Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Б. Витамин С, антискорбутный, аскорбиновая кислота, участие в синтезе коллагена и другие метаболические функции.Содержание книги
Поиск на нашем сайте
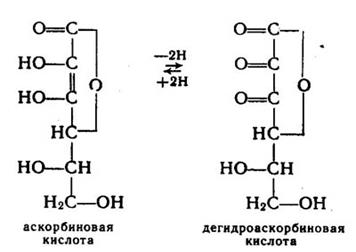
Аскорбиновая кислота является незаменимым компонентом пищи для человека, обезьян, морских свинок, но может синтезироваться у многих других видов животных из глюкозы или глюкуроновой кислоты. В организме аскорбиновая кислота легко окисляется в дегидроаскорбиновую кислоту, которая в присутствии восстановителей также легко превращается в аскорбиновую кислоту.
Рис.5. Химическая структура аскорбиновой кислоты в восстановленной и окисленной форме.
В связи с этим аскорбиновая кислота участвует в ряде окислительно-восстановительных реакций, входя в состав монооксигеназных систем, в частности, в состав пролилгидроксилазы и лизилгидроксилазы, которые обеспечивают окисление боковых радикалов лизина и пролина в составе полипептидных цепей проколлагена и способствуют тем самым ‘‘созреванию’’ коллагена. Биологическая роль витамина С не ограничивается его участием в синтезе коллагена. Он участвует также в реакциях превращения фенилаланина в тирозин, тирозина - в диоксифенилаланин (ДОФА), триптофана - в 5-окситриптамин (cеротонин), в синтезе карнитина, гормонов коры надпочечников и катехоламинов, в обезвреживании токсических веществ эндогенного и экзогенного происхождения в печени, а также в других химических процессах, происходящих с участием монооксигеназных систем. Аскорбиновая кислота способствует выделению железа из ферритина, что очень важно для синтеза гема и предотвращения развития анемии. Недостаточность аскорбиновой кислоты в организме проявляется развитием цинги. Цинга у взрослых характеризуется кровоточивостью и разрыхлением дёсен, расшатыванием зубов, нарушением заживления ран, появлением подкожных кровоизлияний, отёков и болей в суставах, анорексией и анемией. У детей к приведенным выше симптомам добавляются нарушение формирования зубного ряда, замедленное развитие скелета. В основе развития большинства патологических симптомов при цинге лежит нарушение синтеза коллагена. Образующийся при цинге коллаген содержит мало гидроксипролина и гидроксилизина, поэтому в нём образуется недостаточное количество стабилизирующих его структуру связей. В результате коллаген лишается своего основного свойства - прочности. Суточная норма потребления витамина С составляет 50 - 100 мг. Основными пищевыми источниками витамина С являются свежие овощи и фрукты, особенно - цитрусовые. Аскорбиновая кислота разрушается при кипячении и хорошо сохраняется в замороженных фруктах и овощах. 3.2-в. Эластин, особенности аминокислотного состава, структурной организациии и метаболизма. Эластин (тропоэластин)- второй главный белок соединительной ткани, основной структурный компонент эластических волокон. Эластические волокна преобладают в тех структурах, функция которых связана с растяжением и сокращением, изменением объёма: в крупных сосудах, связках, коже, лёгких. Эластин обусловливает эластичность (способность многократно растягиваться в длину и возвращаться в исходное состояние) тех образований, в состав которых он входит. Полипептидные цепи тропоэластина содержат глицин (~30%), много неполярных аминокислот, лизин, мало гидроксипролина, не содержат гидроксилизина. Тропоэластин является гликопротеином с молекулярной массой около 70 КДа. Молекулы тропоэластина соединяются между собой в волокнистые тяжи с помощью связей типа лизиннорлейцина, десмозина и изодесмозина, которые образуются между 2 - 4 полипептидными цепями. В образовании связей типа десмозина участвуют 4 остатка лизина, 3 из которых предварительно окисляются до соответствующих альдегидов с участием медьсодержащего фермента лизилоксидазы, в присутствии витаминов РР и В6, а затем объединяются с четвёртым остатком лизина (рис.6). При недостаточности в организме меди, витаминов РР и В6 образование десмозина нарушается.
Рис. 6. Десмозин.
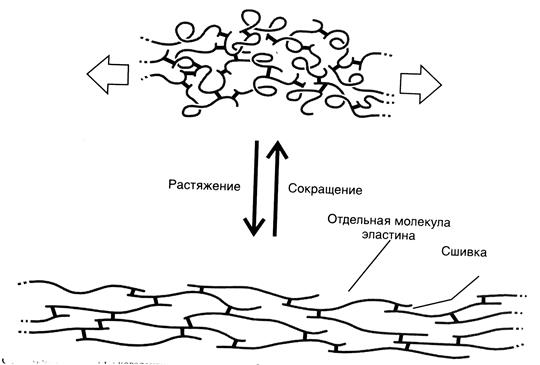
Связи типа десмозина и изодесмозина есть только в эластине. Молекулы тропоэластина не имеют характерной третичной структуры, а обладают случайной гибкой конформацией, множественные пространственные конфигурации которой переходят друг в друга. Наличие случайной гибкой конформации молекул тропоэластина и большого количества поперечных сшивок между ними позволяет эластическим волокнам проявлять свои резиноподобные свойства, т. е. эластичность. При натяжении эластических волокон молекулы тропоэластина в их составе приобретают относительно постоянную конформацию, в результате чего упорядоченность структуры эластических волокон возрастает (см. рис. 7).
Рис.7.Связь молекул эластина между собой в процессе сокращения и растяжения эластических волокон.
В литературе имеются данные о том, что эластические волокна являются двухкомпонентной системой, содержащей помимо эластина гликопротеины иного аминокислотного состава, которые защищают эластические волокна от действия протеаз. Эластин-белок синтезируется в фибробластах и гладкомышечных клетках в виде растворимого предшественника - тропоэластина, а затем полимеризуется, превращаясь в нерастворимую внеклеточную форму в результате образования поперечных связей типа десмозина и изодесмозина. Эластическое волокно характеризуется высокой стабильностью, нерастворимостью в воде, высокой скоростью обмена. Нативные эластические волокна не перевариваются трипсином и химотрипсином, медленно гидролизуются пепсином. Поджелудочная железа выделяет фермент проэластазу, которая активируется трипсином, превращаясь в эластазу. Под действием эластазы нити эластина расщепляются до пептидов, имеющих жёлтый цвет. В тканях эту функцию выполняет тропоэластаза, расщепляющая тропоэластин и не действующая на эластические волокна. В печени синтезируется ингибитор трипсина альфа-антитрипсин, защищающий эластин от избыточного протеолиза. Эластаза синтезируется также макрофагами и полиморфноядерными лейкоцитами (ПЯЛ), она проявляет наибольшую активность в щелочной среде, обладает низкой специфичностью и расщепляет также коллаген, протеогликаны, гемоглобин, иммуноглобулины и другие белки. В норме эластазу ПЯЛ и другие протеазы ингибирует альфа1 антитрипсин, который синтезируется в гепатоцитах и поступает в кровь. Альфа1-антитрипсин синтезируется также макрофагами в лёгких, что обеспечивает защиту альвеол от воздействия эластазы. Деградация эластических волокон при эмфиземе лёгких и других заболеваниях обусловлена повышением активности эластазы лейкоцитарного происхождения. Активность эластазы ПЯЛ в десневой жидкости и тканях пародонта возрастает при пародонтите. Разрушенные эластические волокна не восстанавливаются. Процесс старения сопровождается потерей эластичности тех образований, в состав которых входят эластические волокна, потому что количество поперечных связей в них уменьшается с возрастом, и они становятся более чувствительными к биомеханическим воздействиям. Структура эластических и коллагеновых волокон может нарушаться в патологии. Латиризм (cutis laxa или вялая кожа) - заболевание, связанное со снижением активности лизилоксидазы. Это заболевание может развиться при употреблении в пищу душистого горошка (Lathyrus orodatus), в котором содержится ингибитор лизилоксидазы - b-аминопропионитрил. Под влиянием этого ингибитора нарушается формирование поперечных связей в коллагене и эластине, в результате чего образуется непрочный, растворимый коллаген, снижается эластичность соединительно-тканных образований, в том числе кожи, нарушается развитие скелета. При данной патологии с мочой выделяются пептиды, содержащие гидроксипролин. Недостаточность лизилоксидазы может быть связана с дефицитом ионов меди в организме, так как фермент лизилоксидаза, как отмечалось выше, активен только в присутствии ионов меди. Помимо этого, описаны также формы латиризма, связанные с наследственной, генетически обусловленной недостаточностью фермента лизилоксидазы.
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 285; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.125.137 (0.006 с.) |