Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Волокнистые структуры соединительной ткани.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
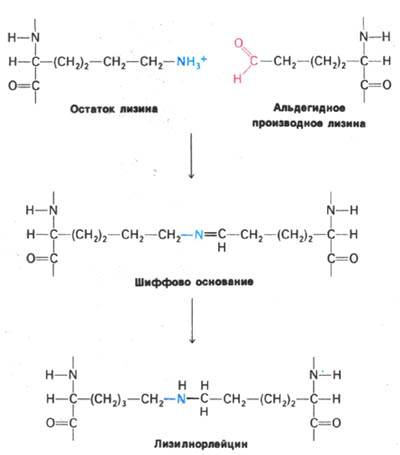
3.2-а. Коллаген. Особенности аминокислотного состава, структурной организации и метаболизма. Волокнистые структуры соединительной ткани представлены коллагеновыми, эластическими и ретикулиновыми волокнами. Главным структурным компонентом коллагеновых и ретикулиновых волокон является белок- коллаген или тропоколлаген. Это самый распространённый белок в организме. Он составляет 6% массы тела и 30% всех белков организма. Основная масса коллагена сосредоточена в минерализованных тканях и коже, около 10% - в строме внутренних органов. Тропоколлаген является структурной единицей коллагенового волокна. Это фибриллярный белок с Мr ~300000, состоящий из трёх однонаправленных полипептидных цепей (по 1000 аминокислот в каждой), закрученных в тройную спираль. Длина молекулы коллагена составляет ~300 нм, толщина - ~1,5 нм. Каждая отдельная цепь тропоколлагена представляет собой плотную левозакрученную альфа - спираль, в которой на один виток приходится три аминокислотных остатка. Каждая третья аминокислота в альфа - спирали представлена глицином, 21% составляют в сумме пролин и гидроксипролин, 11% - аланин, имеются также лизин, гидроксилизин, глютаминовая, аспарагиновая и другие аминокислоты. Последовательность аминокислот в полипептидной цепи тропоколлагена может быть представлена как (-гли-Х-Y-)n, чаще всего - (-гли-про-гип-)n. Гидроксилизин обеспечивает образование поперечных связей и присоединение глюкозы, галактозы или лактозы, гидроксипролин - образование водородных связей (с водой), стабилизирующих альфа - спиральную конфигурацию полипептидных цепей коллагена. Тройная спираль тропоколлагена стабилизируется дисульфидными и водородными связями, возникающими между атомом водорода глицина и атомом кислорода карбонильной группы пептидных связей. При этом глицин оказывается внутри трёхспирального жгута, а три цепи образуют жёсткую структуру, похожую на кабель, слегка закрученную в правую суперспираль. Молекулы коллагена затем ассоциируются в микрофибриллы. Коллагеновая фибрилла представляет собой параллельные ряды молекул тропоколлагена, расположенные так, что каждый следующий ряд сдвинут по отношению к предыдущему на 1/4 длины тропоколлагена. Молекулы тропоколлагена не связаны «конец в конец», поэтому между ними есть промежутки, которые могут служить местом первичного накопления кальция и фосфора при минерализации кости. В процессе филогенеза происходит окислительное дезаминирование остатков лизина и гидроксилизина в составе полипептидных цепей коллагена с образованием альдегидопроизводных лизина. В этой реакции участвует медьсодержащий фермент лизилоксидаза, который активен при наличии витаминов РР и В6. При взаимодействии радикалов лизина с альдегидопроизводными лизина между молекулами тропоколлагена образуются поперечные связи ковалентного характера, которые стабилизируют коллагеновую фибриллу. Образование поперечных сшивок в коллагеновых фибриллах происходит по следующей схеме:
Рис. 2. Образование поперечных сшивок в коллагене.
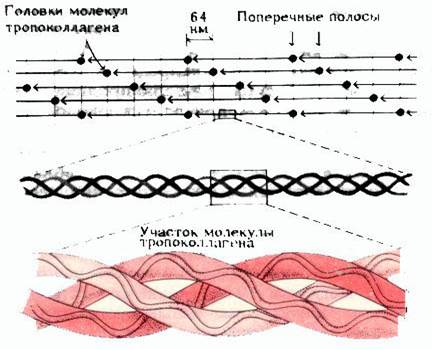
Многократное скручивание обеспечивает высокую прочность коллагенового волокна. Коллаген - белок, как правило, гликозилирован. Глюкоза, галактоза или лактоза присоединяются к остаткам гидроксилизина О-гликозидной связью. Известно 19 типов коллагена, отличающихся друг от друга набором полипептидных цепей (они могут быть идентичными или различными), степенью их гликозилирования и гидроксилирования, а также распределением в организме. Не все типы коллагена образуют фибриллы. К фибриллообразующим относятся коллагены 1,2,3,5 и 11 типов. Наиболее распространён коллаген 1-го типа. Он входит в состав костей, дентина, сухожилий, роговицы. Коллаген 2-го типа распространён в хрящевой ткани, межпозвоночных дисках, в стекловидном теле глаза. Коллагены 5-го и 6-го типов присутствуют в разных соотношениях в межклеточном веществе различных тканей. Коллаген 4-го типа является структурным компонентом базальных мембран. Базальные мембраны - это особый вид межклеточного матрикса, в виде тонкого слоя отделяющий клетки от окружающей соединительной ткани, а также различные слои клеток друг от друга. Базальные мембраны играют роль полупроницаемого фильтра в почечных клубочках, а также участвуют в процессах эмбрионального развития и регенерации. Коллаген 7-го типа входит в состав фибрилл, которые находятся в субэпителиальном слое и участвуют в присоединении эпидермиса к дерме. 9,12,14 и 17 типы коллагенов фибрилл не образуют, но связаны с коллагеновыми фибриллами других типов. Микрофибриллы состоят чаще всего из 5 рядов полипептидных цепей. Вместе с различными гликопротеинами они образуют фибриллы. Молекулы гликопротеинов находятся, как правило, на поверхности фибрилл и защищают их от действия коллагеназы. Схематическое строение коллагеновой фибриллы представлено на рисунке 3.
Рис.3. Схематичное изображение фибриллы коллагена.
Интенсивность обмена коллагена варьирует в зависимости от вида животного, типа ткани, возраста, характера питания, наличия патологии. У взрослого человека в норме коллаген обновляется медленно, а процессы его синтеза и распада сбалансированы. Период полураспада коллагена измеряется неделями, месяцами. Наиболее активно коллаген обновляется в возрасте до 20 лет. Его обмен становится более интенсивным также при некоторых инфекционных заболеваниях, при коллагенозах и гиперпаратиреозе. В детском возрасте скорость синтеза коллагена преобладает над скоростью его распада. При этом увеличивается общая масса коллагена (главным образом, за счёт костной ткани). Известно, что коллагеновые фибриллы в физиологических условиях (нейтральное значение рН среды, температура 37 градусов по Цельсию) устойчивы к действию трипсина, пепсина, лизосомальных и нелизосомальных пептидаз, способных расщеплять только денатурированный коллаген. Катаболизм коллагена - это сложный многоступенчатый процесс, происходящий внутри - и внеклеточно с участием различных пептидаз, глюкозидаз. Ключевую роль в этом процессе играет фермент коллагеназа, расщепляющая все три полипептидные цепи тропоколлагена на расстоянии 1/4 их длины от С-конца между глицином и лейцином (изолейцином). Образовавшиеся фрагменты растворяются в воде и расщепляются далее различными протеазами. Различают два вида коллагеназ: микробные и тканевые. Микробные - вырабатываются микробами и способствуют их проникновению через соединительно-тканные барьеры хозяина. Тканевые коллагеназы имеют оптимум рН 8,5, активны в присутствии ионов цинка (металлозависимые). Они проявляют наибольшую активность в тканях, претерпевающих реорганизацию, например, в матке после родов, а также при некоторых заболеваниях, сопровождающихся деструкцией межклеточного вещества соединительной ткани. Тканевая коллагеназа вырабатывается в виде проколлагеназы, которая переходит в активную форму путём отщепления N-концевого октапептида под действием катепсина D, других протеиназ или аутокаталитически. Активность тканевых коллагеназ контролируется гормонами и ингибиторами. Наиболее изучен т.н. «тканевой ингибитор металлопротеиназ (ТИМП)» - гликопротеид с Мr 28000, постоянно присутствующий в тканях. Активаторами тканевых коллагеназ являются плазмин, калликреин, катепсин В. Микробные коллагеназы расщепляют коллаген более, чем в 200-х участках одновременно, что обусловливает быстрое разрушение соединительно-тканных барьеров и проникновение бактерий вглубь тканей. Продукты расщепления коллагена (пептиды, аминокислоты) выводятся с мочой. Гидроксипролин и пролин являются маркёрами соединительной ткани. За сутки с мочой взрослого человека выводится в норме 15 -20 мг гидроксипролина, а с мочой ребёнка и подростка ~200 мг/сутки. При некоторых заболеваниях, связанных с поражением соединительной ткани, содержание гидроксипролина в сыворотке крови и его экскреция с мочой увеличиваются вследствие повышенного распада коллагена. Это отмечается, в частности, при гиперфункции паращитовидных желёз, переломах трубчатых костей, некоторых опухолях кости, пародонтите, наследственной гипергидроксипролинемии. Последнее заболевание связано с врождённой недостаточностью фермента гидроксипролиноксидазы, который в норме окисляет часть гидроксипролина крови.
Синтез коллагена происходит на рибосомах фибробластов. Сначала синтезируются предшественники полипептидных цепей тропоколлагена, не содержащие гидроксипролина и гидроксилизина - препроколлаген, который состоит из короткого сигнального пептида, двух С - и N концевых пропептидов и центрального сегмента - альфа-цепи. Сигнальный пептид ориентирует синтез полипептидных цепей в полость эндоплазматического ретикулума. Затем происходит посттрансляционная модификация цепей препроколлагена, состоящая из следующих этапов: 1. Отщепление сигнального пептида под действием специфической протеиназы. 2. Превращение остатков пролина и лизина в гидроксипролин и гидроксилизин, соответственно, в составе полипептидных цепей с участием специфических гидроксилаз, альфа-кетоглютарата, молекулярного кислорода, ионов двухвалентного железа и аскорбиновой кислоты в качестве кофакторов (рис. 4).

 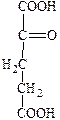  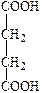
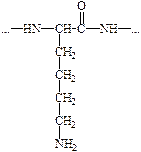  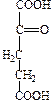 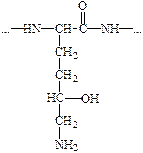 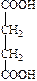
Рис. 4. Гидроксилирование остатков пролина и лизина в составе полипептидных цепей проколлагена.
3. Гликозилирование полипептидных цепей проколлагена - присоединение глюкозы, галактозы или лактозы к ОН - группам гидроксилизина под действием различных гликозилтрансфераз. 4. Образование тройной спирали проколлагена и секреция его в межклеточное пространство, где происходит превращение проколлагена в «зрелый» коллаген (тропоколлаген) путём отщепления N - и С - концевых пептидов во всех полипептидных цепях под действием проколлагенпептидазы. В стабилизации тройной спирали тропоколлагена важную роль играют водородные связи, в образовании которых участвуют ОН-группы гидроксипролина.
Далее происходит полимеризация молекул тропоколлагена в коллагеновые микрофибриллы, в которых между молекулами тропоколлагена образуются поперечные ковалентные связи. В их формировании участвуют радикалы лизина и гидроксилизина, находящиеся в различных полипептидных цепях. Как описано выше, радикалы гидроксилизина окисляются далее медьсодержащей лизилоксидазой, которая в присутствии витаминов В6 и РР превращает их в альдегидные производные лизина. Вновь образованные высокореактивные альдегидные группы образуют с другими остатками лизина ковалентные связи по типу шиффовых оснований: R-CH2-CH2-СН2-CH = N-СН2-CH2-CH2-CH2-R* Пространственная структурная организация коллагеновых фибрилл завершается с участием гликопротеинов типа фибронектина и протеогликанов. Синтез коллагена в клетке регулируется по принципу отрицательной обратной связи. Обмен коллагена контролируется также гормонами. Глюкокортикоиды угнетают синтез коллагена, паратгормон активирует распад коллагена; эстрогены, соматотропин, тироксин активируют синтез коллагена. В процессе синтеза коллагена могут возникать мутации, что обусловливает возможность возникновения наследственных заболеваний, связанных с патологией соединительной ткани. К ним относятся несовершенный остеогенез, хондродисплазии и другие.
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 762; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.46.202 (0.009 с.) |