
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторна робота. Галогени та їх сполукиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте ЗМІСТ
1. Галогени. 4 2. Водень. Кисень. Пероксид водню.. 16 3. Cірка. 26 4. Азот. 38 5. Фосфор. 49 6. Арсен, стибій, бісмут. 55 7. Вуглець, силіцій. 64 8. Олово, свинець. 69 9. Бор, алюміній. 74 10. Лужні метали. 79 11. Берилій, магній та лужноземельні метали. 85 12. Хром, молібден, вольфрам.. 92 13. Манган та його сполуки. 102 14. Підгрупа міді 109 15. Підгрупа цинку. 117 16. Сімейство заліза. 125 Література. 135
Галогени Мета роботи. Ознайомлення з властивостями галогенів, їхніх водневих та кисневих сполук. 1.1. Контрольні питання 1. Чому хлор, бром та йод можуть виявляти ступені окиснення –1, +1, +3, +5, +7, а фтор лише –1? 2. Чому молекули галогенів двохатомні? 3. Чим пояснюється різний агрегатний стан галогенів за стандартних умов? Як змінюється характер зв’язку у ряді простих речовин і чим це підтверджується? 4. Яких застережних заходів необхідно дотримуватися при роботі із фтором, хлором? Яких з перелічених заходів необхідно дотримуватися при роботі з бромом: роботу проводити у витяжній шафі; остерігатися вдихати пари брому; берегти очі від пари; працювати в рукавичках; працювати в окулярах; мати протигаз; у разі вдихання пари брому – нюхати розбавлений розчин аміаку, дихати свіжим повітрям? 5. Розташуйте в ряд у міру збільшення ступеня іонности такі зв’язки: Cl – H, Cl – Cl, Cl – Br, Cl – S, Cl – P. 6. Поясніть, чому менше, ніж у хлору, значення спорідненості до електрону у фтору не суперечить таким фактам: фтор – найактивніший неметал; ефективний заряд атома фтору в сполуках більш негативний, ніж в аналогічних сполуках хлору; зв’язок H – F полярніший, ніж зв’язок H – Cl? 7. Чому деякі реакції з бромом, наприклад, реакція взаємодії брому з порошкоподібним алюмінієм, перебігають енергійніше, ніж з хлором? 8. Чи слушні схеми рівнянь реакцій: Г2 + Н2О = НГ + НГО; Г2 + 2КОН = КГ + КГО + Н2О. для всіх галогенів і при різних температурах? 9. Які хімічні реакції можуть перебігати, якщо через розчин броміду натрію пропустити газоподібний фтор? 10. Чи можна приготувати «фторну воду» аналогічно «хлорній»? 11. Чи відрізняється за хімічними властивостями йод від інших галогенів? Які хімічні реакції характерні лише для йоду? Що представляють собою оксиди IO2 та I4O7? 12. Напишіть рівняння реакції взаємодії фтору з аміаком. Яким буде розчин (кислотним, основним або нейтральним) при додаванні до продуктів реакції води? 13. Розчин солі Мора розділили на три пробірки і додали до них: до 1-ої - хлорну воду; до 2-ої – бромну воду; до 3-ої – суспензію йоду у воді. У яких пробірках перебігатиме реакція? Напишіть рівняння реакцій. 14. Які з наведених нижче схем реакцій лежать в основі промислових і лабораторних методів добування вільних галогенів: 1) 2Г- ® Г2 при електролізі розплаву; 2) 2Г- ® Г2 при електролізі розчину; 3) 2Г- ® Г2 при хімічному окисненні; 4) 2ГО3- ® Г2 при хімічному відновленні? 15. Чому для атомів хлору, брому та йоду більш характерні непарні ступені окиснення, ніж парні? 16. Закінчіть рівняння реакцій: Br2 + KCrO2 + KOH ® K2CrO4 + …, KBr + KMnO4 + H2SO4 ® MnSO4 + …, NaI + K2CrO4 + HCl (розб.) ® CrCl3 + …, Cl2 + FeCl3 + NaOH ® Na2FeO4 + …, I2 + H2SO3 + H2O ® H2SO4 + … 17. Наскільки застосовані до окремих галогеноводнів кожен із загальних принципів їх добування: синтез з простих речовин, дія кислоти на галогеніди металів; гідролітичний розклад галогенідів неметалів? 18. Чи можна пояснити утворенням водневих зв’язків такі факти: водень та фтор реагують в темноті; водень та хлор реагують при освітленні; температури кипіння та плавлення фтороводню вищі, ніж хлороводню; фтористоводнева кислота – слабка кислота, тоді як соляна кислота – сильна; фтористоводнева кислота утворює стійкі дифториди, соляна – стабільних дихлоридів не дає; хлороводень у хімічних реакціях може мати відновні властивості, фтороводень не є відновником? 19. Чому для добування хлороводню користуються концентрованою сірчаною кислотою і твердою кухонною сіллю? Чи можна як вихідні речовини узяти KCl та концентровану азотну кислоту; розчин кухонної солі та розбавлену сірчану кислоту? 20. Який тип хімічного зв’язку має місце у молекулах галогеноводнів, галогенідів лужних металів та оксидів галогенів? 21. Чому формулу фтористоводневої кислоти записують як HF і як H2F2? Чому у водному розчині фтористоводневої кислоти утворюються іони 22. У якому з хлоридів елементів II періоду: LiCl, BeCl2, BCl3, CCl4, NCl3, Cl2O, ClF - зв’язок найменш полярний? 23. Як змінюється міцність хімічного зв’язку у ряді HF-HCl-HBr-HI? Чим це пояснюється? 24. Як змінюються відновні властивості галогеноводневих кислот у ряді HF-HCl-HBr-HI? Наведіть приклади реакцій, що підтверджують відповідь. 25. Напишіть формули оксидів хлору із ступенями окиснення хлору +1, +3, +5, +7 та відповідних кислот. Вкажіть, як послідовно змінюються їхні сила, стійкість та окисні властивості. 26. За яких умов відбувається розпад хлорнуватистої кислоти відповідно до таких схем: а) HClO = HCl + O, б) 2HClO = H2O + Cl2O, в) 3HClO = 2HCl + HClO3? 27. Який склад має хлорна вода? Які процеси відбуваються при додаванні лугу до хлорної води? 28. Порівняйте силу кислот, окиснювальну здатність та стійкість у рядах: а) HClO-HBrO-HIO, б) HClO3-HBrO3-HIO3. 29. Як можна пояснити, що з усіх галогенів один тільки йод утворює багатоосновні кислоти? Задачі 1. При електролізі розчину хлориду калію у катодному просторі утворився гідроксид калію масою 56 г. Який об’єм хлору (н.у.) виділився на аноді? Відповідь: 11,2 л. 2. Для окиснення сульфату заліза (II) масою 3,8 г у присутності сірчаної кислоти було витрачено бромну воду масою 57,5 г. Визначте розчинність брому у воді масою 100 г. Відповідь: 3,6 г. 3. Який об’єм хлору (н.у.) необхідно пропустити крізь розчин йодиду натрію об’ємом 1 л з масовою часткою 10% (густина розчину 1,08 г/см3), якщо внаслідок реакції утворюється: а) йод; б) йодат натрію? Відповідь: а) 8,064 л; б) 48,38 л. 4. Обчисліть масу плавикового шпату, в якому масова частка CaF2 дорівнює 80%, необхідного для добування фтористоводневої кислоти масою 10 кг з масовою часткою 36%. Відповідь: 8,775 кг. 5. Визначте об’єм 0,4 н розчину сульфату мангану, необхідного для реакції у нейтральному середовищі з бертолетовою сіллю, яку добули з хлору об’ємом 2 л (н.у.). Відповідь: 0,45 л. 6. Газ, що утворився після вибуху 10 л суміші хлору з воднем (н.у.), був пропущений крізь надлишок розчину йодиду калію. Для знебарвлення добутого розчину потрібно було додати до нього 250 мл 2 н розчину сульфіту натрію. Скільки літрів водню містилося у початковій газовій суміші? Відповідь: 2,2 л. 7. При нагріванні 24,5 г бертолетової солі частина її розклалася з виділенням кисню, а решта – з утворенням перхлорату калію та інших продуктів. Визначте масову частку перхлорату калію у залишку, якщо виділилося 13,44 л кисню (н.у.). Відповідь: 73,6%. 8. На взаємодію з хлорним вапном витрачено 200 мл 0,5 н розчину пероксиду водню. Визначте об’єм хлору, що пішов на утворення цього хлорного вапна, при температурі 50 оС і тиску 1,4×105 Па. Відповідь: 0,96 л. 9. На реакцію з певною кількістю хлорного вапна витратили розчин йодиду об’ємом 100 мл з еквівалентною концентрацією 0,2 екв.мас/л. Визначте масу активного хлору в узятій пробі хлорного вапна. Відповідь: 0,71 г. 10. Після електролізу розчину хлориду натрію отримали 2 л 0,25 н. розчину NaOH. Газ, який виділився на аноді, пропустили крізь 10% розчин йодиду калію (r = 1,1 г/см3) об’ємом 66 мл. Розчин упарили досуха. Визначте масу залишку. Відповідь: 3,278 г. 11. Розрахувати масову долю (в %) KClO3 в розчині (r = 1,02 г/см3), якщо на взаємодію цього розчину об’ємом 5 мл (у присутності розведеної сірчаної кислоти) витрачено 50 мл розчину сульфата заліза (ІІ) з концентраціюєю 0,12 екв. мас/л. Відповідь: 2,4%. 12. Який об’єм розчину йодної кислоти з масовою долею 5% (r = 1,04 г/см3) потрібен для окиснення розчину йодоводневої кислоти об’ємом 40 мл та масовою долею HI 8% (r = 1,06 г/см3). Обчислити масу йоду, який при цьому виділився. Відповідь: 18,3 мл; 4 г. 1.3. Зразок завдання для поточного контролю
Задачі 1. Один грам цинку взаємодіє з розчином соляної кислоти і така ж маса алюмінію взаємодіє з розчином лугу. У якому випадку виділиться більше водню? Відповідь: у разі Al. 2. Знайдіть масу оксиду міді(II), яку можна відновити воднем, добутим при гідролізі 6,3 г гідриду кальцію. Скільки грамів міді при цьому виділиться? Відповідь: 24 г СuО; 19,2 г Сu. 3. Який об’єм водню, виміряного при 27 oC та тиску 101325 Па, буде потрібний для відновлення оксиду германію(IV) масою 1 г? Відповідь 0,471 л. 4. Скільки по масі перманганату калію, в якому масова частка домішок дорівнює 4%, слід узяти для добування кисню об’ємом 2,5 л при 37 оС і тиску 1,0133.105 Па? Відповідь: 32,35 г. 5. При пропусканні крізь розчин йодиду калію озонованого кисню об’ємом 10 л (н.у.) виділився йод масою 2,54 г. Обчисліть об’ємну частку (%) озону в озонованому кисні. Відповідь: 2,24 %. 6. Скільки літрів кисню (н.у.) знадобиться для окиснення до азотної кислоти 92 г оксиду азоту(IV)? Скільки грамів розчину азотної кислоти з масовою часткою 50% при цьому вийде? Відповідь: 11,2 л О2; 252 г розчину. 7. Чи вистачить для окиснення 3,1 г фосфору до оксиду фосфору(III) кисню, добутого при взаємодії 8,7 г піролюзиту з концентрованою сірчаною кислотою? Відповідь: не вистачить. 8. Яку масу літію, натрію та калію можна окиснити однаковим об’ємом кисню? Як відносяться маси окиснених металів між собою? Відповідь: 28:46:39. 9. Знайдіть масу тіосульфату натрію, яка знадобиться для розчинення йоду, що утворився при взаємодії 62 мл 10%-ного розчину йодиду калію (r = 1,076 г/см3) з надлишком розчину H2O2 у кислому середовищі. Відповідь: 6,35 г. 10. Обчисліть об’єм кисню (н.у.), який можна добути при взаємодії 15,8 г KMnO4 з надлишком розчину пероксиду водню у кислому середовищі, якщо дослід проводиться при температурі 20 оС і тиску 102825 Па. Відповідь: 5,9 л О2. 11. Скільки мілілітрів 24%-ного розчину соляної кислоти (ρ = 1,119 г/см3) знадобиться для нейтралізації розчину гідроксиду натрію, що утворився при гідролізі 7,8 г пероксиду натрію? Відповідь: 27,2 мл. 12. До розчину сульфату мангану об’ємом 50 мл з концентрацією 0,2 н. додали надлишок розчину пероксиду водню з масовою долею Н2О2 3% (r = 1,012 г/см3). Реакція проходила у слабколужному середовищі. До отриманого в результаті реакції осаду (який попередньо промили водою) додали концентровану хлороводневу кислоту. Який газ і в якому об’ємі був отриманий? Який об’єм 3% розчину Н2О2 прореагував?. Відповідь: VCl2= 0,224 л; VH2O2= 11,2 мл. 2.3. Зразок завдання для поточного контролю
2.4. Лабораторна робота. Водень. Кисень. Пероксид водню Дослід 1. Добування водню При роботі з воднем необхідно дотримуватися обережності. Водень з повітрям, з чистим киснем, а також із хлором, фтором та іншими речовинами утворює вибухові суміші. Активність водню особливо підвищується при нагріванні. При дослідах з воднем не можна запалювати водень, що виходить з приладу, не переконавшись заздалегідь у його чистоті, інакше вибух може відбутися усередині приладу і розірвати його. Щоб переконатися у чистоті водню, що виділяється, необхідно після витіснення повітря з приладу наповнити суху пробірку воднем протягом 10-15 сек. Тримаючи пробірку з воднем догори дном, піднесіть її до полум’я пальника далеко від приладу з воднем і підпаліть зібраний газ. Якщо при підпалі відбувається різке хлопання, значить, водень змішаний із повітрям. Проводіть, міняючи пробірку, перевірку чистоти водню, що виділяється, доти, поки зібраний газ не спалахуватиме майже без звуку. Тільки переконавшись у чистоті водню, що виділяється, його можна нагріти і підпалити. Добування водню при взаємодії металу та кислоти. · Як перевірити водень, що виділяється, на чистоту? Переконавшись, що з приладу йде чистий водень, запаліть його біля отвору відтягнутої трубки. Потримайте якийсь час над полум’ям водню суху пробірку. Що утворюється на стінках пробірки? Напишіть рівняння реакцій добування водню, горіння водню. · Чи утвориться водень при взаємодії цинку або заліза з концентрованою сірчаною кислотою? Добування водню при взаємодії алюмінію та лугу. До пробірки налийте 1‑2 мл розчину їдкого натру з масовою часткою NaOH 10% та помістіть шматочок алюмінію. Закрийте отвір пробірки пробкою з відвідною трубкою (рис. 4). Зберіть газ, що виділяється, у пробірку і перевірте його на чистоту. Піднесіть до відвідної трубки сірник, що горить, і підпаліть газ, що виділяється. Напишіть рівняння реакції взаємодії алюмінію з розчином лугу з утворенням водню і тетрагідроксоалюмінату натрію. · Яка роль лугу в процесі взаємодії NаOH з алюмінієм? Дослід 2. Властивості водню
Порівняння відновних властивостей молекулярного та атомарного водню. Налийте до пробірки 0,5-1 мл розчину перманганату калію та 2-3 краплі розчину сірчаної кислоти (1:1). До другої пробірки помістіть 0,5-1 мл розчину хлориду заліза(III), 2 краплі сірчаної кислоти (1:1) та 1 краплю розчину роданіду калію або амонію та спостерігайте появу інтенсивного червоного забарвлення. Крізь розчини у кожну пробірку пропустіть водень. Чи зміниться забарвлення розчину? До обох пробірок внесіть по шматочку цинку. Що відбувається у пробірках з розчинами KMnO4 та FeCl3 при дії молекулярного та атомарного (у момент виділення) водню? Напишіть рівняння реакцій. · У якому стані – молекулярному або атомарному – водень є активнішим відновником? Дослід 3. Добування кисню Розклад пероксиду барію. Помістіть до пробірки близько 0,5 г пероксиду барію, укріпіть пробірку в штативі вертикально та нагрійте її у полум’ї пальника. Випробуйте газ, що виділяється, тліючою скіпкою. Напишіть рівняння реакції. Розклад перманганату калію. Помістіть до пробірки близько 0,25 г кристалів KMnO4, укріпіть пробірку в штативі вертикально та підігрійте полум’ям пальника. Напишіть рівняння реакції. · Як довести виділення кисню? Розклад хлорату калію (бертолетової солі). Помістіть до пробірки близько 0,5 г кристалів KClO3, укріпіть пробірку в штативі вертикально та нагрійте до повного розплавлення солі. · Які температури плавлення та розкладу має бертолетова сіль? Випробуйте тліючою скіпкою, чи виділяється кисень. Відсуньте пальник, внесіть до розплавленої солі на кінчику шпателя, заздалегідь прожареного діоксиду мангану та знову підігрійте пробірку. Випробуйте газ, що виділяється, тліючою скіпкою. Напишіть рівняння реакцій розкладу бертолетової солі у присутності та у відсутності діоксиду мангану. Для очищення кисню від домішок (слідів хлору, діоксиду азоту, озону, пари води тощо) його пропускають крізь промивну склянку з розчином лугу, який затримує всі супроводжуючі його леткі сполуки кислотного характеру; крізь розчин йодиду калію для звільнення від озону; крізь концентровану сірчану кислоту, яка поглинає пари води. · Навіщо необхідно прожарювати діоксид мангану? Яку роль відіграє діоксид мангану в цій реакції? Cірка Мета роботи. Ознайомлення з властивостями сірки та деяких її сполук. Встановлення окисно-відновної здатності залежно від ступеня окиснення сірки. 3.1. Контрольні питання 1. Як змінюються потенціал іонізації та спорідненість до електрону у ряді S – Se – Te – Po? Чим це пояснюється? 2. Охарактеризуйте можливі валентні стани та ступені окиснення р-елементів VI групи з урахуванням електронної конфігурації зовнішнього шару атомів. 3. Чим пояснити схильність сірки до утворення гомоланцюгів, що мало характерне для кисню? 4. Поясніть закономірність у зміні температур плавлення та кипіння простих речовин у ряді кисень – полоній. Чому температури плавлення та кипіння сірки значно вищі від відповідних температур для кисню? Чому при переході від фтору до хлору не спостерігається такої сильної відмінності у температурах плавлення та кипіння? 5. Чому швидкість взаємодії багатьох речовин із сіркою вища, ніж з киснем, хоча кисень є сильнішим окисником? 6. Порівняйте окисно-відновні властивості халькогеноводнів у газоподібному стані та у водних розчинах. Чи можуть вода та сірководень виступати у ролі окисників? 7. Як змінюються (зменшуються або збільшуються) а) кислотно-основні, б) окисно-відновні властивості у ряді сполук H2O – H2S – H2Se – H2Te? Відповідь підтвердіть прикладами. 8. Чи можна для добування сірководню використовувати реакції взаємодії сульфідів з азотною кислотою; оцтовою кислотою? 9. Які з наведених осушувачів можна використовувати для осушення сірководню: а) концентрована сірчана кислота; б) твердий луг; в) безводний хлорид кальцію? 10. Чи гідролізуються такі солі: CaS, KHS, Na2Se, CuS, HgS? Як залежить здатність до гідролізу цих солей від їхньої розчинності? 11. Які з сульфідів: Al2S3, Cr2S3, Na2S, ZnS, PbS, FeS у розчині гідролізуються? Які з перелічених сульфідів можуть бути добуті шляхом обмінної реакції у водному розчині? 12. Як пояснити, що сполуки сірки складу H2Sn (n>2) стійкіші, ніж аналогічні сполуки кисню, селену та телуру? 13. Як здійснити такі перетворення: S ® H2S ® (NH4)2S ® (NH4)2Sn ® H2Sn ® H2S ® S. 14. Які з перелічених сульфідів: ZnS, Bi2S3, Cu2S, FeS, Cr2S3, MnS, PbS, Al2S3 можна використовувати для добування сірководню? Які з наведених сульфідів можна добути у водному розчині осадженням сірководневою кислотою, які осадженням сульфідом амонію і які лише «сухим» шляхом? 15. Якими властивостями з погляду окисно-відновної здатності має персульфід водню? Відповідь підтвердіть прикладами. Персульфід чи пероксид водню є сильнішим окисником? 16. Напишіть графічні формули оксидів сірки(IV) та (VI). Покажіть характер хімічних зв’язків, тип гібридизації. 17. Поясніть, чому у ряді SO2 – SeO2 – TeO2 – PoO2 зменшуються кислотні властивості. Як змінюються в цьому ряді окисно-відновні властивості? 18. Опишіть хімічні властивості оксидів сірки(IV) та (VI). Покажіть їхню відмінність, використовуючи уявлення про будову молекул. 19. Які властивості, окисні чи відновні, виявляє сірчиста кислота при її взаємодії: а) з магнієм, б) із сірководнем, в) з йодом? Який з іонів, що входять до її складу, зумовлює ці властивості у кожному з вказаних випадків? 20. Складіть схему рівноваг, що встановлюються у водному розчині оксиду сірки(IV). Як зміниться положення рівноваги: а) при нагріванні розчину; б) при додаванні лугу; в) при додаванні сульфіту натрію? 21. Чи можна для осушення оксиду сірки(IV) використовувати концентровану сірчану кислоту, луг, натронне вапно? 22. Напишіть графічну формулу сірчаної кислоти. Вкажіть характер хімічних зв’язків, тип гібридизації, координаційне число сірки. 23. У чому полягає принципова відмінність у механізмі взаємодії розбавленої та концентрованої сірчаної кислоти з металами? Наведіть приклади рівнянь відповідних реакцій. 24. Чим пояснюється сильна дегідратуюча дія концентрованої сірчаної кислоти? 25. Олеум перевозять у залізних цистернах. Чи можна замінити їх свинцевими? Чому олеум не розчиняє залізо? 26. Яка природа зв’язку в гідратах H2SO4.nH2O? 27. Які солі називаються: а) купоросами? б) галунами? Наведіть приклади. Що таке «купоросне масло»? 28. Як можна пояснити, що селенова кислота має більш сильно виражені окиснювальні властивості, ніж сірчана та телурова? Порівняйте їхнє відношення до концентрованої соляної кислоти. 29. Що таке рідина Вакенродера? Наведіть приклади рівнянь реакцій утворення кислот, що містяться у рідині Вакенродера. 30. Наведіть приклади реакцій добування тритіонату натрію та тритіонової кислоти. 31. Як змінюються кислотні властивості та окисно-відновні властивості кисневмісних кислот халькогенів зверху вниз по підгрупі а) для ступеня окиснення +4; б) для ступеня окиснення +6? Відповідь підтвердіть прикладами. 32. Наведіть три способи добування селенової кислоти. Напишіть рівняння реакцій різних методів добування телурової кислоти. 33. Які процеси відбуваються при нагріванні кристалічних речовин на повітрі: а) FeSO4, б) FeSO4·7H2O, в) NaHSO4, г) Na2SO4·10H2O? Чи відрізняються за характером від розглянутих процеси, що перебігають при нагріванні цих солей в атмосфері азоту? 34. Охарактеризуйте загальні умови утворення дисірчаної (піросірчаної) кислоти. 35. Закінчіть рівняння реакцій: Na2SO3 + Na2S + H2SO4 ®, K2SO3 + KMnO4 + H2SO4 ®, H2SO4 + Mg ® H2S + … 36. Як розрізнити такі солі: Na2S, Na2SO3, Na2S2O3, Na2S2O8, Na2SO4? 37. Порівняйте стійкість H2SO4 та H2S2O3, H2SO4 та H2SO5. Як позначається на стійкості сполук заміна атома кисню в іоні SO42- на атом сірки або групу O2-? 38. Закінчіть рівняння реакцій: Na2S2O3 + I2 ® Na2S2O3 + Cl2 (нестача)® Na2S2O3 + Cl2 (надлишок)® BaS2O6 + H2SO4® Задачі 1. Який об’єм сірководню необхідно пропустити крізь розчин сульфату міді масою 200 г з масовою часткою CuSO4 8%, щоб повністю осадити мідь у вигляді сульфіду міді? Відповідь: 2,24 л. 2. Для поглинання всього хлору, що міститься у суміші з азотом об’ємом 2 л (н.у.), було потрібно 3,16 г тіосульфату натрію. Визначте об’ємні частки (у %) газів у суміші. Відповідь: 89,6 % Cl2; 10,4 % N2. 3. Який об’єм повітря, приведений до нормальних умов, потрібний для випалення 5 т піриту, в якому масова частка FeS2 дорівнює 70 %? Відповідь: 8556 м3. 4. До розчину, що містить 5 г оксиду сірки (IV), додали бром масою 10 г. Чи залишиться у розчині бром? Відповідь: ні. 5. Розрахуйте еквівалентну концентрацію сірководневої кислоти, якщо при пропусканні оксиду сірки (IV) крізь її розчин об’ємом 1 л виділилася сірка масою 3 г. Відповідь: 0,125 екв.мас/л. 6. До простої речовини, що утворилася внаслідок взаємодії 2,68 л сірководню та 1,12 л (н.у.) оксиду сірки (IV), додали гарячий концентрований розчин лугу. Добутий прозорий розчин підкислили до кислої реакції та додали до нього розчин KMnO4 до утворення світло-жовтого осаду. Який об’єм 0,5 н розчину KMnO4 витратився в окисно-відновній реакції? Відповідь: 0,6 л. 7. Який об’єм 1 н розчину BaCl2 знадобиться для осадження сульфат-іонів, що утворюються при взаємодії 4,26 г трисульфіду натрію з 0,5 кг розчину хлорату натрію з w =2,5 %? Відповідь: 0,18 л. 8. Персульфат калію масою 5,4 г сплавили з нітратом срібла у присутності КОН. Скільки кисню (н.у.) виділиться при прожарюванні продуктів реакції? Яку масу сірки можна окиснити цим киснем? Скільки мл 20%-ної сірчаної кислоти (ρ = 1,139 г/см3) можна добути надалі з обчисленої кількості сірки? Відповідь: 0,896 л О2; 1,28 г S; 17,2 мл H2SO4. 9. Наважку суміші піриту та кіноварі масою 12 г, що містить 45% піриту, розчинили у «царській горілці». Скільки грамів сірчаної кислоти міститиметься у продуктах реакції? Як відокремити сульфат-іон? Скільки мілілітрів концентрованої азотної кислоти (68%, ρ = 1,405 г/см3) та концентрованої соляної кислоти (40%, ρ = 1,198 г/см3) знадобиться для розчинення? Відповідь: 11,6 г H2SO4; 19,8 мл HNO3(конц.); 14,6 мл HCl (конц.). 10. Сульфіт натрію масою 12,6 г прогріли кілька годин при температурі близько 600 оС. До продуктів реакції, після нагрівання у присутності Н2SO4 та подальшого охолодження до кімнатної температури, додали розчин KMnO4 з концентрацією 0,2 н. Внаслідок реакції випав осад речовини світло-жовтого кольору. Яка це речовина і скільки її утвориться? Обчисліть об’єм розчину, необхідний для реакції. Відповідь: 0,8 г сірки; 0,25 л розчину KMnO4. 11. Визначте об’єм сірководню, який необхідно пропустити (н.у.) крізь 100 мл підкисленого розчину перманганату калію з еквівалентною концентрацією 0,12 н для повного знебарвлення розчину. Обчисліть масу осаду. Відповідь: 134,4 мл H2S; 0,194 г S. 3.3. Зразок завдання для поточного контролю
Азот Мета роботи. Ознайомлення з добуванням та властивостями азоту, його водневих та кисневих сполук. 4.1. Контрольні питання 1. Яка речовина утворюється при пропусканні азоту над розжареним магнієм та як вона взаємодіє з водою? 2. Наведіть структурну формулу іона амонію. Назвіть донорні та акцепторні центри. 3. Яка рівновага існує у водному розчині аміаку? Як вона буде зсуватися при додаванні: кислоти, лугу, хлориду амонію? 4. Наведіть приклади реакцій термічного розкладу солей амонію летких кислот, нелетких кислот, кислот-окисників. У чому полягає відмінність термічної дисоціації від електролітичної? 5. Як взаємодіють: а) гідразин з йодом; б) гідроксиламін з йодом у лужному розчині; в) гідроксиламін з підкисленим розчином перманганату калію; г) гідроксиламін з підкисленим розчином сульфату заліза(ІІ)? Складіть рівняння реакцій і покажіть, які властивості гідразину та гідроксиламіну вони підтверджують. 6. Напишіть рівняння реакцій добування хлораміну. Які властивості має ця речовина та де її використовують? 7. У яких випадках водний розчин аміаку не можна застосовувати для кількісного осадження важкорозчинних гідроксидів? Наведіть приклади та дайте необхідні пояснення. 8. Які з оксидів азоту взаємодіють з водою та розчином лугу? Напишіть рівняння реакцій. 9. Як відрізнити оксид азоту(І) від кисню? 10. Що відбувається при охолодженні оксиду азоту(IV)? Поясніть явище, яке відбувається, використовуючи принцип Ле-Шательє. 11. Закінчіть рівняння реакцій за участю солей азотистої кислоти: K2Cr2O7 + KNO2 +H2SO4 KMnO4 + KNO2 + H2SO4 KI + KNO2 + H2SO4 Na2S + NaNO2 + H2SO4 Які з наведених реакцій підтверджують окисні властивості солей азотистої кислоти, а які - відновні? 12. Що відбувається при тривалому стоянні розчину нітриту калію на повітрі? 13. Які реакції відбуваються при пропусканні у водний розчин сульфату заліза(II) оксиду азоту(II), оксиду азоту(IV)? Чи впливають відносні кількості реагентів на склад продуктів реакцій? 14. Складіть рівняння реакцій окиснення сірки, фосфору, вуглецю концентрованою азотною кислотою. 15. Як взаємодіє концентрована та розбавлена азотна кислота з магнієм, залізом, сріблом? Напишіть рівняння реакцій. 16. Чому не можна зберігати концентровану азотну кислоту: а) на світлі; б) у щільно закритій склянці? 17. Складіть рівняння термічного розкладу нітрату натрію, нітрату міді(ІІ), нітрату срібла. 18. Закінчіть рівняння реакцій: Cr2O3 + KNO3 + KOH C + KNO3 Pb + KNO3 Які властивості має нітрат калію? 19. Напишіть рівняння реакції гідролізу хлористого нітрозилу. До якого класу сполук належить хлористий нітрозил? 20. Чому «царська горілка» сильніший окисник, ніж азотна кислота? Складіть рівняння реакції взаємодії золота з «царською горілкою». 21. Чи відрізняється за складом газ, добутий пропусканням повітря, очищеного від вуглекислого газу, крізь трубку з розжареними мідними ошурками, від газу, добутого розкладом нітриту амонію? Дайте необхідні пояснення. 22. Яке середовище мають розбавлені водні розчини: а) нітрату калію, б) нітриту калію, в) нітрату амонію, г) нітриту амонію? Відповідь обґрунтуйте. 23. Необхідно розчинити наважку металу в азотній кислоті. В якому випадку витратиться менше кислоти: при використанні концентрованої чи розбавленої? Відповідь обгрунтуйте. Чи має значення те, який метал реагує з кислотою? 24. До трьох пробірок налили дуже розбавлений розчин азотної кислоти. До першої долили еквівалентну кількість розчину лугу для нейтралізації кислоти, до другої - надлишок лугу. Потім до усіх трьох пробірок всипали трохи цинкового порошку. Які хімічні реакції відбуватимуться? Напишіть рівняння реакцій. Чим можна пояснити різну взаємодію речовин у виготовлених реакційних сумішах? 25. Складіть рівняння реакцій термічного розкладу нітратів мангану(II), заліза(II), амонію. Як пояснити специфічний характер перетворень цих солей при нагріванні? Задачі 1. Скільки було взято нітриту натрію та розчину NH4Cl з мас. часткою 25% (r = 1,07 г/см3) для добування 3,5 л азоту (t = 17°С, p = 756 мм рт.ст.)? Відповідь: 10,10 г; 29,3 мл. 2. Нітрид металу масою 0,3565 г реагує з водою. На нейтралізацію продуктів, що утворилися, витрачено 56,5 мл розчину соляної кислоти з молярною концентрацією еквіваленту 0,5 моль/л. Чим є цей нітрид – нітридом магнію чи нітридом кальцію? Відповідь: Mg3N2. 3. Змішані 30 г хлориду амонію та 45 г гідроксиду кальцію. Який об’єм аміаку виділиться при цьому (н.у.)? Відповідь: 12,56 л. 4. При синтезі аміаку з елементів рівноважні концентрації дорівнювали: [N2] = 0,3 моль/л; [NH3] = 0,4 моль/л. Визначте вихідні концентрації азоту та водню. Відповідь: 0,5 моль/л N2 та 1,5 моль/л H2. 5. Розчинності NН4С1 та NaNO2 становлять відповідно 27,1 г та 45,8 г на 100 г розчину. Визначте, скільки грамів насичених при 20°С розчинів солей треба змішати для добування 2 л азоту (при 101,3 кПа). Відповідь: 16,4 г розчину NН4С1 та 12,7 г розчину NaNO2. 6. При температурі 90°С густина оксиду азоту(IV) за воднем дорівнює 27,6. Обчисліть мольну частку (%) полімеризованого оксиду азоту(IV). Відповідь: 20%. 7. Після пропускання оксиду азоту над розжареною міддю доважка приладу становила 0,278 г. При цьому було зібрано 420 мл азоту, виміряного при 20 0С і тиску 100,79 кПа. Яку формулу має цей оксид? Відповідь: N2O. 8. Який об’єм (мл) 0,2 н розчину нітриту калію необхідний для відновлення у кислому середовищі 50 мл 0,15 н розчину перманганату калію? Відповідь: 37,5 мл. 9. Який об’єм аміаку (л), виміряний за нормальних умов, потрібний для добування розчину азотної кислоти
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1083; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.016 с.) |

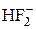 , а не H2F+?
, а не H2F+? До пробірки помістіть шматочок цинку (або заліза) та налийте 1-2 мл розбавленого розчину соляної або сірчаної кислоти. Закрийте отвір пробірки пробкою з відвідною трубкою (кінчик відвідної трубки повинен бути відтягнутий) і укріпіть пробірку вертикально у штативі (рис. 4). Перевірте водень, що виділяється, на чистоту!
До пробірки помістіть шматочок цинку (або заліза) та налийте 1-2 мл розбавленого розчину соляної або сірчаної кислоти. Закрийте отвір пробірки пробкою з відвідною трубкою (кінчик відвідної трубки повинен бути відтягнутий) і укріпіть пробірку вертикально у штативі (рис. 4). Перевірте водень, що виділяється, на чистоту! Відновлення воднем оксиду міді(II). Зберіть прилад, як показано на рис. 5. Невелику кількість оксиду міді(II) помістіть тонким шаром до зігнутої скляної трубки, закріпленої у гумовій пробці. Колбу місткістю 100-150 мл закріпіть у лапці штативу, налийте до неї 10-20 мл розчину сірчаної кислоти з молярною концентрацією 2 моль/л. Внесіть до колби 2-3 шматочки цинку та закрийте її пробкою з трубкою, до якої був поміщений оксид міді. Випробуйте водень, що виділяється, на чистоту. Через 2-4 хвилини, коли повітря з приладу буде витиснене воднем, нагрійте трубку з оксидом міді слабким полум’ям пальника. Як зміниться колір осаду? Аналогічним чином проведіть в цьому ж приладі відновлення воднем оксиду заліза(III). Напишіть рівняння реакцій.
Відновлення воднем оксиду міді(II). Зберіть прилад, як показано на рис. 5. Невелику кількість оксиду міді(II) помістіть тонким шаром до зігнутої скляної трубки, закріпленої у гумовій пробці. Колбу місткістю 100-150 мл закріпіть у лапці штативу, налийте до неї 10-20 мл розчину сірчаної кислоти з молярною концентрацією 2 моль/л. Внесіть до колби 2-3 шматочки цинку та закрийте її пробкою з трубкою, до якої був поміщений оксид міді. Випробуйте водень, що виділяється, на чистоту. Через 2-4 хвилини, коли повітря з приладу буде витиснене воднем, нагрійте трубку з оксидом міді слабким полум’ям пальника. Як зміниться колір осаду? Аналогічним чином проведіть в цьому ж приладі відновлення воднем оксиду заліза(III). Напишіть рівняння реакцій.



