
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 15. Молібденова та вольфрамова кислотиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
а) Добування молібденової кислоти та вивчення її властивостей. До двох пробірок з насиченим розчином молібдату амонію (0,5 мл) додайте краплями одну з концентрованих сильних кислот: соляну, азотну або сірчану – до утворення осаду молібденової кислоти. Потім до першої пробірки з осадом долийте краплями розчин гідроксиду натрію, до другої – надлишок концентрованої кислоти до розчинення осаду. Другу пробірку злегка нагрійте на водяній бані. Напишіть рівняння реакцій. · Які іони утворює молібден(VI)? · Напишіть рівняння дисоціації молібденової кислоти. В якому напрямку переважно зміщена рівновага у цій системі? б) Добування вольфрамової кислоти. Налийте до двох пробірок по 1 мл насиченого розчину вольфрамату натрію або амонію. До однієї пробірки додайте краплями розчин хлороводневої кислоти (2 моль/л), а іншу трохи нагрійте на водяній бані. Спостерігайте випадіння осадів та порівняйте їхній колір. Напишіть рівняння реакцій. Дослід 16. Солі молібденових та вольфрамових кислот Добування тіосолі та сульфіду молібдену(VІ). Налийте до пробірки 1 мл молібдату амонію та додайте краплями розчин полісульфіду до темно-червоного забарвлення, характерного для тіомолібдату амонію. До добутого розчину долийте кілька крапель розчину сірчаної кислоти до утворення осаду трисульфіду молібдену. Який колір має осад? Напишіть рівняння реакцій. · Поясніть, з якою метою іон Дослід 17. Відновлення сполук молібдену(VI) та вольфраму(VI) а) Відновлення молібдату амонію. Налийте до двох пробірок по 1-2 мл розчину молібдату амонію, підкисліть кількома краплями концентрованої хлороводневої кислоти та додайте до однієї 1-2 шматочки цинку, до другої 1-2 мл хлориду олова(ІІ) до зміни забарвлення розчину. Порівняйте хід реакції в пробірках. б) Відновлення сполук вольфраму(VI) до низьких ступенів окиснення. До насиченого розчину вольфрамату натрію додайте 2-3 шматочки цинку та кілька крапель концентрованої хлороводневої кислоти. Спостерігайте поступову зміну забарвлення внаслідок відновлення вольфраму(VI) до нижчих ступенів окиснення. Кілька кристалів вольфрамату натрію, розтертих у порошок, покладіть на перегорнуту кришку фарфорового тиглю, змочіть 1-2 краплями концентрованої хлороводневої кислоти та додайте 1-2 кристали хлориду олова(ІІ). Зафіксуйте появу синього забарвлення внаслідок відновлення вольфрамату.
Манган та його сполуки
Мета роботи. Ознайомлення з хімічними властивостями мангану та його сполук. Встановлення залежності властивостей сполук мангану від ступеня його окиснення. 13.1. Контрольні питання 1. В якому з природних мінералів – МnO2 (піролюзит) чи MnCO3 (родохрозит) – масова частка мангану більша? Відповідь підтвердіть розрахунками. 2. Напишіть рівняння реакцій, що відповідають такій послідовності перетворень: Mn → Х1 → Mn(NO3)2 → X2 → K2MnO4 → X3 → Mn. 3. Наведіть графічні формули гаусманіту та брауніту та вкажіть, до якого класу сполук належать ці речовини. 4. Назвіть сполуки: Mn(OH)2, Mn(OH)3, Mn(OH)4. Як змінюється характер дисоціації цих сполук у водних розчинах? Яка сіль сильніше гідролізується: MnSO4 чи Mn(SO4)2? Чому? 5. Закінчіть рівняння реакцій: MnCl2 + KOCl + KOH MnSO4 + NaNO3 + Na2СО3 Які властивості солей мангану підтверджуються у наведених рівняннях? Розрахуйте еквіваленти Mn2+ в цих реакціях. 6. Закінчіть рівняння реакцій та розставте коефіцієнти електронно-іонним методом: MnO2 + NaI + H2SO4 MnO2 + KClO3 + NaOH 7. Закінчіть рівняння реакцій: К2MnO4 + KI + H2O К2MnO4 + CaOCl2 + H2SO4 На які властивості манганату калію вказують наведені реакції? 8. До якого типу окиснювально-відновних реакцій можна віднести реакцію розкладу манганистої кислоти? 9. Як ступінь відновлення мангану(VI) залежить від середовища? 10. В якому середовищі - кислому, нейтральному чи лужному - краще виражені окисні властивості перманганату калію? Відповідь підтвердіть відповідними рівняннями реакцій. 11. Запишіть рівняння реакції окиснення сульфату заліза(ІІ) розчином перманганату калію у нейтральному та кислому середовищах. Задачі 1. Внаслідок прожарювання еквімолярної суміші нітрату, оксиду та фториду Mn(II) маса суміші зменшилася на 9,2 г. Визначте масу вихідної суміші, якщо масова частка металу в ній становить 48,1%. Відповідь: 34,3 г. 2. Після нагрівання 11,6 г перманганату калію утворилося 10,42 г твердої суміші. Який максимальний об’єм хлору (н.у.) можна добути дією на утворену суміш соляної кислоти з масовою часткою хлороводню 36,5% (густина 1,187 г/см3)? Який об’єм кислоти витрачено? Відповідь: 2,49 л Сl2; 37,11 мл розчину HCl.
3. Кисень, що виділився при розкладі перманганату калію, повністю використали на перетворення оксиду мангану(IV) на манганат калію у лужному середовищі. Визначте масу манганату калію, що утворився, якщо для його добування витратили 75 мл розчину (густина 1,2 г/см3) гідроксиду калію з масовою часткою КОН 22%. Відповідь: 34,8 г K2MnO4. 4. Знайдіть масу феромангану (w = 84% мангану), яку необхідно взяти для добування 5 т манганової сталі, що містить 15% мангану? Відповідь: 892,86 кг. 5. Яку масу оксиду мангану(IV) необхідно взяти для добування 5 л хлору, виміряного при температурі 20°С та тиску 100,8 кПа? Відповідь: 18 г. 6. Яка маса персульфату амонію необхідна для окиснення 50 мл 0,1 н розчину сульфату мангану(II)? Відповідь: 0,66 г. 7. Які об’єми 5%-них розчинів сульфату мангану(II) (r = 1,06 г/см3) та перманганату калію (r = 1,04 г/см3) необхідно змішати для добування 5 г оксиду мангану(IV)? Відповідь: 98,1 мл; 69,2 мл. 8. Яку масу перманганату калію необхідно взяти, щоб добути 2,7 л кисню, виміряного при температурі 20°С та тиску 100,8 кПа? Відповідь: 35,3 г. 9. Скільки необхідно піролюзиту (80% оксиду мангану(IV)) та гідроксиду калію для добування манганату калію шляхом сплавлення, з якого окисненням за допомогою хлору можна добути 100 г перманганату калію? Відповідь: 68,83 г піролюзиту та 70,88 г КОН. 10. Який об’єм (мл) SO2, виміряного за нормальних умов, потрібно пропустити крізь 200 мл 0,1 н розчину перманганату калію, підкисленого сірчаною кислотою, для його повного знебарвлення? Відповідь: 0,224 л. 11. На титрування у кислому середовищі розчину, що містить наважку 0,2 г сульфату заліза(ІІ), витрачено 11 мл 0,1 н розчину перманганату калію. Знайдіть мас. частку (%) домішок сульфату заліза(ІІІ), що містяться в наважці. Відповідь: 15,4%. 13.3. Зразок завдання для поточного контролю
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 442; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.254.202 (0.008 с.) |

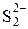 вводять при добуванні сульфіду молібдену(VІ).
вводять при добуванні сульфіду молібдену(VІ).

 ; 4) KMnO4(розч) + H2S ®
; 4) KMnO4(розч) + H2S ®



