
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторна робота. Олово та його сполукиСодержание книги
Поиск на нашем сайте Дослід 1. Добування олова відновленням цинком Користуючись даними таблиці стандартних електродних потенціалів, підберіть метал, здатний відновити іони Sn2+ з розчину його солі (наприклад, цинк). До розчину SnCl2 опустіть гранулу металевого цинку. Спостерігайте виділення олова на поверхні цинку. Напишіть відповідні рівняння реакцій. Дослід 2. Взаємодія олова з кислотами (Роботу виконувати у витяжній шафі) До шести пробірок помістіть по шматочку олова та подійте окремо розбавленими та концентрованими розчинами кислот HCl, H2SO4 та HNO3 спочатку при кімнатній температурі, а потім при нагріванні. Спостерігайте процеси, що відбуваються, та поясніть явища. Напишіть рівняння реакцій. Дослід 3. Гідроксид олова(ІІ) До розчину солі SnCl2 додайте краплями NаOH до осадження гідроксиду олова. Вміст пробірки поділіть на дві частини, до однієї з яких додайте надлишок розчину NаOH, а до іншої – розбавлену HCl. Напишіть відповідні рівняння реакцій у молекулярній та іонній формах. · Які властивості має осад Sn(OH)2? Дослід 4. Олов’яні кислоти а) a- Олов’яна кислота. До розчину SnCl4 додайте краплями водний розчин аміаку. Спостерігайте виділення білого об’ємного осаду a-олов’яної кислоти. Вміст пробірки поділіть на дві частини, до однієї з них додайте надлишок розчину лугу, а до іншої – розбавлену HCl. Складіть рівняння реакцій взаємодії a-олов’яної кислоти з лугами та кислотами у молекулярній та іонній формах. б) b- Олов’яна кислота. Шматочок олова облийте у фарфоровій чашці концентрованим розчином HNO3 та нагрійте до кипіння. Спостерігайте утворення білого осаду b-олов’яної кислоти. Напишіть рівняння реакції. Після охолодження вміст чашки розбавте водою та промийте осад декантацією. Дослідіть відношення b-олов’яної кислоти до концентрованих розчинів HCl та NаOH. Чи спостерігається розчинення осаду у пробірках? · Які існують відмінності у властивостях a- та b-олов’яних кислот? Дослід 5. Гідроліз хлориду олова(ІІ) Кілька кристалів SnCl2×H2O розчиніть у якомога малому об’ємі води, додаючи її краплями. Визначте за допомогою індикаторного папірця, чи гідролізується сіль. Добутий концентрований розчин розбавте водою. Що відбувається? Напишіть рівняння реакції гідролізу. · Як впливає розбавлення на ступінь гідролізу солі? Чи є реакція гідролізу хлориду олова оборотною? Дослід 6. Сульфіди олова(ІІ) та (IV) (Працювати під тягою!) До підкислених хлороводневою кислотою розчинів SnCl2 та SnCl4 додайте свіжоприготовану сірководневу воду до осадження SnS та SnS2. Який колір та характер мають осади сульфідів? Вміст кожної пробірки поділіть на дві частини; на одну з них подійте надлишком розчину (NH4)2S, а на іншу – (NH4)2S2. Що спостерігається? Після розчинення сульфіду олова до розчину тіостанату, що утворився, додайте кілька крапель розчину соляної кислоти. Спостерігайте утворення осаду сульфіду олова та виділення сірководню. Напишіть рівняння всіх реакцій у молекулярній та іонній формах. · Чим можна пояснити різну дію сульфіду та полісульфіду амонію на сульфід олова(II) та сульфід олова(IV)? Дослід 7. Відновні властивості сполук олова(ІІ) а) До невеликого об’єму розчину сулеми HgCl2 (сильна отрута!) додайте кілька крапель розчину хлориду олова(ІІ), а потім його надлишок. Що відбувається? Складіть рівняння окисно-відновного процесу. · Що утворюється при відновленні каломелі Hg2Cl2? б) До невеликої кількості хлориду олова(ІІ) додайте розчин лугу до розчинення осаду, поки розчин не стане прозорим. Що утворюється? До добутого розчину додайте невеликий об’єм розчинної солі бісмуту. Що спостерігається? Складіть рівняння реакцій. в) До сірчанокислого розчину SnCl2 додайте розчин KMnO4. Спостерігайте зміну забарвлення розчину унаслідок відновлення іонів MnO Лабораторна робота. Свинець та його сполуки Дослід 8. Добування свинцю витісненням цинком Ознайомившись з положенням свинцю в електрохімічному ряді напруг та з величиною його стандартного електродного потенціалу, підберіть метал, здатний відновити іони Pb2+ з розчину його солі (наприклад, цинк). До розчину розчинної солі свинцю опустіть гранулу металевого цинку. Спостерігайте виділення свинцю на поверхні цинку. Напишіть відповідне рівняння реакції. Дослід 9. Взаємодія свинцю з кислотами (Роботу виконувати у витяжній шафі!) До шести пробірок помістіть по шматочку свинцю та подійте окремо розбавленими та концентрованими розчинами кислот HCl, H2SO4 та HNO3 спочатку при кімнатній температурі, а потім при нагріванні. Спостерігайте явища, що відбуваються. Напишіть рівняння реакцій. Дослід 10. Взаємодія свинцю з лугом В конічну пробірку помістіть невеличкий шматочок свинцю та додайте 6‑10 крапель 10%-ного розчину гідроксиду натрію. Пробірку підігрійте на водяній мікробані. Напишіть рівняння реакції, що перебігає. Дослід 11. Оксиди свинцю а) Шматочок свинцю розріжте ножем. Що відбувається з поверхнею металу? Напишіть рівняння реакції. б) Помістіть до фарфорового тиглю 3 г карбонату свинцю та прожарте у муфельній печі при температурі 650 оС 1,5-2 години до припинення виділення вуглекислого газу. Яка модифікація оксиду свинцю утворюється у цьому випадку? Дослідіть відношення оксиду свинцю до оцтової, азотної кислот та до концентрованого розчину лугу при нагріванні. Напишіть рівняння реакцій. в) Розчиніть 7 г ацетату свинцю Pb(CH3COO)2×3H2O у 15 мл води. Добутий розчин нагрійте (якщо розчин каламутний, його фільтрують) та додайте до нього при перемішуванні розчин хлорного вапна. Суміш нагрійте. Що відбувається? · Поясніть появу забарвленого осаду при додаванні хлорного вапна до розчину ацетату свинцю. г) Внесіть до фарфорової чашки трохи PbO2, облийте концентрованим розчином KOH та нагрійте 3-4 хв. Що спостерігається? Напишіть рівняння реакції. д) До трьох пробірок внесіть PbO, PbO2 та Pb3O4 та налийте концентровану HCl, перемішайте вміст пробірок скляною паличкою та нагрійте. Що відбувається? Напишіть рівняння реакцій. · Який газ виділяється при взаємодії PbO2 та Pb3O4 з концентрованою соляною кислотою? е) До пробірки налийте 1-2 краплі розчину сульфату мангану, 10-15 мл сірчаної кислоти та внесіть трохи оксиду свинцю(IV). Вміст пробірки прокип’ятіть 1-2 хв. Чим зумовлена зміна забарвлення розчину? Напишіть рівняння реакцій.
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 563; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.008 с.) |

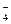 . Дослід повторіть з окисником K2Cr2O7. Складіть рівняння реакцій.
. Дослід повторіть з окисником K2Cr2O7. Складіть рівняння реакцій.


