
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 12. Гідроксид свинцю(ІІ)Содержание книги
Поиск на нашем сайте До розчину солі Pb(ІІ) додайте краплями розчин NаOH до осадження гідроксиду свинцю. Відзначте колір та характер осаду. Розділіть осад на дві пробірки. До однієї з них додайте розчин HNO3, до іншої – надлишок лугу. Напишіть рівняння реакцій у молекулярній та іонній формах. · Які властивості має гідроксид свинцю(ІІ)? Дослід 13. Солі свинцю та їхні властивості а) До розчину солі Pb(ІІ) додайте розбавлену HCl. Відзначте колір та характер осаду. Невелику кількість добутого хлориду свинцю(ІІ) розчиніть у гарячій концентрованій соляній кислоті. Напишіть рівняння реакцій у молекулярній та іонній формах. б) До розчину солі Pb(ІІ) додайте розбавлену H2SO4. Відзначте колір та характер осаду. Напишіть рівняння реакцій у молекулярній та іонній формах. в) До розчину солі Pb(ІІ) додайте розчин Na2S. Що спостерігається? Відфільтруйте осад та обробіть його розчином пероксиду водню. Що спостерігається? г) До розчину солі Pb(ІІ) додайте розчин KI. Який колір має осад? Додайте до осаду 4-5 мл дистильованої води та нагрійте. Що спостерігається? Охолодіть розчин. Спостерігайте виділення золотисто-жовтих кристалів PbI2. Розчиніть невелику кількість кристалів йодиду свинцю у насиченому розчині йодиду калію. Добутий розчин розбавте водою до утворення осаду. Що випадає в осад? Напишіть рівняння реакцій. · Чим пояснити розчинення йодиду свинцю у надлишку йодиду калію? д) До розчину солі Pb(ІІ) додайте розчин хромату калію. Напишіть рівняння реакції. Який колір має осад? Розчин злийте з осаду, осад перенесіть до двох пробірок. До однієї пробірки додайте азотну кислоту, до іншої – розчин лугу. Що спостерігається? Напишіть рівняння реакцій. Дослід 14. Відновні властивості сполук свинцю(ІІ) До 2-3 крапель розчину солі свинцю додайте 6-10 крапель 30%-ного розчину гідроксиду натрію, розчин наполовину розбавте дистильованою водою, додайте 10-15 крапель 3%-ного розчину пероксиду водню та все ретельно перемішайте скляною паличкою. Спостерігайте утворення коричневого осаду PbO2. Якщо осад не випадає, нагрійте пробірку з розчином на водяній бані. Напишіть рівняння реакції. Бор, алюміній Мета роботи. Добування, вивчення основних хімічних властивостей бору, алюмінію та їхніх сполук. 9.1. Контрольні питання 1. Які прості речовини можна використовувати як відновники для добування бору з його оксиду? Як можна добути чистий бор? 2. Опишіть відношення бору до кислот. 3. Поясніть механізм реакції утворення ВН4- з ВН3. 4. Які речовини можна добути під час прожарювання борної кислоти? Напишіть рівняння реакцій, назви добутих речовин та їхні графічні формули. 5. Яка форма борної кислоти є найстійкішою у водному розчині? 6. Чим є за хімічним складом: бориди, борани, борати, поліборати? 7. Які комплекси – катіонні чи аніонні – більш характерні для бору(III)? 8. Яка речовина утворюється, якщо до розчину тетраборату натрію додати кислоти? 9. Чи доцільно добувати алюміній з оксиду хімічним відновленням? Наведіть реакції, за допомогою яких алюміній добувають у промисловості. 10. Як діють на алюміній азотна та сірчана кислоти різних концентрацій? 11. Чому алюміній не витісняє водень з води, але легко витісняє його з водного розчину лугу? Напишіть рівняння реакцій окремих стадій. 12. Що таке терміт? Напишіть рівняння реакцій, на яких засновано його застосування. 13. Напишіть рівняння гідролізу сульфіду алюмінію. 14. Чому при кип’ятінні водного розчину алюмінату амонію утворюється осад гідроксиду алюмінію, а при кип’ятінні розчину алюмінату натрію осаду не утворюється? Напишіть рівняння реакцій. 15. Що утворюється при змішуванні водних розчинів сульфату алюмінію та карбонату натрію? Напишіть рівняння реакції. Задачі 1. Яку кількість 30%-ної борної кислоти необхідно узяти, щоб добути 120 г бури, якщо вихід реакції становить 80% від теоретично можливого? Відповідь: 324,6 г. 2. Скільки вийде Na2B4O7·10 H2O, якщо до 12 г H3BO3 додати 200 мл 0,1 н розчину NаOH? Відповідь: 3,82 г. 3. Скільки грамів Na2B4O7·10H2O, необхідно для реакції із 100 мл 0,4 н розчину HCl? Відповідь: 7,64 г. 4. Визначте молярну концентрацію розчину бури, якщо 30 мл цього розчину нейтралізуються 40 мл 0,15 н розчину сірчаної кислоти. Відповідь: 0,1 моль/л. 5. Якою була маса Al(OH)3, якщо для його розчинення було потрібно 0,2 л розчину азотної кислоти ( 6. При обробці суміші срібла та алюмінію надлишком розчину концентрованої азотної кислоти утворилося 6,72 л (н.у.) газу. При обробці такої ж маси суміші надлишком розчину гідроксиду натрію виділилося 6,72 л (н.у.) газу. Розрахуйте масові частки компонентів у суміші. Відповідь: 86% срібла; 14% алюмінію. 7. Який об’єм 0,4 н розчину лугу буде потрібний для осадження у вигляді Al(OH)3 усього алюмінію, що міститься у 300 мл 1 н розчину Al(NO3)3? Відповідь: 750 мл. 8. Газ, що виділився при дії 10,8 г алюмінію на 160 г 5%-ного розчину гідроксиду натрію, пропустили при нагріванні над порошком оксиду міді(II) масою 40 г. Розрахуйте, яким мінімальним об’ємом 19,6%-ного розчину сірчаної кислоти (ρ = 1,10 г/см3) треба обробити добуту суміш, щоб виділити з неї металеву мідь у чистому вигляді. Скільки грамів міді буде при цьому добуто? Відповідь: 90,9 мл; 19,2 г міді. 9. 13,8 г суміші, що складається з силіцію, алюмінію та заліза, обробили при нагріванні гідроксидом натрію, при цьому виділилося 11,2 л газу (н.у.). При дії на таку ж масу суміші надлишку соляної кислоти виділяється 8,96 л газу. Визначте маси компонентів суміші. Відповідь: 2,8 г силіцію; 5,4 г алюмінію; 5,6 г заліза. 9.3. Зразок завдання для поточного контролю
Лабораторна робота. Бор Дослід 1. Добування аморфного бору з бури (тяга!) 15 г бури (Na2B4O7·10H2O) зневодьте. Для цього прожарте її у фарфоровій чашці на газовому пальнику. При прожарюванні відбувається спучення бури, її необхідно час від часу уминати товкачем. Прожарення потрібно вести до повного видалення вологи. Після охолоджеання чашки зневоднену буру витягніть та розітріть у порошок. Приготуйте 6 г суміші, що складається з 2 мас. ч. прожареної бури та 1 мас. ч. сухого порошку магнію. Ретельно перемішану суміш помістіть до тугоплавкої пробірки у штативі. За допомогою газового пальника прогрійте всю суміш, а потім сильно нагрійте дно пробірки. Реакція перебігає з виділенням великої кількості тепла. Після закінчення реакції пробірку охолодіть та обережно розбийте. Масу (без шматочків скла), що спеклася, розітріть у порошок та обробіть соляною кислотою (1:2). · Які газоподібні продукти утворюються при прожарюванні бури та при дії на неї соляної кислоти? Порошок бору, що залишився, промийте водою та висушіть у сушильній шафі. Напишіть рівняння реакцій. Дослід 2. Властивості бору а) Взаємодія з лугом. До пробірки з невеликою кількістю бору додайте 2-3 мл концентрованого розчину їдкого калі, вміст пробірки нагрійте. Що спостерігається? Напишіть рівняння реакції. б) Взаємодія з азотною кислотою. До фарфорової чашку насипте трохи бору, додайте 3-5 мл концентрованої азотної кислоти, підігрійте. Що спостерігається? Напишіть рівняння реакції. в) Горіння бору. Невелику кількість бору помістіть до тиглю та сильно нагрійте на полум’ї пальника. Що спостерігається? Напишіть рівняння реакції.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 421; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.008 с.) |

 30%,
30%, 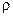 = 1180 кг/м3)? Який мінімальний об’єм 2,5 н. розчину КОН необхідно витратити для розчинення цієї кількості гідроксиду алюмінію? Відповідь: 29,22 г; 150 мл.
= 1180 кг/м3)? Який мінімальний об’єм 2,5 н. розчину КОН необхідно витратити для розчинення цієї кількості гідроксиду алюмінію? Відповідь: 29,22 г; 150 мл.


