Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 5. Гідразин та гідроксиламінСодержание книги
Поиск на нашем сайте а) Відновні властивості гідразину. До двох пробірок налийте по 2-3 мл свіжеприготовленого розчину сульфату гідразину. До першої пробірки прилийте кілька краплин йодної води, до іншої - 1 мл сульфату міді(ІІ) з 1-2 мл розчину їдкого натру. Що спостерігається? Напишіть рівняння реакцій. б) Відновні властивості гідроксиламіну. До двох пробірок налийте свіжоприготовленого розчину хлориду гідроксиламіну та трохи концентрованого розчину лугу. Потім до першої пробірки прилийте йодну воду, а до іншої – розчин сульфату міді(ІІ). Що спостерігається? Напишіть рівняння реакцій. Дослід 6. Добування йодиду азоту Кілька кришталиків йоду розітріть у ступці, прилийте концентрований розчин аміаку. Напишіть рівняння реакції добування йодиду азоту. Через 15 хвилин перенесіть реакційну суміш на фільтр. Добутий продукт відмийте водою та залиште сушитися на повітрі у закритій витяжній шафі. Сухий йодид азоту НАДЗВИЧАЙНО НЕСТІЙКИЙ, ВИБУХАЄ ВІД ДОТИКУ!!! До висушеного йодиду азоту доторкніться скляною паличкою (у закритій витяжній шафі). Напишіть рівняння реакції, що відбувається. Лабораторна робота. Оксиди азоту. Азотиста кислота та її солі При роботі з оксидами азоту необхідно пам’ятати, що усі вони, за винятком оксиду азоту(І), отруйні. Всі роботи необхідно проводити у витяжній шафі. Дослід 7. Оксид азоту(І) а) Добування оксиду азоту(І). Помістіть до широкої пробірки, що закрита пробкою з газовідвідною трубкою, 3 г нітрату амонію та закріпіть у штативі у похиленому положенні. Злегка нагрійте. Чому нагрівання необхідно проводити обережно? Напишіть рівняння термічного розкладу нітрату амонію. Зберіть газ, що виділяється, у дві колбочки, заповнені гарячою водою або насиченим розчином хлориду натрію. Колбочки з оксидом азоту(І) використайте у наступному досліді. б) Властивості оксиду азоту(І). До колбочки з оксидом азоту(І) внесіть тліючу скіпку. Чому скіпка краще горить в оксиді азоту(І), ніж у повітрі? До другої колбочки внесіть ложечку з палаючим фосфором. Напишіть рівняння реакцій, що відбуваються. Дослід 8. Оксид азоту(ІІ) а) Добування оксиду азоту(ІІ). Закріпіть у штативі колбу Вюрца. Помістіть до неї 8-10 г мідних ошурок та закрийте колбу пробкою з краплинною лійкою. До лійки налийте розбавлену азотну кислоту (1:1) та долийте трохи кислоти до колби. Колбу злегка підігрійте та приливайте азотну кислоту. Після витіснення повітря з приладу зберіть над водою газ, що виділиться, у 4 колбочки, заповнені водою. Дайте пояснення різниці кольору газу в реакційній колбі та у приймачах. Добутий оксид азоту(ІІ) збережіть для наступних дослідів. б) Властивості оксиду азоту(ІІ). Приєднайте до приладу для добування оксиду азоту(ІІ) промивну склянку з розчином лугу. Для чого? Пропустіть струм оксиду азоту(ІІ) крізь злегка підігріту концентровану азотну кислоту. Що спостерігається? Напишіть рівняння реакції. До другої колбочки з оксидом азоту(ІІ) внесіть палаючу скіпку. Чи підтримує оксид азоту(ІІ) горіння скіпки? Перевірте, чи горять запалені сірка та фосфор в оксиді азоту(ІІ) в окремих колбочках. Дайте пояснення явищам, що спостерігаються. Дослід 9. Оксид азоту(ІV) а) Добування оксиду азоту(ІV). До мідних ошурок, поміщених до колби Вюрца, прилийте з краплинної лійки концентровану азотну кислоту. Після витіснення повітря з приладу зберіть газ, що виділився, у 3 колбочки. б) Властивості оксиду азоту (ІV). Одну з колб, наповнених NO2, помістіть в охолоджувальну суміш. Як зміниться забарвлення газу при охолодженні? Колбу з газом витягніть з охолоджувальної суміші та спостерігайте відновлення початкового забарвлення. Напишіть рівняння реакції взаємодії оксиду азоту(ІV) з водою, з розчином лугу. Випробуйте, чи підтримує NO2 горіння скіпки та сірки. Напишіть рівняння реакції горіння сірки в оксиді азоту(ІV). · Що називається полімеризацією? Чим пояснюється легкість полімеризації NO2? Дослід 10. Азотистий ангідрид
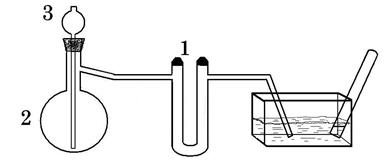
Зберіть прилад (рис.16). U-подібну трубку (1), що буде служити приймачем, помістіть в охолоджувальну суміш, температура якої повинна бути не вище -5°С. До колби Вюрца (2) помістіть 8-10 г крохмалю, а до краплинної лійки (3) налийте концентровану азотну кислоту. Приливайте краплями азотну кислоту до крохмалю та нагрійте. Що збирається у приймачі? Напишіть рівняння реакції. Для чого після приймача ставиться водяний уловлювач? По закінченні реакції U-подібну трубку від’єднайте від приладу та налийте до неї воду. Що спостерігається? Напишіть рівняння реакції. Дослід 11. Азотиста кислота а) Добування азотистої кислоти. Пробірку з 1-2 мл насиченого розчину нітриту калію помістіть в охолоджувальну суміш і до вмісту прилийте кілька краплин попередньо охолодженої концентрованої сірчаної кислоти. Напишіть рівняння реакції, що відбувається. Витягніть пробірку з охолоджувальної суміші. Який газ виділяється з розчину? · Яка рівновага існує у розчині азотистої кислоти? б) Відновні властивості азотистої кислоти. До однієї пробірки налийте 1‑2 мл бромної води, до другої - таку ж кількість розчину перманганату калію та до третьої – стільки ж розчину дихромату калію. Долийте до усіх пробірок такий самий об’єм нітриту калію. Чи спостерігаються будь-які зміни? Підкисліть розчини у другій та третій пробірках розбавленою сірчаною кислотою. Що спостерігається? Напишіть рівняння реакцій. в) Окисні властивості азотистої кислоти. До підкисленого розбавленого розчину йодиду калію прилийте розчин нітриту калію. Як змінюється забарвлення розчину? Напишіть рівняння реакції.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 421; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.007 с.) |