
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 1. Добування та властивості сіркиСодержание книги
Поиск на нашем сайте Добування ромбічної сірки. (Дослід проводити у витяжній шафі). До сухої пробірки налийте 1-2 мл хлороформу та невеликими порціями, струшуючи вміст пробірки, додавайте порошок сірки до утворення насиченого розчину. Після відстоювання сірки, яка не розчинилася, візьміть сухою піпеткою трохи розчину, помістіть його на годинникове скло та, покривши його скляною пластиною, залиште у витяжній шафі для повільного випаровування та кристалізації. Одну краплю розчину помістіть на предметне скло та розгляньте під мікроскопом, спостерігаючи зростання кристалів. Замалюйте кристали та відзначте їхній колір. Добування моноклінної сірки та зміна її при нагріванні. Маленький фарфоровий тигель наповніть на ¾ дрібними шматочками сірки. Тигель помістіть у фарфоровий трикутник та поставте на кільце штатива. Обережно нагрійте тигель до повного розплавлення сірки. Охолодіть тигель, стежачи за утворенням кристалічної кірки. Коли кристали майже зімкнуться в центрі, швидко вилийте розплавлену сірку до стакану з водою. Темні кристали, що утворилися у тиглі, розгляньте в лупу, відзначте їхній колір та замалюйте їхню форму. Спостерігайте поступову зміну кольору кристалів (вони стають спочатку матовими та крихкими, а потім жовтіють), що пов’язано з переходом моноклінної сірки (стійкої вище 95 оС) в ромбічну. Добування пластичної сірки. Маленьку пробірку наповніть на 1/3 шматочками колодочкової сірки, укріпіть у пробіркотримачі та дуже обережно нагрійте, весь час струшуючи. Сірка починає плавитися, утворюючи жовту легкорухливу рідину. Продовжуйте повільно нагрівати розплавлену сірку, спостерігаючи подальшу зміну її кольору та збільшення в’язкості: з перекинутої догори дном пробірки сірка не виливається (температура близько 200 оС). Продовжуйте нагрівання до температури кипіння сірки. Сірка при цьому темніє та знов стає рухливою. Близько половини киплячої сірки вилийте тонким струменем до чашки з холодною водою. Вийміть добуту масу з води та переконайтеся в її еластичності. Збережіть пластичну сірку до кінця занять, щоб прослідкувати перехід аморфної модифікації у кристалічну. Яка модифікація сірки є найстійкішою при кімнатній температурі? Розплавлену сірку, що залишилася у пробірці, знов доведіть до кипіння та залиште повільно охолоджуватися. Зверніть увагу на те, що остигла в пробірці сірка знов зазнає ті ж зміни, що і при нагріванні, але в зворотному порядку: спочатку загусає, потім робиться рідкою, легкорухливою та прозорою і, нарешті, твердне. · Напишіть рівняння реакцій взаємодії сірки з цинком, киснем, з концентрованою сірчаною та азотною кислотами, з концентрованим розчином лугу при нагріванні. Вкажіть, які властивості виявляє сірка в кожній з реакцій (окисні або відновні). Дослід 2. Добування та властивості сірководню (Сірководень дуже отруйний, тому всі досліди з ним проводити у витяжній шафі!) Добування та горіння сірководню (груповий дослід). Зберіть прилад, що складається з пробірки з пробкою, в яку вставлена пряма газовідвідна трубка з відтягнутим кінцем. Укріпіть прилад вертикально у лапці штативу, налийте до нього 1 мл розчину соляної кислоти з масовою часткою НСl 20%, додайте до кислоти кілька шматочків сульфіду заліза (II). Швидко закрийте пробірку пробкою з відвідною трубкою. Коли почнеться енергійне виділення газу, запаліть його у кінця відвідної трубки. Над полум’ям газу потримайте змочений дистильованою водою синій лакмусовий папірець. Поясніть зміну його кольору. Внесіть до полум’я сірководню холодну фарфорову кришку від тиглю або скляну пластинку. Спостерігайте утворення жовтуватого нальоту. Що утворилося? Напишіть рівняння реакцій добування сірководню та його горіння. Напишіть рівняння реакції неповного згоряння сірководню. Якісне відкриття сірководню. Піднесіть до газовідвідної трубки приладу для добування сірководню фільтрувальний папір, змочений розчином ацетату свинцю. Що відбувається? Напишіть рівняння реакції. Відновні властивості сірководню. Налийте в кожну пробірку по 0,5-1,0 мл хлорної води, бромної води, розчину перманганату калію та дихромату калію, підкислених сірчаною кислотою. До кожної з пробірок додайте краплями сірководневу воду до зміни забарвлення кожного розчину та його помутніння внаслідок виділення сірки. Напишіть рівняння реакцій, враховуючи, що Дослід 3. Добування та властивості сульфідів металів (Досліди проводити у витяжній шафі! ) Сульфід міді (І). До сухої пробірки насипте 2-3 г сірки, закріпіть пробірку в штативі та нагрійте до кипіння сірки. У пари киплячої сірки внесіть заздалегідь нагрітий мідний дріт. Спостерігайте інтенсивне горіння сірки з утворенням Cu2S. Напишіть рівняння реакції. · Як відноситься сульфід міді (І) до дії води та соляної кислоти? Сульфід алюмінію. Зважте 0,5-1,0 г порошку алюмінію та обчислену кількість порошку сірки, ретельно перемішайте реагенти. Висипте суміш горою на металеву пластинку та підпаліть за допомогою стрічки магнію (обережно, під тягою!). Поясніть наявність запаху сірководню у сульфіду алюмінію. Частину добутої солі перенесіть у пробірку з гарячою водою (під тягою!). Напишіть рівняння реакцій. · Поясніть причину взаємодії сульфіду алюмінію з водою. Сульфід цинку. Виходячи з еквівалентних кількостей цинку (порошок) та сірки, приготуйте близько 2 г суміші, покладіть на металеву пластинку та нагрійте (обережно під тягою!). Вивчить відношення сульфіду цинку до дії води та соляної кислоти. Напишіть рівняння реакцій. Осадження сульфідом амонію. До ряду пробірок налийте по 0,5-1,0 мл розчинів солей заліза (II), мангану (II), цинку, кадмію, свинцю, стибію та міді. До кожної пробірки додайте по 0,5 мл сульфіду амонію. Відзначте колір осадів. Напишіть рівняння реакцій. · Знайдіть у довіднику добутки розчинності сульфідів металів, розглянутих у досліді. Поясніть утворення сульфідів металів при дії сульфіду амонію. Дослідіть дію розчину соляної кислоти (30%) на добуті осади, узявши дуже малу кількість їх. Напишіть можливі рівняння реакцій розчинення осадів в іонно-молекулярному вигляді. · Поясніть різну дію соляної кислоти на сульфіди металів. Осадження дією сірководню. Налийте до пробірок по 0,5-1,0 мл розчинів тих же солей, що у попередньому досліді, та до кожної з них додайте розчин сірководневої води. Відзначте, в яких випадках утворилися осади сульфідів, а в яких – ні. Напишіть відповідні рівняння реакцій. · Користуючись величинами ДРMS, а також правилом добутку розчинності, поясніть: а) різні результати дії H2S і (NH4)2S на солі цинку, заліза (II) і мангану (II); б) утворення осадів CdS, PbS, Sb2S3, CuS при дії сірководню на розчини солей. Властивості сульфідів, розчинних у воді. Кілька кристалів сульфіду натрію розчиніть у воді. Розділіть розчин на дві пробірки. Випробуйте дію розчину сульфіду натрію на індикатори (фенолфталеїн, лакмус). Поясніть зміну забарвлення індикаторів. Напишіть рівняння реакції гідролізу в іонній та молекулярній формах. Крізь розчин, що знаходиться в другій пробірці, пропустіть струм оксиду вуглецю (IV). Відзначте запах газу, що виділяється. Напишіть рівняння реакції. · Що відбудеться із сульфідом натрію, якщо його залишити у відкритій банці? Дослід 4. Добування та властивості полісульфідів лужних металів (Дослід проводити у витяжній шафі!) До пробірки або маленького стакану внесіть трохи дрібнорозтертої сірки, додайте 1 мл спирту (спирт додають для кращого змочування сірки водою) та 3‑4 мл концентрованого розчину сульфіду натрію або калію. Закріпіть пробірку у штативі та обережно нагрійте до кипіння маленьким полум’ям пальника. Зверніть увагу на темно-червоно-коричневий колір розчину полісульфіду. Відокремте розчин добутого полісульфіду від сірки, що не прореагувала, відстоюванням або фільтруванням. Налийте у пробірку 1-2 мл прозорого розчину полісульфіду та додайте краплями розбавлену соляну кислоту до кислої реакції (проба лакмусовим папірцем). Через деякий час відзначте появу осаду сірки (іноді спочатку утворення колоїдного розчину) та виявіть виділення сірководню. Напишіть рівняння реакцій добування полісульфіду натрію та його руйнування у кислому середовищі (реакцію диспропорціонування).
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 643; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.009 с.) |

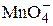 -іон переходить в Mn2+-іон, а
-іон переходить в Mn2+-іон, а 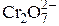 -іон – у Cr3+.
-іон – у Cr3+.


