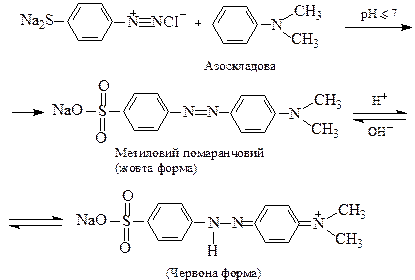Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методи одержання нітросполукСодержание книги Поиск на нашем сайте
АЗОТОВМІСНІ СПОЛУКИ
Азотовмісні органічні сполуки містять атоми азоту, безпосередньо зв'язані з атомами вуглецю. Їх поділяють на: нітросполуки (RNO2), нітрозосполуки (RNO), аміни (RNH2, R2NH, R3N), нітрили карбонових кислот або ціаніди (RC≡N), азосполуки (RN═NR), похідні гідроксил аміну (RNH―OH) тощо. В усіх вищенаведених формулах R ― алкільний, циклоалкільний або арильний залишок. Найбільш поширені нітросполуки та аміни. АЛІФАТИЧНІ НІТРОСПОЛУКИ
Нітросполуки - похідні вуглеводнів, у яких один або декілька атомів водню заміщені на нітрогрупу —NO2. Загальна формула насичених нітросполук CnН2n+1NО2. Залежносто від природи атома вуглецю, з яким зв'язана нітрогрупа, розрізняють первинні, вторинні і третинні нітросполуки:
Нітросполуки бувають насичені і ненасичені. У цьому розділі розглянуті насичені нітросполуки ― нітроалкани. Згідно замісникової номенклатури їх називають за назвою алкану з додаванням префікса “ нітро”. Локантом показують положення нітрогрупи в головному ланцюзі, нумерацію якого починають з того кінця, ближче до якого розміщена NO2 -група (табл.1). За аналогією з іншими функціональними похідними алканів їх ізомерія залежить від положення нітрогрупи в ланцюзі і від будови самого вуглеводневого ланцюга. \ Таблиця 1 Назви нітросполук
МЕТОДИ ОДЕРЖАННЯ НІТРОСПОЛУК
Нітрування алканів (див.стор.). 2. Взаємодія алкілгалогенідів з нітритом натрію (алкілювання нітритів) (В.Мейєр, 1872).
Побічним продуктом реакції є алкілнітрит С2Н5-О-N=О.
ФІЗИЧНІ ВЛАСТИВОСТІ
Нітросполуки аліфатичного ряду - висококиплячі, малорозчинні у воді, сильнополярні рідини або кристалічні речовини з густиною, переважно, більшою за 1. Причина сильної полярності нітрогрупи полягає у її будові. Нітрогрупа містить семіполярний зв'язок, утворення якого можна представити за допомогою реакції окиснення нітрозосполук:
Нітрозоалкан Нітроалкан Зв`язок N-O утворюється за рахунок неподіленої пари електронів азоту і вакантної 2ρ-орбіталі атома кисню. Отже, за своєю природою він є ковалентним донорно-акцепторним. В результаті переходу електрона від азоту до кисню, атом азоту набуває позитивного заряду, а атом кисню – негативного. Такий розподіл зарядів веде до електростатичної взаємодії (як у випадку йонного зв’язку) між різнойменно зарядженими атомами азоту та кисню. Така комбінація ковалентного донорно-акцепторного і йонного зв`язків називається семіполярним зв`язком.
Внаслідок спряження π-електронної системи у нітрогрупі обидва зв'язки азот-кисень вирівнюються і обидва кисневі атоми зв’язуються з азотом однаковими зв’язками:
З цих формул видно, що атом азоту нітрогрупи несе на собі цілий позитивний заряд, що і є основною причиною прояву нітрогрупою сильного –І-ефекту, а наявність семіполярного зв’язку зумовлює високий дипольний момент нітрогупи.
ХІМІЧНІ ВЛАСТИВОСТІ
Таутомерія первинних та вторинних нітросполук Внаслідок прояву нітрогрупою сильних електроноакцепторних властивостей атоми водню при атомі вуглецю, сполученому з атомом азоту (при α-вуглецевому атомі) протонізуються і набувають підвищеної рухливості. Це дозволяє первинним і вторинним нітросполукам існувати у вигляді двох таутомерних форм: нітроформи та ацинітроформи.
Нітроформа Ацинітроформа Натрієва сіль (нітронова кислота) нітронової кислоти
Механізм даної реакції:
Ациформа має кислі властивості, але не володіє електропровідністю. Такі сполуки називаються "псевдокислотами ". У лужних середовищах вони утворюють солі, а у кислому середовищі рівновага зсувається вліво. Третинні нітросполуки до такої таутомерії не здатні (немає атома водню в α-положенні). Відновлення нітросполук
Амін Відновником може служити каталітично-активований водень, або водень у момент виділення. Методи одержання Схема нітрування толуену
Окиснення аренамінів Аміногрупа – NH2 здатна окислюватися до нітрогрупи за умови, що окиснювачі не окиснюють бензенове кільце.
Таутомерія фенілнітрометану Фенілнітрометан, як і первинні та вторинні аліфатичні нітросполуки, здатний до таутомерії. Під дією лугів сполуки типу фенілнітрометану утворюють солі ациформ (див.стор.).
Ця реакція дозволяє відрізнити нітросполуки з NO2- у бічному ланцюзі від нітросполук з NO2-групою в ядрі.
Окремі представники Нітробензен одержують нітруванням бензену, його використовують як розчинник, а також в органічному синтезі. Тринітротолуєн одержують нітруваням нітротолуєнів 100%-ною НNO3 в суміші з H2SO4. Застосовують як вибухову речовину (тротил, тол).
АЛIФАТИЧНI АМIНИ
Аміни можна розглядати як похідні аміаку (NН3), в якому атоми водню заміщені на вуглеводневі залишки (алкільні групи). Розрізняють первинні, вторинні і третинні аміни:
Аміак Первинний Вторинний Третинний амін амін амін
За замісниковою номенклатурою IUPAC назви амінів утворюють шляхом додавання префіксу " аміно " або суфіксу " амін " до назви алкану і локантом показують положення аміногрупи у вуглеводневому ланцюзі (Табл.2). За радикало-функціональною номенклатурою IUPAC перелічують за алфавітним порядком назви алкільних залишків, що сполучені з азотом і додають суфікс " амін. Таблиця 2 Назви аліфатичних амінів
МЕТОДИ ОДЕРЖАННЯ Алкілювання аміаку спиртами
Цетиловий спирт З амідів кислот за Гофманом
Амід кислоти ФІЗИЧНІ ВЛАСТИВОСТІ Алкіламіни - це гази або рідини з неприємним запахом. Середні аміни мають запах гнилої риби. Вищі аміни не мають запаху. Температура топлення первинних амінів вища, ніж вторинних і третинних, що пояснюється наявністю водневих зв'язків, слабших у порівнянні з водневими зв'язками у спиртах. Зв'язок N-H менше полярний, ніж зв'язок О-Н. Будова амінів подібна до будови аміаку і містить пірамідальну молекулу з атомом азоту у вершині піраміди з кутами між зв'язками приблизно 106-108о. Якщо з атомом азоту зв'язані три різних замісники, то такі третинні аміни проявляють оптичну активність. Роль четвертого замісника виконує орбіталь з неподіленою парою електронів атома азоту.
Оптично активні енантіомери
ХІМІЧНІ ВЛАСТИВОСТІ Властивості амінів визначаються аміногрупою, азот якої має рухливу неподілену пару електронів і може бути їх донором. Тому аміни проявляють основні властивості. Основність амінів Аліфатичні аміни є сильними основами. Основність їх проявляється вже у водних розчинах, які мають лужну реакцію (за рахунок утворення іонів ОН-)
При взаємодії з мінеральними кислотами аміни утворюють солі:
Алкіламонійхлорид Протон кислоти (Н+) з атомом азоту утворює донорно-акцепторний зв'язок. Основність амінів вища від основності аміаку за рахунок +І еф. алкільних груп, які збільшують електронну густину на атомі азоту. Тому основність амінів зменшується при переході від третинних до первинних.
Кислотні властивості амінів Первинні і вторинні аміни є дуже слабкими кислотами, але реагуючи з лужними металами утворюють алкіл- або діалкіламіди
Натрій діалкіламін ДІАМІНИ
Аміни, що містять у молекулі дві аміногрупи називають діамінами. Назви їх за номенклатурою IUPAC утворюються аналогічно до назв моноамінів.
Діаміни одержують тими ж методами, що й моноаміни. Нижчі діаміни розчинні у воді і є сильнішими основами, ніж моноаміни. Широке застосування має гексаметилендіамін, який добувають або з адипінової кислоти, або з 1,3-бутандієну (дивінілу):
або з 1,3-бутадієну (дивінілу):
Реакцією поліконденсації гексаметилендіаміну з двоосновними карбоновими кислотами одержують поліаміди, зокрема "Найлон-66":
Поліамід "Найлон-66" Найлон характеризується доволі високою температурою топлення і застосовується як конструкційний матеріал, а також для виготовлення синтетичного волокна "Найлон".
АРОМАТИЧНІ АМІНИ Ароматичні аміни діляться на ароматичні та алкілароматичні. У перших з атомом азоту зв'язані лише ароматичні залишки, а у алкілароматичних - як арильні, так і алкільні групи.
У свою чергу ароматичні аміни, як і аліфатичні поділяються на первинні, вторинні і третинні.
м -Толуїдин Дифеніламін Трифеніламін N-Метил-N-пропіл- (первинний) (вторинний) (третинний) анілін (третинний)
Сполуки, які містять дві аміногрупи називаються діамінами.
о -Фенілендіамін м -Фенілендіамін п -Фенілендиамін СПОСОБИ ОДЕРЖАННЯ Відновлення нітросполук Найпростіший варіант цього методу – відновлення каталітично-збудженим воднем.
Існують й інші відновлювальні системи: Fe+HCI; Sn+НCI; H2S; Na2S. У промислових умовах застосовують чавунні ошурки.
Залежність вказаних реакцій від рН середовища наведена раніше (див.стор.). З галогенопохідних Отримання первинних амінів
Реакція арилювання аміаку протікає в жорстких умовах внаслідок низької реакційної здатності атома галогену, що зв'язаний з бензеновим ядром (див.стор.). В аліфатичному ряді ця реакція протікає значно легше. Отримання вторинних амінів
Дифеніламін Отримання третинних амінів
Трифеніламін Реакція алкілювання Ариламіни Ar-NH2 алкілуються галогеноалкілами R-HaI або спиртами R-OH у присутності кислот. При цьому утворюються вторинні і третинні аміни.
Етилфеніламін Етилпропілфеніламін
Для одержання вторинних амінів без домішок третинних, первинну аміногрупу попередньо захищають ацилюванням.
Ацилювання здійснюється ацилюючими агентами (див.стор.), а отримані похідні називаються феніламідами відповідних кислот
Феніламід оцтової кислоти або ацетанілід або N-Ацетиланілін Захищену таким чином аміногрупу надалі можна алкілювати. Потім захист знімають гідролізом:
N-Метил-N-ацетиланілін Далі захист аміногрупи знімають шляхом гідролізу
Метилфеніламін В результаті утворюються вторинні аміни без домішок третинних.
Основність ариламінів.
Зменшення основності Галогенування ариламінів При галогенуванні незахищених амінів реакція супроводжується окисненням аміногрупи, наприклад:
Хлораніл Тому, її спочатку захищають, наприклад, реакцією ацилювання (див.стор.3). Ацетиламіногрупа зберігає електронодонорні властивості і в реакціях SE орієнтує новий замісник в о - та п -положення (переважноо в пара -):
Далі за допомогою лужного або кислого гідролізу ацильну групу відщеплюють.
п -Хлорофеніламін (п -Хлоранілін)
У випадку бромування у водних розчинах можна обійтися без захисту аміногрупи.
2,4,6-Триброманілін При галогенуванні амінів у розчині сильних кислот поряд з п -ізомером утворюється м -ізомер. Це пов'язано з утворенням солей амінів. Протонована аміногрупа є м -орієнтантом через втрату р- π-спряження пари електронів атому азоту з бензеновим кільцем.
Феніламонійхлорид
м -Хлоранілін Нітрування ариламінів Перед нітруванням аміногрупу, як правило, захищають шляхом ацилювання з метою запобігання її окиснення.
Сульфування ариламінів Сульфування ариламінів приводить до утворення спочатку солі, наприклад, феніламонійгідрогенсульфату, який потім при нагріванні переходить в п -амінобензенсульфокислоту.
(сульфанілова кислота)
Окремі представники Анілін - отримують у промисловості, головним чином, каталітичним відновленням нітробензену воднем у газовій фазі над Сu/SiO2 або NiS/Al2O3 при 200-300оС. Він знаходить широке застосування у синтезі барвників, ліків, прискорювачів вулканізації каучуків, антиоксидантів, поліуретанів. N,N-Диметиланілін одержують алкілуванням аніліну метанолом у присутності сульфатної кислоти під тиском. Використовують для синтезу барвників та вибухових речовин. п-Толуїдин застосовують для синтезу барвників.
ХІМІЧНІ ВЛАСТИВОСТІ Діазоарени характеризуються реакціями двох типів:
1 - реакції заміщення діазонієвої групи та виділенням азоту; 2 - реакції збереження атомів азоту без виділення N2. Всі ці реакції відбуваються при взаємодії з нуклеофільними реагентами. Реакції з виділенням азоту 1.1. Реакція Л.Гаттермана-Т.Зандмейєра (заміна діазогрупи на CI, CN, NO2, SН)
Вказані реакції каталізуються солями міді (І). Каталітична дія солей міді заключається в переносі іоном Сu (І) електрона за схемою:
Реакції без виділення азоту До реакцій, що протікають без виділення азоту, відносяться, в першу чергу, реакції відновлення та азосполучення. Реакції відновлення
Фенілгідразонійхлорид 2.2. Реакції азосполучення (отримання азосполук) Солі діазонію легко вступають у реакції з фенолами в слаболужному розчині і з ариламінами у слабокислому розчині
Вказані реакції відбуваються за механізмом SЕ, де електрофільним реагентом виступає діазокатіон
п -Диметиламіноазобензен
Діазокатіон заміщує атом водню тільки у тому ароматичному ядрі, де є сильні активуючі групи (-NR2, -OH, -OR). Азосполучення не відбувається у сильнокислому розчині, - тому що аміногрупа при цьому перетворюється в амонійну – N+R2H, яка дезактивує бензенове ядро (замісник ІІ-го роду). Феноли в кислому середовищі також протонуються, а протонована гідроксигрупа дезактивує бензенове ядро.
Реакція азосполучення відбувається у п -положенні, а якщо воно зайняте, то в о -положенні, до NН або НОгрупи. Переважна більшість ароматичних азосполук забарвлена. Багато з них використовуються як органічні барвники. Чому саме азосполуки забарвлені і як з цим пов’язана будова органічної сполуки? Відповіді на ці питання дає “теорія колірності органічних сполук”. В першу чергу усвідомлюємо, що забарвлення нерозривно зв’язане зі світлом. Нема світла – нема забарвлення. Коли ми говоримо, що трава зелена, то маємо на увазі, що вона зелена в білому світлі. Наприклад, в червоному світлі вона чорна, а в жовтому – безбарвна. Отже надалі, коли йтиметься про забарвлення, будемо мати на увазі, що воно розглядається при освітлені білим, або денним світлом. Що таке світло? Світло- це потік фотонів або квантів, тобто електромагнітних хвиль певної довжини і енергії. Весь електромагнітний спектр дуже широкий і охоплює діапазон хвиль від 10-14м (у космічних променів) до 10-6м (у змінних струмів). Наше око сприймає тільки вузьку смужку з цього спектра, з довжиною хвиль (λ) від 400 до 760 нм (4 10-7–7,6 10-7 м). Біле світло складається з суміші всіх спектральних кольорів (червоного, помаранчевого, жовтого, зеленого, блакитного, синього, фіолетового).
Якщо на поверхню тіла падає потік білого світла, то можна спостерігати такі явища: 1. Світло проходить крізь тіло. Таке тіло буде прозорим для білого світла. 2. Світло поглинається тілом. Тіло буде чорним. 3. Світло відбивається від поверхні тіла або розсіюється нею. Таке тіло буде дзеркальним або білим. 4. Тіло вибірково поглинає деякі промені з видимої частини спектра, а решта променів проходить крізь нього, або відбивається його поверхнею. Таке тіло буде забарвленим. Наприклад, якщо тіло поглинає промені з довжиною хвиль від 500 до 550 нм., що відповідають зеленому кольору, то дія на людське око інших променів з довжинами хвиль від 400 до 500 і від 550 до 760 нм буде викликати відчуття червоно-фіолетового (пурпурного) кольору. Отже, причиною забарвлення є вибіркове поглинання тілом частини світлових променів із загального потоку у видимій частині електромагнітного спектра. Як же пов’язана довжина світлової хвилі, що поглинається речовиною з її хімічною будовою? Більшість органічних речовин поглинає кванти, що відповідають ультрафіолетовій частині спектра. При цьому енергія поглинутого кванта витрачається на збудження електронів молекули. Суть збудження полягає у переході електронів з ВЗМО на НВМО (див.стор.). Чим менша різниця енергії між НВМО та ВЗМО, тим менша енергія, а значить більша довжина хвилі кванта світла, необхідного для здійснення цього переходу. Так, метан характеризується найбільш інтенсивним поглинанням квантів з довжиною хвилі 120 нм. У молекулах зі спряженими подвійними зв’язками π-електрони утворюють єдину електричну хмару, внаслідок чого рухливість π-електронів зростає і знижується енергія збудження молекули. Так, λmах для 1,3-бутадієну дорівнює 217 нм. При достатньому подовженні спряженої системи енергія її збудження знижується до величини, що відповідає енергії фотонів у видимій частині спектру і речовина набуває забарвлення. Це спостерігається, наприклад, у каротину моркви (речовини, що надає моркві характерного кольору). Наявність в його структурі ланцюга з 11 спряжених подвійних зв’язків зумовлює червоний колір з характерним фіолетовим відтінком.
(λmах.= 420-485 нм).
Система спряжених зв’язків, яка, в основному, зумовлює появу забарвлення, називається хромоформною системою, а полярні групи по її кінцях, що підсилюють здатність поглинати світло і сприяють зв’язуванню барвника з поверхнею, на яку його нанесли – називаються ауксохромами. Отже барвник має в складі молекули хромофорну систему і принаймні дві ауксохроми. Найбільш поширений клас синтетичних барвників – азобарвники. Їх синтез складається з двох стадій: 1) діазотування і 2) азосполучення. Наведемо як приклад схему синтезу азобарвника метилового помаранчевого, який до того ж є одним з найпоширеніших кислотно-основних індикаторів. 1. Діазотування ― одержання т.з. діазоскладової. В даному випадку діазотують сульфанілову кислоту:
2. Азосполучення діазоскладової з ароматичним третинним аміном (азоскладовою):
У кислому середовищі барвник знаходиться, переважно, у червоній формі, що утворюється внаслідок приєднання протона до жовтої. При додаванні лугу відбувається відщеплення протона і знову утворюється жовта форма. Відомі азобарвники, що містять у молекулі 2,3 і більше азогруп.
АЗОТОВМІСНІ СПОЛУКИ
Азотовмісні органічні сполуки містять атоми азоту, безпосередньо зв'язані з атомами вуглецю. Їх поділяють на: нітросполуки (RNO2), нітрозосполуки (RNO), аміни (RNH2, R2NH, R3N), нітрили карбонових кислот або ціаніди (RC≡N), азосполуки (RN═NR), похідні гідроксил аміну (RNH―OH) тощо. В усіх вищенаведених формулах R ― алкільний, циклоалкільний або арильний залишок. Найбільш поширені нітросполуки та аміни. АЛІФАТИЧНІ НІТРОСПОЛУКИ
Нітросполуки - похідні вуглеводнів, у яких один або декілька атомів водню заміщені на нітрогрупу —NO2. Загальна формула насичених нітросполук CnН2n+1NО2. Залежносто від природи атома вуглецю, з яким зв'язана нітрогрупа, розрізняють первинні, вторинні і третинні нітросполуки:
Нітросполуки бувають насичені і ненасичені. У цьому розділі розглянуті насичені нітросполуки ― нітроалкани. Згідно замісникової номенклатури їх називають за назвою алкану з додаванням префікса “ нітро”. Локантом показують положення нітрогрупи в головному ланцюзі, нумерацію якого починають з того кінця, ближче до якого розміщена NO2 -група (табл.1). За аналогією з іншими функціональними похідними алканів їх ізомерія залежить від положення нітрогрупи в ланцюзі і від будови самого вуглеводневого ланцюга. \ Таблиця 1 Назви нітросполук
МЕТОДИ ОДЕРЖАННЯ НІТРОСПОЛУК
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1520; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.116.231 (0.014 с.) |










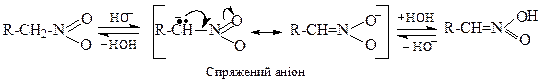




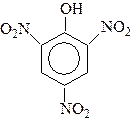 Пікринова кислота (тринітрофенол) використовується в якості вибухівки, а також барвника для вовни,.
Пікринова кислота (тринітрофенол) використовується в якості вибухівки, а також барвника для вовни,.




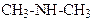







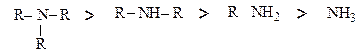





 Амінобензен 2-Метиламінобензен
Феніламін о -Толіламін(Анілін)
(Анілін) (о -Толуїдин)
Амінобензен 2-Метиламінобензен
Феніламін о -Толіламін(Анілін)
(Анілін) (о -Толуїдин)
 Метилфеніламін Диетилфеніламін
(N-метиланілін) (N,N-диетиланілін)
Метилфеніламін Диетилфеніламін
(N-метиланілін) (N,N-диетиланілін)

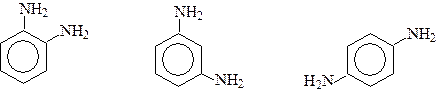





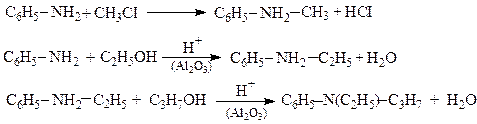



 Ариламіни є слабшими основами порівняно з аліфатичними. Це пов'язано зі спряженням неподіленої електронної пари атома азоту з π-електронами бензенового ядра (р-π-спряження). Завдяки цьому знижується здатність атома азоту реагувати з протоном Н+ (кислотою). Введення другого бензенового кільця ще більше знижує основність, Третинні ариламіни основних властивостей не проявляють. Введення електроноакцепторних груп у бензенове кільце також знижує основність ариламінів, а електронодонорних – навпаки, підвищує. Тому вказані аміни відповідно до зменшення основності можна розмістити в ряд:
Ариламіни є слабшими основами порівняно з аліфатичними. Це пов'язано зі спряженням неподіленої електронної пари атома азоту з π-електронами бензенового ядра (р-π-спряження). Завдяки цьому знижується здатність атома азоту реагувати з протоном Н+ (кислотою). Введення другого бензенового кільця ще більше знижує основність, Третинні ариламіни основних властивостей не проявляють. Введення електроноакцепторних груп у бензенове кільце також знижує основність ариламінів, а електронодонорних – навпаки, підвищує. Тому вказані аміни відповідно до зменшення основності можна розмістити в ряд:







 п -Амінобензенсульфокислота
п -Амінобензенсульфокислота




 п -Гідроксиазобензен
п -Гідроксиазобензен


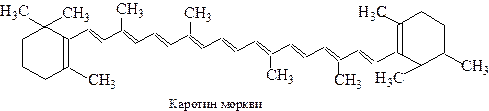
 Максимум поглинання зсувається у довгохвильову область і тоді, коли в спряжену систему входять гетероатоми. Так λmах азобензену дорівнює 440 нм. А якщо спряжена система має полярні замісники, то λmах, як правило, знаходиться у видимій частині спектра, тобто такі сполуки будуть забарвленими і можуть виконувати роль барвників.
Максимум поглинання зсувається у довгохвильову область і тоді, коли в спряжену систему входять гетероатоми. Так λmах азобензену дорівнює 440 нм. А якщо спряжена система має полярні замісники, то λmах, як правило, знаходиться у видимій частині спектра, тобто такі сполуки будуть забарвленими і можуть виконувати роль барвників.