
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Діамінобензен 1,3-діамінобензен 1,4-діамінобензенСодержание книги
Поиск на нашем сайте
СПОСОБИ ОДЕРЖАННЯ Відновлення нітросполук Найпростіший варіант цього методу – відновлення каталітично-збудженим воднем.
Існують й інші відновлювальні системи: Fe+HCI; Sn+НCI; H2S; Na2S. У промислових умовах застосовують чавунні ошурки.
Залежність вказаних реакцій від рН середовища наведена раніше (див.стор.). З галогенопохідних Отримання первинних амінів
Реакція арилювання аміаку протікає в жорстких умовах внаслідок низької реакційної здатності атома галогену, що зв'язаний з бензеновим ядром (див.стор.). В аліфатичному ряді ця реакція протікає значно легше. Отримання вторинних амінів
Дифеніламін Отримання третинних амінів
Трифеніламін Реакція алкілювання Ариламіни Ar-NH2 алкілуються галогеноалкілами R-HaI або спиртами R-OH у присутності кислот. При цьому утворюються вторинні і третинні аміни.
Етилфеніламін Етилпропілфеніламін
Для одержання вторинних амінів без домішок третинних, первинну аміногрупу попередньо захищають ацилюванням. Ацилювання здійснюється ацилюючими агентами (див.стор.), а отримані похідні називаються феніламідами відповідних кислот
Феніламід оцтової кислоти або ацетанілід або N-Ацетиланілін Захищену таким чином аміногрупу надалі можна алкілювати. Потім захист знімають гідролізом:
N-Метил-N-ацетиланілін Далі захист аміногрупи знімають шляхом гідролізу
Метилфеніламін В результаті утворюються вторинні аміни без домішок третинних.
ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
Ариламіни - отруйні рідини або тверді речовини, які окиснюються при зберіганні. Основність ариламінів.
Зменшення основності Алкілювання і ацилювання амінів Ці процеси розглянуті в розділі "Способи одержання ариламінів". Взаємодія з нітритною кислотою Ариламіни по-різному реагують з HNO2. Первинні аміни при цьому вступають у реакції діазотування з утворенням солей діазонію.
В аналогічних умовах аліфатичні аміни утворюють спирти (див.стор.). Вторинні ариламіни, як і аліфатичні, утворюють нітрозоаміни з нітрозогрупою біля азоту
N-Метил-N-нітрозоанілін Третинні ариламіни утворюють п -нітрозосполуки з нітрозогрупою у бензеновому ядрі:
п -Нітрозодиметиланілін
Третинні аліфатичні аміни з HNO2 не реагують (див. Стор). 4. Взаємодія з альдегідами (утворення основ Шіффа) Первинні аміни при взаємодії з ароматичними альдегідами утворюють основи Шіффа (азометини)
Реакції електрофільного заміщення Аміногрупа є одним з найактивніших замісників І роду, тому анілін вступає у реакції електрофільного заміщення значно легше, ніж бензен, з утворенням о - і п -заміщених. Галогенування ариламінів При галогенуванні незахищених амінів реакція супроводжується окисненням аміногрупи, наприклад:
Хлораніл Тому, її спочатку захищають, наприклад, реакцією ацилювання (див.стор.3). Ацетиламіногрупа зберігає електронодонорні властивості і в реакціях SE орієнтує новий замісник в о - та п -положення (переважноо в пара -):
Далі за допомогою лужного або кислого гідролізу ацильну групу відщеплюють.
п -Хлорофеніламін (п -Хлоранілін)
У випадку бромування у водних розчинах можна обійтися без захисту аміногрупи.
2,4,6-Триброманілін При галогенуванні амінів у розчині сильних кислот поряд з п -ізомером утворюється м -ізомер. Це пов'язано з утворенням солей амінів. Протонована аміногрупа є м -орієнтантом через втрату р- π-спряження пари електронів атому азоту з бензеновим кільцем.
Феніламонійхлорид
м -Хлоранілін Нітрування ариламінів Перед нітруванням аміногрупу, як правило, захищають шляхом ацилювання з метою запобігання її окиснення.
Сульфування ариламінів Сульфування ариламінів приводить до утворення спочатку солі, наприклад, феніламонійгідрогенсульфату, який потім при нагріванні переходить в п -амінобензенсульфокислоту.
(сульфанілова кислота)
Окремі представники Анілін - отримують у промисловості, головним чином, каталітичним відновленням нітробензену воднем у газовій фазі над Сu/SiO2 або NiS/Al2O3 при 200-300оС. Він знаходить широке застосування у синтезі барвників, ліків, прискорювачів вулканізації каучуків, антиоксидантів, поліуретанів. N,N-Диметиланілін одержують алкілуванням аніліну метанолом у присутності сульфатної кислоти під тиском. Використовують для синтезу барвників та вибухових речовин. п-Толуїдин застосовують для синтезу барвників.
|
||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 415; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.134.106 (0.008 с.) |






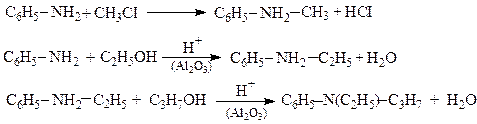



 Ариламіни є слабшими основами порівняно з аліфатичними. Це пов'язано зі спряженням неподіленої електронної пари атома азоту з π-електронами бензенового ядра (р-π-спряження). Завдяки цьому знижується здатність атома азоту реагувати з протоном Н+ (кислотою). Введення другого бензенового кільця ще більше знижує основність, Третинні ариламіни основних властивостей не проявляють. Введення електроноакцепторних груп у бензенове кільце також знижує основність ариламінів, а електронодонорних – навпаки, підвищує. Тому вказані аміни відповідно до зменшення основності можна розмістити в ряд:
Ариламіни є слабшими основами порівняно з аліфатичними. Це пов'язано зі спряженням неподіленої електронної пари атома азоту з π-електронами бензенового ядра (р-π-спряження). Завдяки цьому знижується здатність атома азоту реагувати з протоном Н+ (кислотою). Введення другого бензенового кільця ще більше знижує основність, Третинні ариламіни основних властивостей не проявляють. Введення електроноакцепторних груп у бензенове кільце також знижує основність ариламінів, а електронодонорних – навпаки, підвищує. Тому вказані аміни відповідно до зменшення основності можна розмістити в ряд:
 Фенілдіазонійхлорид
Фенілдіазонійхлорид









 п -Амінобензенсульфокислота
п -Амінобензенсульфокислота


