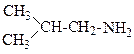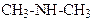Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пряме нітрування аренів та їх похіднихСодержание книги Поиск на нашем сайте 1.1.Нітрування нітруючою сумішшю (HNO3 + H2SO4). Реакція нітрування являється реакцією електрофільного заміщення. Електрофіл ― нітроній катіон (NO2+) утворюється за реакцією:
Далі реалізується звичайний механізм електрофільного заміщення:
Замісники І-го роду прискорюють, а ІІ-го роду сповільнюють реакцію нітрування. 1.2. Нітрування концентрованою HNO3. Концентрована нітратна кислота також є ефективним нітруючим агентом. Утворення йону нітронію протікає за схемою автопротолізу:
Причому, чим менше Н2О в реаційному середовищі, тим менше катіон сольватований і тим вища його активність. Тому, 100%-на HNO3 є дуже ефективним нітруючим реагентом. Друга нітрогрупа може бути введена в м -положення у жорстіших умовах і з меншим виходом.
Третю нітрогрупу можна ввести лише за допомогою спеціальних нітруючих агентів, наприклад тетрафтороборатнітронію [NO2]+ BF4─, але і в цьому випадку вихід 1,3,5-тринітробензену не високий. Схема нітрування толуену
Нітрування бічного ланцюга аренів Нітрування бічного ланцюга здійснюється розведеною НNO3 за реакцією Коновалова. Процес протікає за радикальним механізмом і завжди супроводжується окисленням вихідного арену.
Механізм реакції нітрування:
Окиснення аренамінів Аміногрупа – NH2 здатна окислюватися до нітрогрупи за умови, що окиснювачі не окиснюють бензенове кільце.
Взаємодія галогенопохідних з нітритом срібла У такий спосіб можна одержати нітросполуки з нітрогрупою в боковому ланцюзі.
Фізичні та хімічні властивості Мононітроарени – рідкі або тверді речовини, мають запах мигдалю і дуже отруйні. У воді не розчиняються, є сильно полярними розчинниками. Ди- і полінітроарени – кристалічні речовини. Реакції відновлення нітрогрупи Відновлення NО2-групи в NH2 - це складний процес, напрям протікання якого залежить, в основному, від рН-середовища. У 1842 р. дану реакцію відкрив Зінін М.М.
1.1. Середовище кисле та нейтральне (рН ≤ 7). Основним продуктом реакції є анілін
Виділити проміжні продукти, як правило, не вдається. 1.2. Середовище лужне (рН > 7). Спочатку реакція протікає за аналогією із вищенаведеною схемою. Утворені нітрозобензен та фенілгідроксиламін у лужному середовищі утворюють азоксибензен, який далі відновлюється до аніліну. Однак, проміжні продукти - азобензен та гідразобензен також можна виділити.
Вказані реакції мають важливе значення для виробництва барвників. 2. Реакції електрофільного заміщення SE Нітрогрупа, як замісник ІІ-го роду, сповільнює взаємодію з новим електрофільним реагентом і направляє його в м -положення (див.стор.).
м -Нітробензенсульфонова кислота 3. Реакції нуклеофільного заміщення SN. Наявність у бензеновому ядрі нітрогрупи, однієї з найсильніших акцепторів електронів, зумовлює можливість протікання реакцій нуклеофільного заміщення. Нітроарени з однією нітрогрупою погано взаємодіють навіть з сильними нуклеофільними реагентами
Краще взаємодіють динітросполуки:
Полінітроарени здатні утворювати π-комплекси або комплекси з переносом заряду (КПЗ) з нуклеофілами, якими можуть бути арени з підвищеною електронною густиною в ядрі.
Вплив нітрогрупи на реакції SN галогенонітроаренів. Нітрогрупа є сильний акцептор електронів і помітно впливає на рухливість галогена в о - і п -положеннях (див.стор.). Такі галогенонітроарени легко вступають у реакції нуклеофільного заміщення.
Ще більше впливають на рухливість галогену дві нітрогрупи в ядрі:
Таутомерія фенілнітрометану Фенілнітрометан, як і первинні та вторинні аліфатичні нітросполуки, здатний до таутомерії. Під дією лугів сполуки типу фенілнітрометану утворюють солі ациформ (див.стор.).
Ця реакція дозволяє відрізнити нітросполуки з NO2- у бічному ланцюзі від нітросполук з NO2-групою в ядрі. Окремі представники Нітробензен одержують нітруванням бензену, його використовують як розчинник, а також в органічному синтезі. Тринітротолуєн одержують нітруваням нітротолуєнів 100%-ною НNO3 в суміші з H2SO4. Застосовують як вибухову речовину (тротил, тол).
АЛIФАТИЧНI АМIНИ
Аміни можна розглядати як похідні аміаку (NН3), в якому атоми водню заміщені на вуглеводневі залишки (алкільні групи). Розрізняють первинні, вторинні і третинні аміни:
Аміак Первинний Вторинний Третинний амін амін амін
За замісниковою номенклатурою IUPAC назви амінів утворюють шляхом додавання префіксу " аміно " або суфіксу " амін " до назви алкану і локантом показують положення аміногрупи у вуглеводневому ланцюзі (Табл.2). За радикало-функціональною номенклатурою IUPAC перелічують за алфавітним порядком назви алкільних залишків, що сполучені з азотом і додають суфікс " амін. Таблиця 2 Назви аліфатичних амінів
МЕТОДИ ОДЕРЖАННЯ
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1010; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.005 с.) |

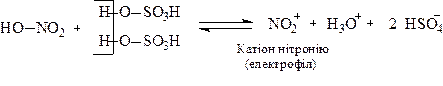



















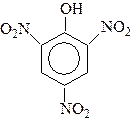 Пікринова кислота (тринітрофенол) використовується в якості вибухівки, а також барвника для вовни,.
Пікринова кислота (тринітрофенол) використовується в якості вибухівки, а також барвника для вовни,.