
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость скорости реакции от температуры.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени. Различают среднюю скорость где Δс=с2-с1 – изменение концентрации вещества за промежуток времени Δt=t2-t1. Знак (+) означает, что вещество образуется, а знак (-) – что вещество расходуется в ходе реакции. Основными факторами, определяющими скорость реакции, являются концентрация, температура и катализатор. Скорость реакций с участием газообразных реагентов зависит также от давления. Зависимость скорости реакции от температуры. Для большинства реакций справедливо правило Вант-Гоффа: Повышение температуры на 10К увеличивает скорость большинства реакций в 2-4 раза:
где Молекулы газов и жидкостей испытывают ежесекундно огромное число столкновений. Только очень малая доля столкновений заканчивается химическими превращениями. Такие столкновения называются эффективными соударениями. Молекулы - активными молекулами с большей энергией. Избыточная энергия необходима молекулам для преодоления сил отталкивания внешних электронных оболочек и для образования активированного комплекса, т.е. промежуточного соединения между исходными веществами и конечными продуктами. В активированном комплексе старые связи еще не полностью разрушены, а новые еще не полностью образовались.
Изменение энергии в ходе химической реакции показано схемой процесса активации (рис.3.2). По оси ординат отложена потенциальная энергия системы. Абсцисса - координата реакции или реакционного пути. В процессе химического превращения переход системы из начального состояния с энергией ΣНi в конечное состояние с ΣНf происходит через энергетический барьер Энергия активации (Е*) - это энергия, необходимая для перевода в состояние активированного комплекса 1 моль реагирующих веществ. Разность ΣНf - ΣНi составляет тепловой эффект реакции (ΔrH). Для обратной реакции тепловой эффект будет иметь ту же величину, но противоположный знак. Для обратной реакции энергия активации составит величину. Зависимость константы скорости химической реакции от температуры описывается уравнением Аррениуса: где k – константа скорости реакции; ko – константа, зависящая от природы реагирующих веществ; Е* - энергия активации; R – универсальная газовая постоянная; Т – температура, К. Константа скорости, а следовательно и скорость химической реакции экспоненциально растет с увеличением температуры. Уравнение Аррениуса Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции Согласно простой модели столкновений химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации
Здесь В рамках теории активных соударений
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений В рамках теории активированного комплекса получаются другие зависимости Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1326; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.007 с.) |


 (3.9)
(3.9) - скорости реакции при Т1 и Т2; γ – термический коэффициент скорости химической реакции
- скорости реакции при Т1 и Т2; γ – термический коэффициент скорости химической реакции 


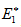 .
.
 (3.10)
(3.10) от температуры
от температуры  .
. ), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией
), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией  , пропорционально
, пропорционально  . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
 характеризует частоту столкновений реагирующих молекул,
характеризует частоту столкновений реагирующих молекул,  — универсальная газовая постоянная.
— универсальная газовая постоянная.



