
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика биологических процессовСодержание книги
Поиск на нашем сайте Кинетическая классификация химических реакций. Типы реакций. Согласно кинетической классификации, реакции делят на простые и сложные. В простой реакции реагенты непосредственно превращаются в конечные продукты без образования промежуточных, в реакционной системе отсутствуют катализаторы и ингибиторы, а химический процесс состоит из однотипных элементарных актов. Сложная (многостадийная) реакция состоит из элементарных стадий, связанных друг с другом через реагенты или продукты. Суммарные признаки кинетически простой и сложной реакций приведены в табл. 2.1.1. Кинетические признаки, лежащие в основе различий простой и сложной реакций
Другой тип кинетической классификации химических реакций основан на делении простых реакций по числу частиц, участвующих в превращениях: мономолекулярная реакция — реакция, в элементарном акте которой превращается одна частица (молекула, радикал, ион); бимолекулярная реакция — реакция, в которой претерпевают превращения две частицы (молекула, радикал, ион); тримолекулярная реакция — реакция, протекающая с участием трех частиц при их одновременном столкновении. Основные типы простых мономолекулярных и бимолекулярных реакций приведены в табл. 2.1.2. Таблица 2.1.2 Типы простых мономолекулярных и бимолекулярных реакций
Тримолекулярные реакции характерны для каталитических и ингибированных процессов, а также процессов, протекающих с выделением значительного количества энергии, когда стабилизация образовавшейся в ходе бимолекулярной химической реакции молекулы достигается путем передачи энергии третьей частице.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 461; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.005 с.) |

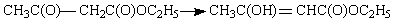

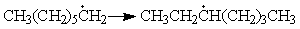 Диссоциация — распад молекулы, связанный с разрывом одной связи:
Диссоциация — распад молекулы, связанный с разрывом одной связи:


 Реакции электрофильного и нуклеофильного замещения— реакции замены активной группы в молекуле на другую группу:
Реакции электрофильного и нуклеофильного замещения— реакции замены активной группы в молекуле на другую группу:


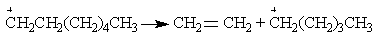
 Реакция элиминирования — распад многоатомной молекулы на несколько молекул:
Реакция элиминирования — распад многоатомной молекулы на несколько молекул:


 Реакция рекомбинации — взаимодействие двух атомов, радикалов, ионов, приводящее к образованию молекулярного продукта:
Реакция рекомбинации — взаимодействие двух атомов, радикалов, ионов, приводящее к образованию молекулярного продукта:
 Реакция диспропорционирования—перераспределение атомов или их группировок между двумя одинаковыми молекулами, радикалами в результате их взаимодействия:
Реакция диспропорционирования—перераспределение атомов или их группировок между двумя одинаковыми молекулами, радикалами в результате их взаимодействия:





