
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
График Аррениуса для биологических процессовСодержание книги
Поиск на нашем сайте Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если бы каждое столкновение приводило к химическому взаимодействию частиц, все реакции протекали бы практически мгновенно. С. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации. Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию. Рассмотрим путь некоторой элементарной реакции А + В ––> С Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом: А ––> K# ––> B Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и атомных ядер при сближении частиц и, во-вторых, необходимостью построения определенной пространственной конфигурации атомов в активированном комплексе и перераспределения электронной плотности. Таким образом, по пути из начального состояния в конечное система должна преодолеть своего рода энергетический барьер. Энергия активации реакции приближённо равна превышению средней энергии активированного комплекса над средним уровнем энергии реагентов. Очевидно, что если прямая реакция является экзотермической, то энергия активации обратной реакции Е'А выше, нежели энергия активации прямой реакции EA. Энергии активации прямой и обратной реакции связаны друг с другом через изменение внутренней энергии в ходе реакции. Вышесказанное можно проиллюстрировать с помощью энергетической диаграммы химической реакции (рис. 2.5).
Рис. 2.5 Энергетическая диаграмма химической реакции. Eисх – средняя энергия частиц исходных веществ, Eпрод – средняя энергия частиц продуктов реакции Поскольку температура есть мера средней кинетической энергии частиц, повышение температуры приводит к увеличению доли частиц, энергия которых равна или больше энергии активации, что приводит к увеличению константы скорости реакции (рис.2.6):
Рис. 2.6 Распределение частиц по энергии Здесь nЕ/N – доля частиц, обладающих энергией E; Ei - средняя энергия частиц при температуре Ti (T1 < T2 < T3) Рассмотрим термодинамический вывод выражения, описывающего зависимость константы скорости реакции от температуры и величины энергии активации – уравнения Аррениуса. Согласно уравнению изобары Вант-Гоффа,
Поскольку константа равновесия есть отношение констант скоростей прямой и обратной реакции, можно переписать выражение (II.31) следующим образом:
Представив изменение энтальпии реакции ΔHº в виде разности двух величин E1 и E2, получаем:
Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA – энергия активации:
После неопределенного интегрирования выражения (II.35) получим уравнение Аррениуса в интегральной форме:
Рис. 2.7 Зависимость логарифма константы скорости химической реакции от обратной температуры. Здесь A – постоянная интегрирования. Из уравнения (II.37) нетрудно показать физический смысл предэкспоненциального множителя A, который равен константе скорости реакции при температуре, стремящейся к бесконечности. Как видно из выражения (II.36), логарифм константы скорости линейно зависит от обратной температуры (рис.2.7); величину энергии активации EA и логарифм предэкспоненциального множителя A можно определить графически (тангенс угла наклона прямой к оси абсцисс и отрезок, отсекаемый прямой на оси ординат).
Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать величину константы скорости при любой температуре T2:
5-6 вопрос (нехуй было сплошной текст кидать!) Свет, или оптическое излучение, представляет собой волны электромагнитного поля. Световые волны являются плоскопоперечными, они распространяются перпендикулярно направлению электрического и магнитного полей. Основными характеристиками светового излучения являются: · частота колебаний – величина, равная числу полных колебаний напряженности электромагнитного поля, совершаемых в единицу времени (в 1 с); · длина волны – расстояние, на которое распространяется в данной · среде фронт монохроматической световой волны за один период световых колебаний; · волновое число – величина, обратная длине волны. В фотометрических методах используют избирательное поглощение света молекулами анализируемого вещества. При поглощении света атомы и молекулы анализируемых веществ переходят в новое возбужденное состояние. Возбужденная молекула обладает набором дискретных квантованных энергетических состояний, называемых энергетическими уровнями молекулы. Согласно квантовой механике, свет представляет собой поток частиц, называемых квантами, или фотонами. Энергия каждого кванта определяется длиной волны излучения. В результате поглощения излучения молекула поглощающего вещества переходит из основного состояния с минимальной энергией E1 в более высокое энергетическое состояние Е2. Электронные переходы, вызванные поглощением строго определенных квантов световой энергии, характеризуются наличием строго определенных полос поглощения в электронных спектрах поглощающих молекул. При этом поглощение света происходит только в том случае, когда энергия поглощаемого молекулой кванта совпадает с разностью энергий между квантовыми энергетическими уровнями E2 и E1 поглощающей свет молекулы – ∆Е:hν= ∆Е = Е2 – E1, где h – постоянная Планка (h = 6,625 Ч 10–3 Дж·с); ν – частота поглощаемого излучения, которая определяется энергией поглощенного кванта и выражается отношением скорости распространения излучения с (скорости световой волны в вакууме с = 3Ч1010 см/с) к длине волны λ; ν = с/λ. Частота излучения ν измеряется в обратных секундах (с–1), герцах (Гц): 1 Гц = 1 с–1. Длина волны λ измеряется в ангстремах (1 Е = 1Ч10–8 см), микрометрах или микронах (1 мкм = 1 мк = 1Ч10–6 м), нанометрах или миллимикронах (1 нм = 1 ммк = 10 Е = 1Ч10–9 м). Для характеристики участка спектра часто используют также волновое число θ, которое показывает, какое число длин волн приходится на 1 см пути излучения в вакууме. Величина волнового числа определяется соотношением: θ = 1 / λ. Природа полос поглощения в ультрафиолетовой (10–400 нм) и видимой (400–750 нм) областях спектра одинакова и связана главным образом с числом и расположением электронов в поглощающих молекулах и ионах. В инфракрасной области (750 нм и выше) она в большей степени связана с колебаниями атомов в молекулах поглощающего вещества. Различают три основные спектральные области оптического излучения: инфракрасная (ИК – от 750 до 2500 нм), видимая (400–750 нм) и ультрафиолетовая (УФ – от 10 до 400 нм). Дополнительно в УФ-области спектра выделяют следующие диапазоны: вакуумный (ВУФ) – 10–200 нм, коротковолновый (КУФ) – 200–280 нм, средневолновый (СУФ) – 280–315 нм и длинноволновый ультрафиолет (ДУФ) – 315–400 нм. В медицине принято разделение УФ-излучения на УФ-А, УФ-В, УФ-С диапазоны (ДУФ, СУФ и КУФ соответственно). В простой молекуле способен возбуждаться любой электрон. Требуемая для этого энергия зависит, прежде всего, от типа занимаемой им орбитали. Из схемы, представленной на рис. 2.2, видно, что для возбуждения электрона на σ-орбитали необходима наиболее высокая энергия. Следовательно, труднее всего возбудить электроны в таких простых органических молекулах, как насыщенные углеводороды. Единственными доступными электронами у них являются электроны σ-связей, и для перехода электрона σ-связи на разрыхляющую σ*-орбиталь необходимо поглощение большого количества энергии. Так, переход σ → σ* для метана, соединения с одинарными связями между атомами, соответствует поглощению при Е > 600 кДж/моль. Это количество энергии может дать электромагнитное излучение в УФдиапазоне при λ ≈ 122 нм. Меньшему значению энергии соответствует переход на разрыхляющие π*-орбитали. Известно, что молекулы большинства веществ, поглощающих свет в видимой и ближней ультрафиолетовой областях спектра, обладают системой сопряженных двойных связей, например, углерод-углеродная двойная связь С = С, которая может рассматриваться как π-связь. Переход электрона со связывающей π-орбитали на разрыхляющую π*-орбиталь достигается значительно легче, чем переход σ → σ*. Меньшее количество энергии, которое при этом необходимо, может быть обеспечено УФ-излучением при λ ≈ 162 нм (например, для этилена СН2 = СН2). Наряду с системой сопряженных двойных связей многие поглощающие электромагнитное излучение молекулы имеют в своем составе гетероатомы, такие как атомы кислорода (например, карбонильная группа >С = О пептидных связей белков) или азота (индольное кольцо триптофана), входящие в систему сопряженных связей или непосредственно примыкающие к ней (n-орбитали). На рис. 2.2 видно, что энергия верхних заполненных электронных уровней у неподеленных электронов (т. е. электронов, не участвующих в образовании химических связей) таких гетероатомов значительно превышает не только энергию σ-электронов, образующих одинарные связи между атомами (σ-орбитали), но и энергию заполненных орбиталей сопряженных двойных связей (π-орбитали). Переход несвязывающего неспаренного n-электрона при поглощении фотона может происходить на разрыхляющую σ*-орбиталь. Переход n → σ* требует еще меньших затрат энергии. Полосы, вызванные этим переходом, расположены в диапазоне длин волн λ, равных 200–300 нм. Из приведенной на рис. 2.2 схемы видно, что наименьшее количество энергии необходимо для n → π*-перехода. Длина волны максимума полосы поглощения n → π*-перехода карбонильной группы >С = О соответствует примерно 280 нм. Именно переходы π → π* и n → π* встречаются в молекулах соедине- ний с сопряженными связями и молекулах ароматических соединений. Переход электрона в возбужденное состояние на более высокий энер- гетический уровень происходит чрезвычайно быстро (~10-15 с). В течение этого времени более тяжелые атомные ядра не успевают сколько-нибудь заметно переместиться. Следовательно, во время переходов электрона положения ядер (межъядерное расстояние) практически не меняются (принцип Франка–Кондона). Взаимодействие света с веществом описывается рядом законов, основ- ными из которых являются: 1. Закон Гротгуса–Дрейпера: химически активным является излучение с такими длинами волн, которые поглощаются веществом. Этот закон не имеет исключений. 2. Закон Вант–Гоффа: количество химически модифицированного све-том вещества прямо пропорционально количеству поглощенной веществом энергии света. 3. Закон Бугера–Ламберта-Бера для монохроматического света: однородные слои одного и того же вещества одинаковой толщины поглощают одну и ту же долю падающей на них световой энергии (при постоянной концентрации растворенного вещества). Математически этот закон выражается уравнением экспоненциальной зависимости: I = Ioe-εcl, где ε – молярный коэффициент экстинкции (поглощения); с – концентрация вещества (моль/л); l – длина оптического пути (толщина слоя вещества). Коэффициент экстинкции характеризует способность молекул вещества поглощать свет определенной длины волны и зависит от структурных особенностей молекул данного вещества. Закон Бугера–Ламберта–Бера выведен для достаточно разбавленных растворов при использовании монохроматического света. Значительные отклонения от закона могут быть обусловлены: o свойствами анализируемого образца, способностью молекул вещества при больших концентрациях образовывать агрегаты, что приводит к росту светорассеяния и кажущемуся повышению его оптической плотности; o конструкцией прибора – использование немонохроматического пуч-ка света, работа в области, где погрешности прибора максимальны. Для характеристики поглощающей способности вещества используют ткие величины, как оптическая плотность, светопропускание и светопоглощение. Оптическая плотность (D) – это десятичный логарифм отношения интенсивности света, падающего на образец (Io), к интенсивности света, выходящего из образца (I): D = lg Io/I. Оптическая плотность является безразмерной величиной. Светопропускание (Т) – отношение интенсивности света, вышедшего из образца, к интенсивности света, падающего на образец: Т = I/Iо. Светопропускание не зависит от интенсивности света, но зависит от длины волны и может служить характеристикой данного образца. Светопропускание измеряется в процентах. Светопоглощение – величина, равная 1 – Т; измеряется в долях или процентах. Важнейшим следствием из закона Бугера–Ламберта–Бера является сле-дующее положение: оптическая плотность прямо пропорциональна концентрации данного вещества: D = εcl, где ε – молярный коэффициент экстинкции (поглощения). Раствор с концентрацией 1 моль/л в кювете толщиной в 1 см имеет оптическую плотность D, равную ε. Молярный коэффициент поглощения зависит от длины волны падающего света, природы растворенного вещества, температуры раствора и не зависит от условий измерения. Поэтому ε характеризует способность молекул данного вещества поглощать свет той или иной длины волны, т. е. является индивидуальной характеристикой поглощательной способности вещества при данной длине волны. Размерность молярного коэффициента экстинкции ε – М–1·см–1. При графическом изображении зависимости оптической плотности от концентрации (при постоянном значении l) получается прямая линия. Эта прямая проходит через начало координат при отсутствии поглощения растворителем или других погрешностей. Отклонения от закона Бугера–Ламберта–Бера могут быть вызваны и посторонними веществами, присутствующими в растворе. Измерив оптическую плотность раствора в кювете толщиной 1 см (точ- нее, в кювете с длиной оптического пути, равной 1 см), по значению моляр-ного коэффициента экстинкции можно определить концентрацию раствора(моль/л): с = D/ε. Поглощение света осуществляется не всей молекулой, а определенны- ми ее участками – хромофорами. Хромофоры – это отдельные химические группы только одного типа атомов в молекуле вещества, поглощающие кванты света в УФ- и видимой областях спектра. Основными хромофорами в белках являются пептидные группы, ароматические аминокислоты и цис-теин. Все они поглощают в УФ-области спектра. В нуклеиновых кислотах основными хромофорами являются пуриновые и пиримидиновые азотистые основания нуклеотидов, поглощающие в диапазоне длин волн 255–270 нм. Хромофорами сложных белков, в частности, гемопротеидов, в видимой области является гем. Так, благодаря железопорфирину в составе белка рас-твор оксигемоглобина обнаруживает несколько максимумов поглощения в этой области спектра: самый значительный (интенсивный) в области 412–414 нм (полоса Соре), принадлежащей порфириновой части молекулы, и максимумы меньшей интенсивности при 540 и 575 нм. Однокомпонентные неокрашенные белки (сывороточный альбумин, пепсин, трипсин, глобулины и др.) не поглощают свет с длинами волн 400–700 нм. С помощью спектральных методов, измеряя оптическую плотность, можно получить следующую информацию: их оптических свойствах, Спектры поглощения Спектр поглощения, или, более корректно, абсолютный спектр поглощения вещества, представляет собой зависимость количества поглощенного света от длины волны. Такие спектры для красителей в видимой области (400–700 нм) имеют иногда несколько максимумов. Спектры поглощения в ультрафиолетовой (200–400 нм) и видимых областях отражают переходы связанных и несвязанных электронов в молекуле. Это обычно делокализованные π-электроны двойных С = С связей (связанные) и n-электроны неподеленных пар гетероатомов (азота, кислорода, серы, фосфора). Причем, можно отметить следующую особенность: чем длиннее система сопряженных двойных связей в молекуле, т. е. чем сильнее делокализованы по молекуле π-электроны, тем при большей длине волны располагается спектр по-глощения. Спектры поглощения биологически важных веществ представляют собой сравнительно плавные кривые с одним или несколькими максимумами. У атомов и простых молекул в газовой фазе спектры поглощения линейчатые. Поскольку, как правило, все электроны в молекуле при комнатной тем-пературе находятся на нижнем энергетическом уровне, спектры в этой области дают информацию об основном и первом возбужденном электронных состояниях молекулы. Ввиду того, что длина волны поглощенного света соответствует опре-деленному переходу, пики на спектрах поглощения вещества обусловлены присутствием в нем известных структур. Длина волны, при которой наблюдается максимальное поглощение света, обозначается λмакс. Положение максимума спектра поглощения является важной оптической характеристикой вещества, а характер и вид спектра поглощения характеризуют его качественную индивидуальность. Спектр поглощения является индивидуальной характеристикой вещества и определяется в первую очередь химической структурой молекулы. Однако λмакс и ε проявляют некоторые изменения в зависимости от того, в какой среде исследуется образец. На положение максимума спектра поглощения и значение молярного коэффициента поглощения оказывает влияние рН среды, полярность растворителя, присутствие в растворе других молекул и др. Именно эти факторы лежат в основе использования абсорбционных методов для характеристики макромолекул. Соответственно, группа в молекуле вещества, которая определяет максимальный вклад в спектр ее поглощения, и называется хромофором. Такой группой является, например, карбонильная группа >С=О, присутствующая у всех аминокислот. К основным хромофорам белка относятся остатки ароматических кислот: триптофан и в меньшей степени тирозин и фенилаланин.
Спектр поглощения триптофана, обусловленный его индольным коль-цом с системой сопряженных связей, обладает двумя полосами поглощения с максимумами при 220 и 280 нм. При образовании сопряженных связей в молекуле энергия возбужденного состояния электронов может уменьшаться, и, следовательно, хромофор начинает поглощать свет большей длины волны. Такой сдвиг в спектрах поглощения называется батохромным. Наоборот, сдвиг спектра в коротковолновую область именуется гипохромным. Гиперхромный и гипохромный эффекты – это соответственно увеличение и уменьшение экстинкции. Гипохромный эффект, например, используется для оценки степени спиральности (упорядоченности) белков. Обнаружить очень близко расположенные линии колебательных и вращательных переходов в спектрах молекул удается лишь при высоком разрешении (разрешением называется способность прибора различать две близко расположенные линии). Кроме остатков ароматических аминокислот в общий спектр поглощения белка вносят вклад и другие хромофорные группировки. В области спектра 220–255 нм поглощают серосодержащие аминокислоты – цистеин, цистин, метионин. В области спектра 190 нм – пептидные группы белковой молекулы. Полосы поглощения белков, и особенно полоса при 280 нм, чувствительны к разнообразным влияниям, которые действуют на π-электроны ароматических аминокислот. К ним относятся – различные типы комплексообразования, ионные и дипольные взаимодействия, образование водородных и иных связей. Анализ спектральных характеристик белковых образцов дает возможность получить надежную информацию о состоянии белковой молекулы в норме, в условиях различного микроокружения, при действии физико-химических агентов, а также при развитии в организме патологических процессов и пр. Фотопроцессы в биологических системах начинаются с поглощения света хромофором исследуемого объекта и сопровождаются возникновением электронновозбужденного состояния, характеризующегося определенной энергией, временем жизни, структурными свойствами. Через какое-то непродолжительное время молекула теряет избыток энергии и возвращается в исходное состояние. Одним из способов дезактивации электронно-возбужденного состояния (перехода в исходное) является флуоресценция. Флуоресценция – это физический внутримолекулярный процесс, в результате которого молекула за время, составляющее 10-8–10-9 с, переходит в основное состояние с испусканием кванта света. Как и в случае поглощения, здесь реализуется принцип Франка–Кондона. Поскольку по сравнению с поглощением испускание света происходит в течение более длительного времени, в структуре биомолекулы за этот период может произойти ряд изменений. Эти структурные перестройки оказывают влияние на параметры флуоресценции системы, которые позволяют получить информацию об ее электронновозбужденных состояниях. Полная энергия состояния молекулы Е складывается из энергии элек- тронного возбуждения Ее, колебательной энергии Ev и вращательной энергии Er. Таким образом, при поглощении кванта света полное изменение энергии молекулы можно представить следующим образом: hυ = ∆ Ее + ∆ Ev + ∆ Er, при этом Ее>> Ev> Er. Поглощение и испускание света хорошо иллюстрирует диаграмма уровней энергии, предложенная Яблонским.
(So – основное (невозбужденное) состояние; S1, S2 и T1 – возбужденные синглетные и триплетные состояния соответственно; жирные горизонтальные линии – электронные уровни энергии, тонкие – 0, 1, 2, 3, 4 – колебательные подуровни. Прямые стрелки между уровнями – излучательные переходы, волнистые – безызлучательные. ВК – внутренняя конверсия (переходы электрона без обращения спина); ИК – интеркомбинационная конверсия (переходы электрона с обращением спина)) При поглощении кванта света молекулой осуществляется переход с са- мого нижнего колебательного подуровня основного состояния на возбужденные уровни S1, S2 или Sn, которые также характеризуются своими колебательными и вращательными подуровнями. Термин «синглетные уровни» указывает на то, что спин электрона при поглощении фотона и переходе на более высокий энергетический уровень не изменяется. При переходе между уровнями So, S1, S2 спины электронов также не изменяются. В молекулах большинства соединений при возбуждении электронных состояний, расположенных выше первого синглетного возбужденного состояния S1, происходит быстрая внутренняя конверсия (со временем порядка 10–13 с). Внутренняя конверсия – это отдача избытка электронной и колебательной энергии окружающей среде безызлучательным путем из-за соударений с молекулами растворителя. Внутренняя конверсия осуществляется за счет перехода электрона с нижнего колебательного подуровня верхнего состояния Sn на верхний колебательный подуровень состояния S1 с последующей релаксацией на самый нижний колебательный подуровень возбужденного состояния S1. Это означает, что независимо от того, в какое электоронно-возбужденное состояние была переведена молекула во время поглощения кванта света, в течение 10-13–10-12 с она перейдет на нижний колебательный подуровень возбужденного состояния S1. Время жизни молекул в S1-состоянии состав-ляет 10-8–10-9 с. Именно на уровне S1 решается дальнейшая судьба всех возбужденных молекул. От этого состояния берут начало все последующие, конкурирующие между собой фотофизические процессы, в конечном счете приводящие к дезактивации возбужденной молекулы. Некоторые молекулы с большой вероятностью переходят из синглетного возбужденного состояния в триплетное, и этот переход сопровождается изменением спина электрона. Такой процесс является внутримолекулярным безызлучательным интеркомбинационным переходом и называется интеркомбинационной конверсией.
Одним из путей возвращения молекулы в основное состояние является излучательная дезактивация с испусканием фотона. Это явление, как указывалось выше, называется флуоресценцией (см. рис. 3.1 и 3.2).
Именно при переходе с уровня S1 на любой колебательно-вращательный подуровень основного состояния S0 и происходит излучение кванта света. В общем случае флуоресценцией называют разрешенный по спину излучательный переход между двумя состояниями одинаковой мультиплетности, а именно, между синглетными уровнями S1→So. Скорость испускания фотоэлектронов составляет около 10-8 с. Конечная длительность излучения составляет 10-8–10-9 с. Сравнительно небольшое время жизни синглетного возбужденного состояния объясняется тем, что переход с уровня S1 на S0 относится к разрешенным по спину и происходит с высокой вероятностью. Однако возбужденная молекула не всегда флуоресцирует. Эффективность флуоресценции описывается квантовым выходом флуоресценции – отношением количества излученных квантов к числу поглощенных. Иными словами, квантовый выход флуоресценции отражает вероятность дезактивации синглетного возбужденного состояния по излучательному пути. Испускание фотона может происходить и при переходе молекулы из триплетного состояния в основное. Это явление называется фосфоресценцией. Время жизни молекулы в триплетном состоянии относительно велико, что связано с изменением спинового состояния электрона при испускании фотона. В противоположность флуоресценции характеристическое время фосфоресценции составляет значительную величину: от 10-6 до нескольких секунд. Поскольку переход с Т1 на S0 уровень относится к запрещенным по спину, он происходит с низкой вероятностью и, соответственно, с низкой скоростью (именно фосфоресценция является причиной свечения некоторых минералов в темноте после их предварительного облучения солнечным светом). Общий термин для любых излучательных переходов (флуоресценции и фосфоресценции) – люминесценция. Многие биологически важные соединения, такие как белки, каротинои-ды, хлорофилл, флавины и др., обладают свойством излучательной дезактивации синглетного электронновозбужденного состояния, т. е. флуоресцеции. Такая флуоресценция называется собственной: S1 → S0 + hνфл. Например, собственная флуоресценция белков обусловлена ароматиче-скими аминокислотами, входящими в их состав, причем из трех флуоресци-рующих аминокислот (фенилаланин, тирозин, триптофан) наибольший вклад в собственную флуоресценцию белка вносит триптофан. Флуоресценция белков обычно возбуждается в максимуме поглощения при 280 нм или бульших длинах волн. Основная цель изучения собственной флуоресценции белков – получение информации об их конформационном состоянии. Возможность получения такой информации обусловлена тем, что как флуоресценция триптофана, так и флуоресценция тирозина существенно зависят от микроокружения хромофора в молекуле белка (т. е. растворителя, рН, присутствия малой молекулы тушителя или соседних групп в белке). Так, например, при уменьшении полярности растворителя флуоресценция триптофана смещается в область более коротких длин волн. Спектр флуоресценции – это зависимость интенсивности флуоресценции образца от длины волны: Iфл = f (λ), где Iфл – интенсивность света флуоресценции в относительных единицах, измеренная при длине волны λ. При измерении интенсивности флуоресценции существенным является подбор концентрации исследуемого вещества. Чтобы поглощение света, а следовательно, и флуоресценция происходили равномерно по всей толщи-не раствора, при измерении пользуются разбавленными растворами, оптическая плотность которых не превышает 0,1–0,2. Интенсивность флуоресценции возрастает с увеличением интенсивности возбуждающего света (Iо) и в разбавленных растворах пропорциональна концентрации вещества. Поскольку энергия поглощенного кванта частично расходуется на тепловые колебания, испускание флуоресценции всегда происходит с нижнего колебательного подуровня возбужденного состояния S1. Потеря энергии поглощенного кванта происходит дважды. По этой причине спектр флуоресценции относительно спектра поглощения сдвинут в более длинноволновую сторону (закон Стокса).
Кроме того, благодаря процессам внутренней конверсии спектры флуоресценции не зависят от длины волны возбуждающего света (правило Кашѝ). Параметры флуоресценции (интенсивность, квантовый выход, положение максимума спектра, поляризация) очень чувствительны к структуре окружения флуоресцирующего хромофора (флуорофора). Макромолекулы глобулярных белков в водном растворе в нативной конформации представляют собой компактные плотные глобулы. Совершенно очевидно, что остатки триптофана в белке не унифицированы по локализации и свойствам окружения. Микроокружение каждого из них характеризуется своим набором физи-ко-химических условий, таких как диэлектрическая постоянная, микровязкость, наличие или отсутствие заряженных групп, различные специфические взаимодействия. Так, например, положение максимумов флуоресценции триптофанилов в составе отдельных белков имеют значения от 308 (азурин) до 342 нм (папаин). Изменение физико-химического состояния макромолекулы и,следовательно, микроокружения хромофора (изменение рН, тепловая денатурация и др.) приводит к значительным различиям параметров флуоресценции. Поэтому собственная флуоресценция веществ широко используется для изучения их химических превращений, межмолекулярных взаимодействий, конформационных перестроек, переноса энергии и др.
Вопрос Миграция энергии и электронов в биологических структурах. Под миграцией энергии понимают безызлучательный перенос энергии или электронов между молекулами, находящимися в основном состоянии или между отдельными частями одной молекулы. Возможность переноса электронов обеспечивается наличием коллективизированных π-электронных облаков. Выделяют три механизма миграции энергии: 1. Индуктивно-резонансный. Происходит миграция энергии по синглетным уровням. Возбуждённым электроном донора генерируется переменное магнитное поле, которое взаимодействует с электроном акцептора. Если частота переменного поля совпадает с частотой перехода электрона донора на возбуждённый уровень, происходит перенос энергии. Такой механизм имеет место при небольших энергиях взаимодействия, но перенос может происходить на большие расстояния. Обменно-резонансный. В этом случае происходит обмен электронами триплетных уровней. Для осуществления такого обмена необходимо частичное перекрывание электронных облаков донора и акцептора. Экситонный механизм. Этот механизм имеет место при больших энергиях взаимодействия. При этом возбуждение передаётся с донора на акцептор раньше релаксации самого донора. При этом может произойти передача сразу на несколько молекул-доноров. Эта область передачи возбуждения называется экситон. Перенос электрона между взаимодействующими группами происходит по туннельному механизму и сопряжён с изменением конформации молекул.
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1163; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.013 с.) |



 (II.31)
(II.31)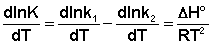 (II.32)
(II.32) (II.33)
(II.33) (II.34)
(II.34) (II.35)
(II.35) (II.36)
(II.36) (II.37)
(II.37)
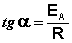 (II.38)
(II.38) (II.39)
(II.39)



