
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Контрольні завдання. Грубодисперсні системи. Питома електропровідність. Фактор еквівалентності. Співвідношення між одиницямиСодержание книги
Поиск на нашем сайте
КОНТРОЛЬНІ ЗАВДАННЯ 1. Що таке високомолекулярні речовини? 2. Дати класифікацію високомолекулярних сполук. 3. Набрякання високомолекулярних сполук. Що таке ступінь набрякання? 4. Написати математичний вираз ступеня набрякання. 5. Види набрякання високомолекулярних сполук. 6. Причини виникнення тиску набрякання? 7. Фактори стійкості розчинів високомолекулярних сполук. 8. Що називається порогом висолювання високомолекулярних сполук? 9. Що таке денатурація білків і від чого вона залежить? 10. Поняття про колоїдний захист, його роль. 11. В’язкість розчинів високомолекулярних сполук. Якими законами характеризується в’язкість? 12. Написати математичний вираз закону Пуазейля. 13. Що таке питома в’язкість? Написати молекулярний вираз питомої в’язкості. 14. Від яких факторів залежить питома в’язкість? 15. Класифікація поліелектролітів. 16. Що таке ізоелектрична точка білків? 17. Поняття про онкотичний тиск і його біологічне значення. 18. Що таке драглі? 19. Способи одержання драглів. 20. Які фактори впливають на драгління полімерів? 21. Як впливають катіони і аніони на процес драгління? 22. Що таке тиксотропія і від чого вона залежить? 23. Що таке набрякання полімеру і колоїду? Написати вираз ступеня набрякання. 24. Механізм набрякання. Тиск набрякання. 25. В чому полягає суть періодичності осадження в драглях? 26. Що називається процесом синерезису? Його вплив на живий організм. 27.Яке значення для біологічних процесів має набрякання і старіння драглів?
Розділ ІХ ГРУБОДИСПЕРСНІ СИСТЕМИ Системи, в яких величина частинок дисперсної фази більша за 100 нм, називають грубодисперсними. До них належать суспензії, емульсії, пасти, порошки, піни, аерозолі. За окремими властивостями грубодисперсні системи наближаються до колоїдних: вони гетерогенні і мають дуже чітку поверхню поділу фаз. Значна питома поверхня спричинює, згідно з другим законом термодинаміки, агрегативну нестійкість цих систем, яку можна підвищити лише вносячи стабілізатори, що добре сорбуються на частинках дисперсної фази. У грубодисперсних системах, через відсутність броунівського руху, спостерігається кінетична нестійкість, осідання частинок під впливом сил ваги або спливання (якщо густина речовини частинок менша від густини середовища). Грубодисперсні системи досить поширені. Це їжа чи корм, окремі лікарські препарати, молоко, будівельні розчини, лаки, фарби, кераміка і т. п.
§1. Аерозолі. Аерозолями називають дисперсні системи з газоподібним дисперсним середовищем і дисперсною фазою у вигляді твердих або рідких частинок. Аерозолі утворюються при вибухах, подрібненням, розпиленням речовин і при процесах конденсації пересиченої водяної пари і органічних рідин за рахунок охолодження систем. За агрегатним станом частинок аерозолі класифікуються на тумани (рідина/газ) – дисперсна фаза складається із крапельок рідини; дим (тверда фаза/газ) – аерозолі з твердими частинками конденсаційного походження; пили (тверда фаза/газ) – тверді частинки утворені шляхом диспергування. Можливі системи змішаного типу, коли на твердих частинках конденсується волога. Так виникає “смог” – туман, утворений на частинках диму. Для аерозолів характерна крайня агрегативна нестійкість. Їх існування пов’язане з високою дисперсністю і малою концентрацією. Це означає, що стійкість аерозолів є лише кінетичною, термодинамічні ж фактори стійкості відсутні. Порушення стійкості аерозолів зумовлюють наступні процеси: 1) седиментація частинок, яка, через малу в’язкість середовища, відбувається швидше, ніж у гідрозолях; 2) інтенсивна коагуляція частинок внаслідок високого рівня броунівського руху, прискоренню коагуляції сприяє підвищення вологості середовища; 3) вплив температури, особливо на стійкість туманів. До особливостей фізичних властивостей аерозолів належать явища термофорезу, фотофорезу і термопреципітації. Явища термофорезу і термопреципітації спостерігаються в аерозолях під впливом градієнта температури. Термофорезом називають рух частинок аерозоля у напрямку нижчих температур. Причина полягає в тому, що більш нагрітий бік частинок молекули газу “бомбардують” з більшою швидкістю, ніж менш нагрітий. Частинки одержують імпульс для руху до нижчої температури. Термопреципітація – це осадження частинок аерозоля на холодних поверхнях за рахунок втрати ними кінетичної енергії. Фотофорез – процес переміщення частинок аерозоля при односторонньому освітленні. Напрям руху залежить від розмірів, форм, прозорості частинок. Роль аерозолів у природі та побуті надзвичайно велика. Це вплив хмар, туманів на клімат, перенесення вітром насіння і пилку рослин. Аерозолі знайшли використання у медицині, ветеринарній медицині. Стерильні аерозолі використовують для стерилізації операційного поля, ран, опіків; інгаляційні аерозолі, які містять антибіотики та інші лікарські речовини, застосовуються для лікування дихальних шляхів.
§2. Емульсії. Це вільнодисперсні системи, у яких дисперсне середовище і дисперсна фаза є рідини. Утворюючі емульсію рідини не змішуються. Рідина дисперсної фази є у вигляді крапель розміром від 10–7 м до видимих неозброєним оком. Рідини, що утворюють емульсію, повинні відрізнятися полярністю. Однією з рідин найчастіше буває вода, другою – будь-яка неполярна рідина, яку умовно називають “олива”. Залежно від полярності фаз розрізняють два типи емульсій: 1) емульсії першого типу складаються із полярного дисперсного середовища (води) і неполярної дисперсної фази (оливи); ці емульсії називають прямими, або емульсіями оливи у воді і скорочено позначають О/В; 2) емульсії другого типу мають неполярне дисперсне середовище (олива) і полярну дисперсну фазу (вода); ці емульсії інакше називають оборотними, або емульсіями води у оливі і скорочено позначають В/О. За концентрацією дисперсної фази емульсії поділяють на три групи: 1) розведені – з концентрацією дисперсної фази не більше 0,1% від об’єму емульсії; 2) концентровані – з концентрацією дисперсної фази від 0,1 до 74% об’єму; 3) висококонцентровані – з вмістом дисперсної фази, вищим від 74% об’єму емульсії. Від концентрації дисперсної фази залежать усі основні властивості емульсій, і в першу чергу стійкість.
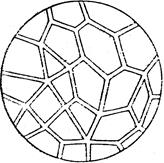
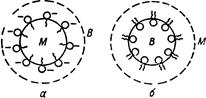
Рис.9.1.Висококонцент-рована емульсія в/О. У розведених і концентрованих емульсіях краплі кулястої форми. У висококонцентрованих емульсіях часточки деформуються і набувають вигляду багатогранників (рис. 9.1), між стінками яких знаходяться тонкі шари рідини дисперсного середовища. Стійкість емульсій. Емульгатори і механізм їх дії. Оскільки емульсії є гетерогенними системами з великою питомою поверхнею поділу, вони термодинамічно нестійкі. В емульсіях довільно відбувається процес злиття крапель дисперсної фази – коалесценція. При цьому утворюється агрегати крапель, які не зливаються, а зберігають свою індивідуальність і за певних умов знову розходяться. Такий процес оборотної коагуляції називають флокуляцією. Седиментаційна стійкість емульсій визначається їх дисперсністю, різницею густини рідин, в’язкістю середовища. Високодисперсні емульсії седиментаційно стійкіші, ніж грубодисперсні. Стійкість емульсій проти коалесценції тісно пов’язана з концентрацією дисперсної фази, а точніше – з числом крапель в одиниці об’єму емульсії і частотою їх зіткнень. Розведені емульсії можуть існувати довше. Концентровані вимагають застосування емульгаторів. Емульгатори – це розчинні поверхнево-активні і високомолекулярні або нерозчинні порошкоподібні речовини, які підвищують стійкість емульсій. Механізм стабілізуючої дії емульгаторів різний, але є окремі закономірності, які характеризуються правилом Банкрофта: гідрофільні емульгатори стабілізують прямі емульсії типу О/В; гідрофобні емульгатори, які краще розчинні в маслі, ніж у воді стабілізують зворотні емульсії типу в/О. Таким чином, згідно з правилом Банкрофта, молекули або частинки емульгатора повинні розташовуватися переважно з боку дисперсного середовища, тобто головним чином на зовнішній поверхні крапель емульсії. Ліофільні порошки (крейда, гіпс, глина) стабілізують прямі емульсії О/в, ліофобні порошки (графіт, сажа, каніфоль) є стабілізаторами зворотних емульсій в/О. Ефективність будь-якого стабілізатора оцінюють за двома основними показниками: 1) за стійкістю емульсії, стабілізованої даним емульгатором; 2) за максимальною кількістю емульсії, яка може бути стабілізована певною порцією емульгатора. Найбільшу емульгуючу дію мають низькомолекулярні поверхнево-активні речовини, молекули яких складаються з сильної полярної групи, найчастіше йоногенної, та вуглеводневого радикала з 12-18 вуглецевих атомів. Наприклад, мила – солі жирних кислот. Мила лужних металів розчинні у воді й стабілізують прямі емульсії О/в, мила лужноземельних та інших багатовалентних металів є стабілізаторами зворотних емульсій в/О. Молекули лужного мила, адсорбуючись на краплинах оливи, утворюють на їх зовнішній поверхні відносно товстий адсорбційно-сольватний шар, який перешкоджає зіткненню та злиттю краплинок оливи. При цьому на поверхні краплинок знаходяться полярні гідрофільні групи -СООNа, які йонізуються у воді і надають краплинам оливи негативного заряду. Однойменний заряд усіх крапель, у свою чергу, сприяє збільшенню стійкості емульсії (рис. 9.2 а).
Рис. 9.2. Схема стабілізації емульсії О/в лужним милом (а) і емульсії в/О лужноземе-льним милом (б). Крім того, мила знижують міжфазовий поверхневий натяг, полегшуючи процес емульгування. Лужноземельні мила, розчиняючись у оливі утворюють адсорбційно-сольваторний шар вже на зовнішній поверхні крапель води, захищаючи їх від коалесценції (рис. 9.2 б). Методи емульгування і деемульгування. Емульсії можна одержати методами конденсації і диспергування. Найбільше практичне значення мають методи диспергування – механічне диспергування двох рідин у присутності емульгатора шляхом струшування, перемішування, вібраційної дії. Емульгування проводять у спеціальних апаратах-емульгаторах і роторно-пульсаційних пристроях. При коливаннях високої частоти замість емульгування може пройти деемульгування – руйнування емульсії. До руйнування емульсій ведуть три процеси: 1) коалесценція при недостатній агрегативній стійкості емульсій – необоротний процес; 2) коагуляція або флокуляція – оборотний процес; 3) седиментація – спливання або осідання крапель дисперсної фази з утворенням шару, який шляхом перемішування можна знову розподілити по всьому об’єму. Для приготування високодисперсних емульсій застосовують метод гомогенізації, або вторинне зменшення розмірів краплин емульсії. Гомогенізацію здійснюють, протискаючи вихідну емульсію крізь невеликі отвори під великим тиском. Апарати, в яких здійснюється ця операція, називають гомогенізаторами. Одержання емульсій методом конденсації менш поширене. Іноді емульсію оливи у воді одержують при його пропусканні у вигляді пари крізь воду. Охолодження призводить до утворення емульсій. Розрізняють так зване довільне емульгування. Воно полягає у тому, що емульсія двох рідин утворюється без зовнішнього перемішування. Довільне емульгування відбувається, коли міжфазовий поверхневий натяг на межі вода-масло знижений до дуже малої величини шляхом введення емульгатора. Так, жири, що потрапляють до організму, емульгуються в кишечнику солями жовчних кислот і у вигляді високодисперсної емульсії О/в всмоктуються через його стінку. Жовчні кислоти, зменшуючи поверхневий натяг до 1·10–3 нм, сприяють довільному диспергуванню. Емульсії знаходять найрізноманітніше застосування в галузях науки і виробництва. Вони мають практичне значення у будівництві, текстильній, харчовій, хімічній промисловостях, їх широко використовують у медицині, фармації, парфюмерному виробництві. До емульсій належать молоко, вершки, майонези, маргарини, яєчний жовток. У тваринному й людському організмах ліпіди переносяться кров’ю у вигляді емульсій і комплексів з білками. Багато лікарських речовин застосовують у вигляді емульсій О/в для внутрішнього вживання і емульсій в/О – як зовнішні засоби.
§3. Суспензії. Це грубодисперсні системи з рідким дисперсним середовищем і твердою дисперсною фазою з розміром частинок в діапазоні 10–6-10–4 м. Суспензії з найбільш грубодисперсними частинками (10–4 м.) називають зависями. Способи одержання і стабілізації суспензій за багатьма параметрами схожі з такими для колоїдних розчинів – золів. Різка відмінність суспензії від колоїдів проявляється в молекулярно-кінетичних і оптичних властивостях. Явища дифузії і осмосу не властиві суспензіям, проходження світла через суспензії не викликає опалесценсії, а проявляється у вигляді каламутності, оскільки світлові промені заломлюються і відбиваються частинками суспензії, а не розсіюються. Седиментаційна стійкість суспензій звичайно дуже мала внаслідок великих розмірів частинок. Агрегативна стійкість суспензій є результатом дії сил різної природи, які запобігають злипанню частинок: 1) відштовхування, обумовленого подвійним електричним шаром; 2) “ентропійного” відштовхування, яке проявляється тоді, коли частинки зближуються одна до одної на таку відстань, при якій адсорбовані на них молекули поверхнево-активних речовин починають зачіпати одна одну вуглеводневими ланцюгами; 3) відштовхування, обумовленого сольватними оболонками. Цей вид відштовхування виникає між частинками, якщо на їх поверхні адсорбуються молекули розчинника, утворюючи сольватний шар товщиною в один-два молекулярних діаметри. Крім сильно вираженої седиментації, для суспензій характерні такі процеси, як флотація, фільтрація і кольматація. Суть флотації полягає у тому, що частинки твердої фази, сорбуючи гідрофобні речовини, спливають. На тверді частинки діють флотаційні сили з боку рідини. Якщо частинки не змочуються рідиною, дія флотаційних сил направлена вверх, проти сил тяжіння. Рідина старається виштовхувати частинку на поверхню. Фільтрація через пористі мембрани призводить до розділення суспензій на тверду і рідку фази. Кольматацією називають природне або штучне вливання глинистих або мулистих частинок у пори ґрунту, що зменшує фільтрацію води через стінки каналів, водойм тощо. Суспензії та зависі мають велике практичне значення. Глинисті, цементні, вапняні “розчини”, олійні фарби, кольорові лаки застосовуються у будівництві. У сільському господарстві багато фунгіцидів та інсектицидів використовують у вигляді суспензій та паст. Лікарські препарати (синтоміцин, фенілсаліцилат, оксид свинцю та ін.) вживають у медичній практиці у вигляді суспензій, зависів.
§4. Пасти. Пасти – це суспензії, у яких концентрація дисперсної фази сягає вище 25%. Це є пластичні або пружнов’язкі тіксотропні системи. Вони здатні зберігати форму, структурну в’язкість і можуть тверднути. Розрізняють гомо- і гетерогенні пасти. Гомогенні пасти – однокомпонентні системи, гетерогенні складаються із декількох компонентів дисперсної фази. Пасти одержують диспергуванням твердих речовин у рідинах, які добре їх змочують. Для стабілізації вносять поверхнево-активні речовини. Іноді пасти готують простим змішуванням порошку дисперсної фази з рідиною дисперсного середовища. Залежно від основи розрізняють жирні і нежирні пасти. У жирних пастах основою є жири або жироподібні речовини та високомолекулярні вуглеводні (наприклад, вазелін). Дисперсним середовищем у нежирних пастах найчастіше є гліцерол, гідрофільні глини. Використовуються пасти як для лікувальних і профілактичних цілей (борно-цинкова, йодоформова, зубні пасти, косметичні креми), так і в побуті (пастоподібні лакофорбні матеріали, замазки, полірувальні пасти, шпаклівки та ін.).
§5. Порошки. Цілий ряд речовин та матеріалів, які використовуються у промисловості, сільському господарстві, медицині, ветеринарній практиці, виготовляють у вигляді порошків: окремі будівельні матеріали (цемент, крейда, вапно), сухі фарби, мінеральні добрива, отрутохімікати, різні лікарські препарати, продовольчі товари (крохмаль, борошно) тощо. Дисперсна фаза порошків представлена твердими речовинами, а дисперсне середовище – газами. Розмір частинок різних порошків коливається в широких межах. Так, пшеничне борошно одного й того самого гатунку може містити в собі частинки розміром від 5·10–3 до 6·10–2 см. Залежно від розмірів частинок порошкам дають різну назву: при діаметрі частинок 20·10–3-10–5 м – пісок; 2·10–5-10–6 м – пил; менше 2·10–6 м – пудра. Газоподібний характер дисперсного середовища і висока концентрація твердих частинок надають порошкам властивостей сипучих тіл. З іншого боку, оскільки між частинками порошку площа контактів мала, в системі є канали і пустоти. В цілому порошки мають капілярну структуру. Як і колоїдно-дисперсні системи, порошки добувають двома методами: методом концентрації і диспергуванням. Метод концентрації ґрунтується на добуванні порошків осадженням з розчинів внаслідок коагуляції золів колоїдів або внаслідок хімічної реакції між електролітами. Наприклад, осаджену крейду (зубний порошок) добувають за реакцією: Na2CO3+CaCl2 = CaCO3↓+2NaCl. Окремі високодисперсні порошки дістають, спалюючи (окиснюючи) метали. Так, оксид цинку (цинкове білило) добувають, окиснюючи випари цинку повітрям при 300ºС. Різні види сажі, які використовуються у виробництві гуми, пластмас, друкарської фарби, добувають, спалюючи газоподібні або рідкі вуглеводні при недостатній концентрації кисню. Метод диспергування ґрунтується на подрібненні вихідної сировини на різних млинах і наступному поділі її на фракції за розміром частинок. §6. Піни. Це висококонцентровані гетерогенні системи, в яких дисперсна фаза складається із бульбашок газу, а дисперсне середовище (рідке або тверде) утворює тоненькі плівки між бульбашками газу. Така структура пін зближує їх з висококонцентрованими емульсіями. Однак, незважаючи на подібність структури, стійкість пін значно нижча, ніж емульсій. Як піноутворювачі використовують різні поверхнево-активні речовини ( в тому числі мила, жирні кислоти, спирти та ін.). Піноутворювачі поділяють на два роди: 1) першого (нижчі спирти, кислоти), які знаходяться в об’ємі розчину і в адсорбційному шарі в молекулярному стані. Піни, що містять ці поверхнево-активні речовини, швидко розпадаються; 2) другого – мила, міцелярні розчини поверхнево-активних речовин. Піни з цими поверхнево-активними речовинами мають високу стійкість, оскільки на поверхнях поділу утворюються різні драглеподібні плівки. Стабільність пін забезпечують структурно-механічні властивості адсорбційно-сольватних шарів і розклинюючий тиск. Піни характеризуються дисперсністю, стійкістю і кратністю. Дисперсність пін визначають методом мікрофотографування з наступним підрахуванням числа бульбашок різних фракцій. Стабільність пін визначають за часом “життя” вільної плівки чи бульбашки, а також за часом руйнування стовпа піни. Кратність піни β визначають як відношення об’єму піни Vn до об’єму розчину поверхнево-активних речовин (Vр), що був використаний на її утворення:
Практичне значення процесів піноутворення досить велике. Їх використовують у флотації, при гасінні пожеж, в очищенні поверхонь, в харчовій, косметичній і фармакологічній промисловостях. Піноподібні аерозолі використовуються для зупинки кровотечі. Мають широке застосування тверді піни: пінопласти, природна тверда піна – пемза.
КОНТРОЛЬНІ ЗАВДАННЯ 1. Що таке грубодисперсні системи? 2. Які дисперсні системи називаються аерозолями? 3. Класифікація аерозолів за агрегативним станом. 4. Які процеси зумовлюють порушення стійкості аерозолів? 5. Що таке термофорез, фотофорез і термопреципітація? 6. Значення аерозолів для біологічного світу. 7. Що таке емульсії? 8. Класифікація емульсій за полярністю фаз. 9. Класифікація емульсій за концентрацією дисперсної фази. 10. Поняття про коалесценцію і флокуляцію. 11. Дати характеристику емульгаторам. Механізм дії. 12. Які процеси зумовлюють руйнування емульсій? 13. Методи одержання емульсій. 14. Біологічне значення емульсій. 15. Що таке суспензії? Поняття про зависі. 16. Види стійкості суспензій? 17. Що таке агрегативна стійкість суспензій? 18. Поняття про флотацію, фільтрацію і кольматацію суспензій. 19. Характеристика седиментаційних властивостей суспензій. 20. Що таке пасти? Їх класифікація і використання. 21. Що таке порошки? Їх одержання і застосування. 22. Поняття про піни. Класифікація піноутворювачів. 23. Основні фізико-хімічні властивості пін. 24. Практичне значення пін.
ЛІТЕРАТУРА 1. Ахметов Н.С. Общая и неорганическая химия. Изд. 2-е. – М.: Высшая школа, 1987. – С.10-93. 2. Воюцкий С.С. Курс коллоидной химии. – М.: Химия, 1975. – 512 с. 3. Галинкер И.С., Медведев П.И. Физическая и коллоидная химия. – М.: Высшая школа, 1972. 4. Глінка М.Л. Загальна хімія. – К.: Вища школа, 1976. – 603 с. 5. Грин Д., Гольбергер Р. Молекулярные аспекты жизни. – М.: Мир, 1968. – 393 с. 6. Даниэльс Ф., Ольберти Р. Физическая химия. – М.: Мир, 1978. – 638 с. 7. Евстратова К.И., Купина Н.А., Малахова Е.Е. Физическая и коллоидная химия. – М.: Высшая школа, 1990. – 477 с. 8. Кемпбел Дж. Современная общая химия. В 3-х томах. – М.: Мир, 1975. – т.1. – С. 300-315, т.2. – 230-264, т.3. – 52-96. 9. Клотц И. Энергетика биохимических реакций. – М.: Мир, 1970. – 109 с. 10. Кононский А.И. Физическая и колоидная химия. – К.: Высшая школа, 1986. – 301 с. 11. Кучеренко Н., Войцицкий В. Биоэнергетика. – К.: Высшая школа, 1982. – 260 с. 12. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М.: Высшая школа, 1989. 13. Ленинджер А. Биохимия. – М.: Мир, 1974. 14. Ліпатников В.Є., Казаков К.М. Фізична і колоїдна хімія. – К.: Вища школа, 1983. – 194 с. 15. Миттел К. Мицеллобразование, солюбилизация и микроэмульсии. – М.: Мир, 1980. – 598 с. 16. Мороз А.С., Ковальова А.Г. Фізична і колоїдна хімія. – Львів: Світ, 1994. – 271 с. 17. Николаев Л.А. Основы физической химии биологических процессов. – М.: Высшая школа, 1976. – 261 с. 18. Оганесян Э.Т. Неорганическая химия. – М.: Высшая школа, 1984. – 378 с. 19. Полинг Л. Общая химия. – М.: Мир, 1974. – 821 с. 20. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. – М.: Высшая школа, 1975. – 255 с. 21. Садовничая Л.П. Хухренский В.Г., Циганенко А.Я. Биофизическая химия. – К.: Высшая школа, 1986. 22. Сент-Дьердьи А. Биоэнергетика. Современные проблемы физики. – М.: Мир, 1960. – 151 с. 23. Уильямс В., Уильямс С. Физическая химия для биологов. – М.: Мир, 1976. 608 с. 24. Филипов Ю.В., Попович М.П. Физическая химия. – М.: Моск. ун-т, 1980. 25. Хмельницкий Р.А. Физическая и коллоидная химия. – М.: Высшая школа, 1988. 26. Чанг Р. Физическая химия с приложением к биологическим системам. – М.: Мир, 1980. – 662 с. 27. Стрельцов О.А., Мельничук Д.О., Снітинський В.В. та ін. Фізична і колоїдна хімія. – Львів: Ліга-Прес, 2002. – 456 c.
Додаток 1. ОСНОВНІ ФІЗИЧНІ СТАЛІ Атомна одиниця маси Нормальне прискорення вільного падіння Об’єм одного моля газу за нормальних умов Стала Планка Універсальна газова стала Стала Авогадро Число Фарадея 1 а.о.м. = 1,66·10–27 кг g = 9,81 м/с2 V0 = 22,4 м3/кмоль h = 6,63·10–34 Дж·с R = 8,31·103 Дж/кмоль·K NA = 6,02·1023 кмоль–1 F = 9,65·107 Кл/кг-екв
Додаток 2. ОСНОВНІ ПОЗНАЧЕННЯ Грецькі літери Назва літер Величини, які позначає та чи інша літера α Альфа Ступінь дисоціації, тип структури білка, ступінь гідролізу β Бета Тип структури білка γ Гамма Коефіцієнт активності Δ Дельта Депресія, зміщення, приріст ε Епсілон Діелектрична проникність середовища ζ Зета Дзета-потенціал η Ета В’язкість рідини; ступінь перетворення χ Каппа Питома електропровідність λ Лямбда Еквівалентна електропровідність, довжина світлової хвилі μ Мі Йонна сила; дипольний момент ν Ні Нількість речовини ρ Ро Питомий опір, густина π Пі Осмотичний тиск, відношення довжини кола до діаметра Σ Сигма, велика л-ра Символ суми σ Сигма Поверхневий натяг τ Тау Час, період напівперетворення υ Іпсилон Швидкість хімічної реакції φ Фі Робота виходу електрона, об’єм частки ω Омега Масова частка речовини в розчині або компонентів в суміші
Додаток 3. ОСНОВНІ ПОЗНАЧЕННЯ Літери Величини, які позначає та чи інша літера С(C) Концентрація Cm Моляльна концентрація CM Молярна концентрація e- Електрон; заряд електрона E0 Стандартний електронний потенціал E Енергія, електрорушійна сила Ea Енергія активації fекв Фактор еквівалентності I Сила струму, потенціал йонізації K Константа швидкості реакції; коефіцієнт пропорційності M Молярна маса Mекв Молярна маса еквівалента N Мольна частка NA Стала Авогадро p Тиск газу, парціальний тиск pH Водневий показник (показник йонів гідрогену) R Газова стала T Абсолютна температура Q Теплота, тепловий ефект V Об’єм Vm Молярний об’єм газу z Заряд йона
Додаток 4. СПІВВІДНОШЕННЯ МІЖ ОДИНИЦЯМИ ФІЗИЧНИХ ВЕЛИЧИН Величина Одиниця виміру Довжина Метр 1 ангстрем (Ǻ) = 10–10 м = 10–8 см Маса Кілограм 1 г = 10–3 кг 1 моль = М·г (М – відносна молекулярна маса - молекулярна вага) Об’єм Кубічний метр 1л = 10–3 м3 = 103 см3 Сила Ньютон 1Н = 0,102 кгс = 105 дін Робота, енергія Джоуль 1 Дж = 107 ерг = 0,102 кгс·м Тиск Паскаль 1 Па = 10 дін/см2 = 1,02·10–5 кгс/см2 = 7,52·10–3 мм·рт·ст = 10–5 бар Теплота Джоуль 1Дж = 0,239 кал = 107 ерг = 2,39·10–4 ккал/кг Питома теплота топ-лення,пароутворення Джоуль на кілограм 1Дж/кг = 2,39·10–4 кал/г = 2,39·10–4 ккал/кг Теплоємність, ентропія Джоуль на Кельвін 1Дж/K = 2,39 кал/ºС = 2,39·10–4 ккал/ºС Питома теплоємність, питома ентропія Джоуль,кілограм-Кельвін 1Дж/(кгK) = 2,39·10–4 кал/(гºС) = 2,39·10–4 ккал/(кгºС)
Додаток 5. НАЗВИ ХІМІЧНИХ ЕЛЕМЕНТІВ, рекомендовані Національною Комісією України (НКУ) з хімічної термінології і номенклатури згідно з правилами IUPAC Хімічний символ Заряд ядра Назва елемента Рекомендована НКУ Загальновживана Ag Аргентум Срібло As Арсен Миш’як Au Аурум Золото Bi Бісмурт Вісмут C Карбон Вуглець CL Хлор Хлор Cu Купрум Мідь F Флюор Фтор Fe Ферум Залізо Ga Галій Галій Ge Германій Германій H Гідроген Водень Hg Меркурій Ртуть La Лантан Лантан Mg Магній Магній Mn Манган Марганець N Нітроген Азот Ni Нікол Нікель O Оксиген Кисень Pb Плюмбум Свинець Pt Платина Платина S Сульфур Сірка Sb Стибій Сурма Si Сицілій Кремній Sn Станум Олово Te Телур Телур Ti Титан Титан W Вольфрам Вольфрам
ПРЕДМЕТНИЙ ПОКАЖЧИК
Абсорбція 135 Агрегація 156 Адитивність 183 Адсорбенти 135 Адсорбтив 135 Адсорбція 135 -вибіркова 146 -йоннообмінна 148 -негативна 136 -обмінна 148 -позитивна 136 Аерозолі 153, 205 Активатори 127 Активні центри 129 Алкалоз 74 Амфійони (цвіттерйони) 62 Амфоліти 61 Анізотропія 32 Антифриз 53 Антогонізм електролітів 143, 183 Аутокаталіз 121 Ацидоз 74
Білки -висолювання 189 -денатурація 190 -ізоелектрична точка 195 Броунівський рух 163 Буферна дія 73 Буферна ємність 73
Випаровування 31 Високомолекулярні сполуки (ВМС) 185 -в’язкість 191 -висолювання 189 -властивості 187 -набрякання 187 -стійкість Висолювання 189 Вівідіаліз 159 Вода -дисоціація 65 -йонний добуток 65 Водневий зв’язок 39 Водневий показник 65, 66 В’язкість -питома 192 -приведена 193 -характеристична 193 -розчинів ВМС 191
Газ -ідеальний 23 -реальний 25 Гальванічний елемент 95 Гемоліз 47 Гетерогенність колоїдів 167 Гетерокоагуляція 183 Гідроксильний показник 65 Гранула 161
Деемульгування 208 Десорбція 135 Денатурація 190 Дипольний момент 39 Диспергування 156 Дисперсне середовище 35, 152 Дисперсна система 35 Дисперсна фаза 35 Дисперсність 167 Дифільні молекули 137 Дифузія 44, 45, 164 Діалектрична проникність 39 Діаліз 158 Драглі 199 Драгління 199 Дроблення 156
Ебуліометрія 53 Екзоосмос 49 Електродекантація 160 Електроди 92 -другого роду100 -індикаторний 104 -каломельні 103 -окиснювально-відновні 100 -першого роду 99 -скляні 104 -стандартний 98 -хлорсрібний 102 Електродіаліз 159 Електрокінетичні явища 171 Електролізер 107 Електроліти 55 Електролітична дисоціація 55 Електронна мікроскопія 170 Електроосмос 172 Електроосмотична швидкість Електропровідність 82 -гранична 85 -електронна 83 -йонна 83 -молярна 84 -питома 83, 84 Електрофорез 173 Електрохімія 82 Елемент Вестона 98 Елюція 135 Емульгатори 207 Емульсії 206 Ендоосмос 49 Енергія -активації 113 -вільна 28 -Гельмгольца 18 -Гіббса 18, 181 -внутрішня 7 -кристалічної решітки 33 Ентальпія 7 Ентропія 14, 15
Желатування Зависі 209 Закон -Авогадро 23 -Бойля-Маріотта 23 -Вант-Гоффа 44 -Гей-Люссака 23 -Генрі 42 -Гесса 9 -Дебая 78 -діючих мас 110 -ідеальних газів 22 -ідеальних розчинів 44 -Кольрауша 86 -Ламберта-Бера 68 -Максвелла-Больцмана 113 -Ньютона 191 -Пуазейля 192 -Рауля 44, 50, 51 -Релея 168 -розведення Оствальда 58 -термодинаміки другий 14 -термодинаміки перший 7, 8 -термодинаміки третій 16 -Шарля 24 Золі 153
Ізоелектрична точка білків 195 Ізоелектричний стан 171, 195 Ізоосмія 49 Ізотерма -Ленгмюра 145 -Брунауера, Еммета, Теллера (БЕТ) 145 Ізотропність 32 Інгібітори 123, 127 Індикатор 67 Інтервал переходу забарвлення 67
Йонна рівновага 55 Йонна сила розчину 63 Йонний добуток води 65 Йонофорез 159
Каталіз 120 -гетерогенний 123 -гомогенний -мікрогетерогенний (ферментативний) 124 Каталізатор 121 Кесоннова хвороба 139 Кипіння 32 Кислотність -активна 67 -загальна 67 -льюїсівська 63 -потенціальна 67 Коагулююча здатність Коагуляція 163, 176 -значення 184 -концентраційна 182 -нейтралізаційна 183 Коалесценція 207 Коефіцієнт -активності 63, 64 -Вант-Гоффа 47, 53 -дифузії 45, 164 -електропровідності 89 Колоїди -ліофільні 155 -ліофобні 155 Колоїдна частинка (міцела) 160 Колоїдний захист 190 Компенсаційний діаліз 159 Комплекси -Арреніуса 121 -Вант-Гоффа 121 Кондуктометричне титрування 89 Константа -дисоціації 56 -йонізації 89 -класична 19, 56 -Міхаеліса-Ментена 131 -седиментації (Сведберга) -термодинамічна 63, 19 -хімічної рівноваги 19, 20, 118 Контракція 188 Конус Тіндаля 168 Концентраційний елемент Концентрація 36 -водневих йонів 66 -масова 36 -моляльна 37 -молярна 36 Коферменти 130 Критична температура 26 Критичний об’єм 26 Критичний стан 26 Критичний тиск 26 Кріометрія 53
Ламінарний потік 191 Ліотропний ряд (ряд Гофмейстера) 189
Мембранна рівновага Доннана 196 Метод (и) -Бредінга 158 -гідролізу 158 -деемульгування 208 -дисперсні 156 -драгління 199 -ебуліоскопічний 47 -електрометричний 68 -емульгування 208 -колориметричний 67 -конденсаційні 157, 158 -кріоскопічний 47 -набрякання 199 -осмометричний 47 -плазмолітичний 47 -подвійного обміну 157 -сталагмометричний 29 Молекули -полярні 27, 41 -неполярні 27 Молярна маса еквівалента 38
Набрякання 201 Натяг поверхневий 28 Нефелометрія 169 Онкотичний тиск 164, 198 Осмометр 47 Осмос 44, 46 -екзоосмос 59 -ендоосмос 59 -значення 59 Осмотичний тиск 44, 46, 48-50 Основність льюїсівська 76
Пасти 210 Питома поверхня 152 Питома поверхня каталізатора 126 Піна 212 Плинність 22 Поверхневий натяг 28 Поверхнево-активні речовини 28, 136 Поверхнево-неактивні речовини 29, 136 Поліелектроліти 194 Полярографія 107 Поріг висолювання 189 Поріг коагуляції 181 Порядок реакції 115 Порошки 211 Потенціал -дифузний 104 -електродний 92, 93 -електрокінетичний 171, 172 -електролітичний 171 -ізобарно-ізотермічний 17 -ізохорно-ізотермічний 17 -мембранний 104 -нормальний 94 -перебігу 175 -півхвилі 108 -редокс 101 -седиментації 175 -спокою 106 -хімічний 19 Правило -Банкрофта 207 -Вант-Гоффа 112 -Пєскова-Фаянса 161 -Траубе-Дюкло 138 -Шульце-Гарді 181 Провідник -першого ряду 83 -другого ряду 83 Протийони 161 Протоліти 60 Процес -ендотермічний 41 -ізобарний 10 -ізотермічний 9 -ізохорний 10 -необоротний 6 -оборотний 6
Реакції -аутокаталітичні 121 -бімолекулярні 115 -другого порядку 116 -ланцюгові 118 -мономолекулярні 114 -нульового порядку 116 -оборотні 117 -паралельні 116 -першого порядку 116 -послідовні 117 -проміжні 110 -прямі 19 -спряжені 118 -тримолекулярні 115 Резервна лужність крові 76 Реографія 92 Речовини -поверхнево-активні 28, 136 -поверхнево-неактивні 29, 136 Рівновага динамічна Доннана 196 Рівняння -адсорбції Ленгмюра 145 -Анштайна 164 -Ван-дер-Ваальса 25 -Гельмгольца-Смолуховського 172 -Гендерсона-Гассельбаха 70 -Гіббса 136 -Доннана 197 -Клапейрона-Менделєєва 25, 46 -Марка-Куна-Хаувінка -Міхаеліса-Ментена 131, 132 -Нернста 92 -Релея 169 -стану ідеальних газів 23, 24 -Фрейндліха 189 -Штаудінгера 193 Робота 8 Розпушування 201 Розчини -буферні 69 -високомолекулярних сполук (ВМС) 35, 185 -газуваті (пароподібні) 35 -гіпертонічні 47 -гіпотонічні 47 -електролітів 55 -ідеальні 44 -ізотонічні(фізіологічні) 48 -істинні 35 -йонні 35 -колоїдні 35 -молекулярні 35 -неідеальні (реальні) 54 -рідкі 35 -тверді 35 Розчинник 34 Розчинність -газів 42 -рідин 43
Світлорозсіювання 167 Седиментаційна стійкість 166 Седиментація 165 Сили -Ван-дер-Ваальса 25 -електрорушійні 96 Синергізм 143, 183 Синерезис 203 Система(и) -амоніачна 70 -білкові 70 -буферні 69 -відкрита 6 -гетерогенна 6, 153 -гідрокарбонатна 70 -гомогенна 6 -грубодисперсні 153, 204 -дисперсні 152 -закрита 6 -ізольована 5 -йонодисперсні 153 -колоїднодисперсні 153 -молекулярнодисперсні 153 -спряжена 59 -фосфатна 70 Сольватація 41, 81 Стала -Авогадро 215 -Больцмана 16 -ебуліоскопічна 51 -кріоскопічна 51 -Планка 215 -універсальна газова 24 -Фарадея 215 Сталагмометр 29 Стан -газуватий 22 -критичний 26 -рівноважний 31 -рідкий 27 -твердий 32 -хімічної рівноваги 117 Старіння драглів 203 Ступінь -дисперсності 152 -електролітичної дисоціації 57 Сублімація 34 Суспензії 209
Температура -кипіння 32 -критична 26 -топлення 34 Теорії -Айнштайна 163 -Арреніуса 55 -асорбційна 128, 177 -асоціацій 80 -Бренстеда 63 -Дебая-Хюккеля 77 -ДЛФО 178 -електронна 128 -коагуляції колоїдів 177 -Льюїса 63 -Міхаеліса-Ментена 130 -мультиплетна 129 -Мюллера 178 -Нікольського 104 -проміжних сполук 128 -протонна кислот і основ 59 -Релея 168 -сольватацій (гідратацій) 80, 81 -стійкості колоїдів 177 Тепловий ефект реакції 10, 11, 13 Теплоємність 9, 13 Теплота -згоряння 12 -змочування 142 -стандартна 12 -розчинення 42 Термодинаміка 6 Термопреципітація 206 Термофорез 206 Термохімія 9 Тиск -критичний 26 -набрякання 189, 201 -насиченої пари 31 -онкотичний 198 -осмотичний 44, 46 Тиксотропія 201 Туман 246 Тургор 49
Ультрамікроскопія 170 Ультрафільтрація 159 Ультрацентрифугування 166
Фактор еквівалентності 38 Ферментативний каталіз 124 Ферменти (ензими) 112, 129 Фільтрація 210 Флокуляція 207 Флотація 210 Формула (цикл) Карно 14 Фотофорез 205
Хемосорбція 135 Хімічна кінетика 108 Хімічні взаємодії 80, 81 Хроматографія 149
Частка -масова 36 -молярна 36 -об’ємна 36 Частокол Легмюра Число -Авогадро 23 -залізне 190 -золоте 190 -коефіцієнтне сольватації 81 -срібне 190 -Фарадея 215
Явища електрокінетичні 171 ПЕРЕДМОВА ВСТУП ЧАСТИНА ПЕРША. ФІЗИЧНА ХІМІЯ Розділ І. Основні поняття ї закони термодинаміки.Термохімія § 1. Поняття про хімічну термодинаміку § 2. Внутрішня енергія системи. Робота. Теплота. Перший закон термодинаміки § 3. Теплові ефекти.Закон Гесса. Теплоємність § 4. Другий закон термодинаміки. Ентропія § 5. Третій закон термодинаміки. Термодинамічні і хімічні потенціали § 6. Термодинаміка хімічної рівноваги Контрольні завдання Розділ ІІ. Агрегатний стан речовини § 1. Загальна характеристика станів речовини § 2. Газоподібний стан речовини § 3. Рідкий стан речовини § 4. Твердий стан речовини Контрольні завдання Розділ ІІІ. Розчини § 1. Типи розчинів § 2. Способи вираження концентрації розчинів § 3. Вода § 4. Дипольний момент. Діелектрична проникність § 5. Механізм розчинення і термодинамічні умови утворення розчинів § 6. Ідеальні розчини. Закони ідеальних розчинів § 7. Неідеальні розчини. Хімічний потенціал компонента в ідеальному і реальному розчині § 8. Розчини електролітів. Йонна рівновага § 9. Термодинамічна константа дисоціації. Активність, коефіцієнти активності. Йонна сила розчину § 10. Дисоціація води. Йонний добуток води. Водневий і гідроксильний показники § 11. Буферні розчини: склад, механізм дії, згачення для живих організмів § 12. Особливості властивостей сильних електролітів § 13. Основні поняття електростатичної теорії сильних електролітів Дебая і Хюккеля. Розрахунок коефіцієнтів активності § 14. Основні поняття теорії асоціації і сольватації (гідратації) йонів Контрольні завдання Розділ ІV. Електрохімія § 1. Електропровідність. швидкість руху йонів § 2. Кондуктометричне визначення ступеня і константи йонізації слабкого електроліту § 3. Кондуктометричне титрування § 4. Значення електропровідності для біологічних систем § 5. Електродні потенціали Рівняння Нернста. Електрохімічні елементи та електрорушійні сили § 6. Стандартні електроди § 7. Класифікація електродів § 8. Індикаторні електроди § 9. Електрометричне визначення рН розчинів. Дифузний і мембранний потенціали і їх біологічне значення § 10. Полярографічний метод аналізу Контрольні завдання Розділ V. Хімічна кінетика і каталіз § 1. Основні поняття хімічної кінетики § 2. Залежність швидкості хімічної реакції від концентрації реагуючих речовин § 3. Залежність швидкості хімічної реакції від температури. Енергія активації хімічних реакцій § 4. Методи визначення швидкості хімічних реакцій. Кінетична класифікація хімічних реакцій § 5. Хімічні реакції у біологічних системах § 6. Каталіз. Види каталізу § 7. Основні властивості каталізаторів. Фактори, які впливають на каталіз § 8. Теорії каталізу § 9. Ферментативний каталіз Контрольні завдання ЧАСТИНА ДРУГА. КОЛОЇДНА ХІМІЯ Розділ VI. Адсорбція § 1. Адсорбція на поверхні рідин § 2. Адсорбція твердими тілами § 3. Адсорбція із розчинів § 4. Фізико-математичне визначення адсорбції § 5. Вибіркова адсорбція і її біологічне значення § 6. Обмінна адсорбція § 7. Хроматографія Контрольні завдання Розділ VII. Колоїднодисперсні системи § 1. Загальна характеристика дисперсних систем § 2. Методи одержання колоїдних розчинів § 3. Методи очищення колоїдних розчинів § 4. Будова колоїдних частинок § 5. Молекулярно-кінетичні властивості колоїдних систем § 6. Оптичні властивості колоїдних систем § 7. Електрокінетичні явища § 8. Стійкість і коагуляція колоїдних систем § 9. Коагуляція гідрофобних золів Контрольні завдання Розділ VIII. Розчини високомолекулярних сполук § 1. Класифікація і структура високомолекулярних сполук § 2. Властивості розчинів високомолекулярних сполук § 3. Поліелектроліти. Особливості розчинів білків § 4. Драглі Контрольні завдання Розділ IХ. Грубодисперсні системи § 1. Аерозолі § 2. Емульсії § 3. Суспензії § 4. Пасти § 5. Порошки § 6. Піни Контрольні завдання Література Додатки Предметний покажчик
НАВЧАЛЬНЕ ВИДАННЯ
Галяс Віктор Людвикович Колотницький Анатолій Гнатович
ФІЗИЧНА І КОЛОЇДНА ХІМІЯ
Редактор В.Л.Галяс, А.Г.Колотницький Коректор С.І.Ваврин Комп’ютерний набір О.М.Федець, С.Й.Кава Ілюстрації О.М.Федець
|
||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 8; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.213.60 (0.021 с.) |

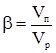 .
.


