Содержание книги
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рис. 3. 5. Залежність тиску насиченої пари від температури над чистим розчинником і над розчином.
KCl NH4Cl Етанол Метанол Гліцерол Вода 27,5 31,2 56,2 80,4 0,0034 0,5 6,4 25,5 0,6 3,4 9,0 27,3
§5. Механізм розчинення і термодинамічні умови утворення розчинів. Для живого світу особливу зацікавленість мають рідкі розчини, де розчинником виступає вода. До них належать біологічні рідини (плазма крові, лімфа, цитозоль, сеча та ін.), які є досить складними сумішами білків, ліпідів, вуглеводів, солей тощо. Фізико-хімічні закономірності взаємодії цих різноманітних за властивостями і розмірами частинок як між собою, так і оточуючими їх полярними молекулами води виявилися дуже важливими для життєдіяльності організмів. Рідкі розчини характеризуються досить складними й різноманітними співвідношеннями між складом і властивостями. Тому і єдиної кількісної теорії розчинів, яка б описувала їх поведінку та давала можливість визначити властивості розчинів за відомими властивостями компонентів у чистому стані, ще не створено. В ході розвитку науки були розроблені дві теорії: фізична і хімічна. Згідно фізичної теорії (С.Арреніус, В.Оствальд, Я.Вант-Гофф), процес розчинення розглядається як рівномірний розподіл частинок розчиненої речовини в усьому об’ємі розчинника. Розчинник приймають за індеферентне середовище. Хімічна теорія (Д.Менделєєв, І.Каблуков, М.Курнаков) розглядає розчини як системи, утворені частинками розчинника, розчинюваної речовини і нестійких хімічних сполук, які утворюються між ними за рахунок водневих зв’язків чи електростатичних сил взаємодії. Сучасна теорія розчинів об’єднує фізичну та хімічну точку зору і розглядає процес розчинення як взаємодію між частинками різної полярності. Полярність молекул виражається нерівномірністю розподілу електричних зарядів, тобто в одній частині молекули можуть переважати позитивні заряди, а в другій – негативні. Полярність молекули кількісно характеризують електричним моментом диполя (див. §3, 4). Утворення розчинів є довільним процесом, який відбувається зі збільшенням безладдя у системі, тобто з підвищенням ентропії (∆S>O) і зменшенням вільної енергії системи (енергії Гіббса) згідно з рівнянням ∆Н–Т∆S = ∆G<0 (3.11) З цього рівняння випливає, що якщо процес розчинення характеризується додатною зміною ентальпії (ендотермічний процес), то він обов’язково буде зв’язаний зі збільшенням ентропії. Тільки за цих умов різниця між ентальпійним та ентропійним фактром буде мати від’ємний знак (∆G<0).
Механізм розчинення твердих речовин в рідинах відбувається одночасно у три стадії: 1) орієнтація полярних молекул розчинника навколо частинок розчинюваної речовини, утворення йон-дипольного зв’язку; 2) розрив зв’язків у розчинюваній речовині; тобто руйнування кристалічної гратки; 3) сольватація (гідратація) йонів у розчині (див. §15, рис. 3.2). На першій і другій стадіях розчинення енергія затрачається, на третій-виділяється. Від співвідношення величини енергії вказаних процесів залежить загальна теплота розчинення. Враховуючи співвідношення величини енергії вказаних процесів, можна зробити висновок, що зміна ептальпії системи (∆Нр), яка проявляється у вигляді теплоти розчинення, за відсутністю хімічної взаємодії між розчинником і розчинюваною речовиною, буде додатньою (∆Нр>O). Якщо ж відбувається хімічна взаємодія компонентів розчину, то загальна зміна ентальпії може бути як додатньою (∆Нр>O), так і від’ємною (∆Нр<O), тобто теплота розчинення залежить від природи компонентів системи і концентрації розчину. Розчинність газів. Розчинність їх залежить не лише від природи газу і розчинника, а й від тиску та температури. Розчинність газу вища тоді, коли під час розчинення відбувається його хімічна взаємодія з розчинником. Наприклад, в одному об’ємі води розчиняється 748,7 об’ємів амоніаку, оскільки між молекулами NН3 і Н2О утворюється водневий зв’язок: NН3+Н2О ↔ Н3N...Н2О (або NН3·Н2О). Зате в одному об’ємі води розчиняється лише 0,0139 об’єму гелію. Розчинність газів значною мірою залежить від температури. З підвищенням температури розчинність газів зменшується. Так, при 0ºС в 100 мл води розчиняється 180 мл карбон (IV) оксиду, а при 20ºС – лише 89 мл. Під час розчинення газів майже завжди виділяється теплота, тому, згідно з принципом Ле Шательє, підвищення температури знижує їхню розчинність. Підвищення температури сприяє й збільшенню ентропії, оскільки ентропія речовини в газоподібному стані вища, ніж у рідкому. Тому з підвищенням температури розчинність буде зменшуватися.
Залежність розчинності газів від тиску визначає закон Генрі: розчинність газів у рідині при сталій температурі пропорційна тиску його над рідиною: Ср = kр, (3.12) де: Ср – концентрація газу в рідині; р – тиск газу; k – коефіцієнт пропорційності. Коефіцієнт k дорівнює кількості моль газу, яка розчиняється в 1000 г розчинника при тиску 101,325 кПа. Наприклад, у 100 г води при 20ºС і тиску 1 атм (101,325 кПа) розчиняється 0,169 г карбон (IV) оксиду. При підвищенні тиску удвічі кількість розчиненого газу також подвоюється і становить 0,338 г. Збільшення розчинності газів при підвищенні тиску широко використовується, зокрема для виробництва газованих напоїв. Якщо над розчином є суміш газів, то кожний з них розчиняється відповідно до його парціального тиску. Це має велике значення у фізіологічних процесах переносу кисню і карбон (IV) оксиду кров’ю. Гази, молекули яких полярні, краще розчиняються у полярних розчинниках. Деякі гази при розчиненні вступають у хімічну взаємодію з розчинником (наприклад СО2) або дисоціюють на йони (HCl), і це підвищує їх розчинність. У цих випадках закон Генрі не завжди може бути використаний. В зміненому вигляді його можна використати, наприклад, при вивченні розчинності газів, що взаємодіють з розчинником. Так, при розчиненні СО2 у воді кількість утворених молекул Н2СО3 залежить від константи рівноваги реакції: СО2+Н2О ⇄ Н2СО3. Встановлено, що присутність електролітів у розчині знижує розчинність газів. Розчинність газів у цьому випадку розраховують згідно з формулою: С = С0е–Кс, (3.13) де: С – розчинність газу; С0 – розчинність газу в чистому розчиннику; е – основа натурального логарифма; К – константа, яка залежить від природи газу, електроліту і температури; с – концентрація електроліту. У крові містяться електроліти, в т.ч.: білки, ліпіди та інші речовини; їх концентрація може змінюватися в певних межах, впливаючи таким чином на розчинність у крові О2 і СО2. Крім того, на зміну розчинності газів впливає зміна тиску, що може призвести до важких патологій організму. Різке зниження атмосферного тиску, наприклад, при дуже швидкому підйомі водолазів із значних глибин, при розгерметизуванні скафандрів призводить до “закипання” крові через виділення розчинених у ній газів; їх пухирці закупорюють маленькі судини мозку та інших органів. Розчинність рідин. При розчиненні рідини в рідині можливі три випадки: а) необмежена розчинність; б) обмежена розчинність; в) практична нерозчинність. Розчинність рідини в рідині залежить насамперед від їх природи. Найчастіше, чим ближчі за своєю хімічною природою змішувані речовини, тим вища розчинність: “подібне розчиняється в подібному”. Це означає, що полярні речовини краще розчинні у полярних розчинниках, а неполярні – в неполярних. З цієї причини вода (полярна речовина) – добрий розчинник для полярних рідин (етанол, ацетатна кислота), а бензен (неполярна рідина) – добрий розчинник для неполярних ліпідів. Обмежена розчинність спостерігається під час змішування рідин з різною полярністю, наприклад, диетиловий етер – вода. У цьому випадку кожна з рідин розчиняється в іншій до певної межі, внаслідок цього утворюється двошарова система. Так, якщо змішати анілін з водою, утворюється два шари: верхній – насичений розчин аніліну у воді, нижній – насичений розчин води в аніліні. У суміші аніліну і води при 20ºС вміст аніліну у водному шарі є близько 3,3%, а води в аніліновому – 5%. З підвищенням температури взаємна розчинність збільшується і при 168ºС (і вище) обидві рідини змішуються у будь-яких співвідношеннях, а межа між шарами зникає. Таку температуру, при якій спостерігаться необмежена розчинність рідин, називають критичною температурою розчинення.
До практично нерозчинних сумішей можуть бути віднесені вода і олива – як рідини з дуже відмінною природою (полярна вода – неполярна олива).
§6. Ідеальні розчини. Закони ідеальних розчинів. Ідеальними називають розчини, утворені компонентами у яких сили взаємодії між однорідними і різнорідними молекулами одинакові. Наприклад, у розчині, що складається із компонентів А і В, сили взаємодії між молекулами А-А, В-В і А-В рівні. В ідеальних розчинах властивості окремих компонентів не відрізняються від властивостей в чистому індивідуальному вигляді, тому природа ідеальних розчинів досить проста. Їх поводження точно описують закони Рауля і Вант-Гоффа, які називають законами ідеальних розчинів. Закон Рауля. При аналізі результатів вимірів тиску насиченої пари розчинів нелетких речовин Ф.Рауль (1848) виявив важливу закономірність – парціальний тиск насиченої пари розчинника дорівнює тиску насиченої пари над чистим розчинником помноженому на мольну частку розчинника в розчині: р = p0N0 (3.14) Рівняння (3.14) носить назву закон Рауля. Закон Рауля можна пояснити наступним чином. Нехай рідина при деякій температурі має тиск насиченої пари p0. При розчиненні у ній речовини В тиск пари при тій же температурі знизиться і стане рівним р. Зниження тиску насиченої пари пов’язане зі зниженням мольної частки розчинника (А) від 1 до N0, що призводить до зменшення числа молекул А, які переходять в пару. Так як сили взаємодії молекул FA-A, FB-B, FA-B одинакові, то число молекул, що переходить в пару, зменшується пропорційно зниженню мольної частки речовини А в розчині, тобто розчинника. Якщо ідеальний розчин складається із двох летких компонентів, то закон Рауля буде справедливим як для розчинника, так і для розчиненої речовини. Якщо пара володіє властивостями ідеального газу, то
Із рівнянь випливає, що парціальний тиск пари кожного компонента над ідеальним рідким розчином є лінійною функцією його мольної частки в розчині. Загальний тиск пари над ідеальним розчином дорівнює сумі парціальних тисків окремих компонентів. Для бінарного розчину згідно закону Дальтона
р = pA+pB (3.16) Дифузія, осмос, осмотичний тиск. Закон Вант-Гоффа. У дуже розбавлених розчинах молекули розчиненої речовини практично не взаємодіють одна з одною, бо сили притягання між ними в розчині майже відсутні, через те що середня відстань між ними надто велика порівнянно з їхніми власними розмірами. Це пояснює поведінку молекул у розбавленому розчині, аналогічну поведінці ідеального газу. Аналогія з газами виявляється, наприклад, у здатності розчиненої речовини рівномірно розподілятися в усьому об’ємі розчину. Тому розбавлені розчини підлягають законам ідеальних газів. Властивості таких розчинів не залежать від природи розчиненої речовини, а визначаються лише їхньою концентрацією. Так, якщо в посудину з концентрованим розчином кухонної солі обережно влити шар води, то частинки (Na+ i Cl–) через деякий час рівномірно розподіляться в усьому об’ємі. Цей процес буде тривати доти, поки не пройде вирівнювання концентрації солі в усьому об’ємі розчину. Самочинне вирівнювання концентрації розчиненої речовини в розчині зумовлене тепловим рухом частинок розчинюваної речовини та розчинника, називається дифузією (від лат. diffusio – розчинення, розповсюдження). Здатність речовин до дифузії визначається коефіцієнтом дифузії D, який є кількісною величиною речовини, що дифундує за одиницю часу крізь одиницю площі при градієнті концентрації, рівному одиниці. Значення коефіцієнта дифузії визначається рівнянням:
де: kT – міра теплової або кінетичної енергії молекули; f – міра в’язкісної протидії дифузії молекулам розчиненої речовини з боку розчинника. Швидкість дифузії зростає при підвищенні температури і градієнта концентрації і зменшується при збільшенні в’язкості середовища (розчинника) та розміру дифундуючих частинок. Збільшення розміру частинок (молекулярної маси) приводить до зменшення коефіцієнта дифузії (табл. 3.4).
Таблиця 3.4. Залежність коефіцієнта дифузії від молекулярної маси. Речовина Молекулярна маса D Сечовина Гліцерол Цукроза Яєчний альбумін Глобулін сироватки крові (коня) Тиреоглобулін свині 7,7 4,1 2,7
Явище дифузії відіграє важливу роль у життєдіяльності організмів. З дифузією пов’язані процеси перенесення поживних речовин та продуктів обміну, дихання, проведення нервових імпульсів. Кожна клітина організму є дуже складна система різних речовин (систему фаз), яка суттєво впливає на направленість і швидкість дифузії різних речовин. Зміни функціонального стану клітини, які пов’язані із загальними регуляторними механізмами живих організмів, супроводжуються змінами стану фаз, їх об’ємів, величини поверхневого поділу між ними. Все це призводить до відповідних змін у дифузії різних речовин. Інтенсивність обмінних реакцій також впливає регулятивно на дифузію. Підвищення обмінних процесів посилює використання дифундуючих реагентів і веде до накопичення продуктів реакцій, що у свою чергу підвищує градієнт їх концентрацій і збільшує дифузію. Пониження інтенсивності обмінних процесів діє у зворотному напрямку.
У природі розчини часто відділяються від розчинника мембранами, які володіють проникністю лише для частинок розчинника. У цьому випадку частинки розчиненої речовини дифундувати у розчинник не можуть. Наприклад, якщо помістити еритроцити у чисту воду то вони спочатку набрякають, а потім руйнуються, оскільки вода проникає через клітинну оболонку, яка володіє напівпроникністю, всередину еритроцитів. Це пов’язано з тим, що система прагне до рівності тисків насиченої пари над розчином всередині клітини і тиском насиченої пари чистої води, що знаходиться ззовні клітини. Такий врівноважений гідростатичний тиск називають осмотичним тиском розчину, а одностороння дифузія розчинника – осмосом (від грецького osmos –поштовх, тиск). Величина осмотичного тиску розчину визначається тим зовнішнім тиском (крім тиску самого розчинника), який слід докласти до розчину, щоб осмос припинився. На підставі одержаних експериментальних даних Я.Вант-Гофф у 1887 році сформулював закон: осмотичний тиск розчину дорівнює тому тиску, який чинила б розчинена речовина, якби вона при тій же температурі перебувала в газуватому стані і займала об’єм, рівний об’єму розчину. Тому для кількісної характеристики осмотичного тиску Вант-Гофф використав основне рівняння газового стану – рівняння Клапейрона-Менделєєва:рV = νRT. (3.18) Для розрахунку осмотичного тиску розчинів неелектролітів це рівняння можна записати: πV = νRT, (3.19) де: π – осмотичний тиск, Па; V – об’єм розчину (л); ν – кількість молів розчиненої речовини; R – універсальна газова стала (8,314´103 Дж/моль·K); T – абсолютна температура, К. Перенісши V у праву частину рівняння, одержимо:
Оскільки π = СMRT. (3.21) Тобто осмотичний тиск прямо пропорційний молярній концентрації розчину. Для розчину електролітів вводять ізотонічний коефіцієнт Вант-Гоффа: π = іСMRT. (3.22) Усі методи визначення осмотичного тиску поділяються на чотири групи – осмометричні, плазмолітичні, кріоскопічні та ебуліоскопічні. При використанні осмометричних методів застосовуються спеціальні прилади – осмометри. У 1877 році В.Пфеффер сконструював найпростіший осмометр у вигляді циліндра із пористої глини, стіни якого проникні для будь-якого розчинника. Циліндр заповнювали розчином CuSO4 і занурювали в розчин калію гексаціаноферату (II). У порах циліндра утворювалася напівпроникна плівка із купрум гексаціаноферату (ІІ): 2CuSO4+K4[Fe(CN)6] → Cu2[Fe(CN)6] + 2K2SO4. Стінка циліндра ставала проникною лише для одного розчинника – води. Вносячи у циліндр розчини різної концентрації манометром можна фіксувати неоднакові осмотичні тиски (рис. 3.3).
Рис. 3.3. Схема осмометра: 1 – осмо-метр; 2 – манометр; 3 – посудина з розчином; 4 – висота підняття стовпчика ртуті після осмосу. В основі плазмолітичних методів осмотичний тиск розчинів порівнюється з осмотичним тиском ізольованих клітин тварин (частіше еритроцитів) або рослин. Клітини вносять у розчини з різною концентрацією будь-якої розчиненої речовини, наприклад NaCl, стосовно якого клітинна оболонка непроникна. Розчини з вищим осмотичним тиском (гіпертонічні) будуть “всмоктувати” воду із клітин, які зморщуватимуться (настає плазмоліз), в результаті чого збільшується густина і вони осідають на дно посудини. Розчини з нижчим осмотичним тиском, як у клітинах, по-іншому чинять осмотичну дію – розчинник через плазмолітичну мембрану проникає у клітину, її об’єм збільшується, оболонка розривається і вміст виходить у позаклітинне середовище. У випадку еритроцитів настає гемоліз. Такі розчини називаються гіпотонічними. Їх π менший від π крові (686,8–737,3 кПа). Розчини з осмотичним тиском, рівним осмотичному тиску клітин, чи плазми крові, не призводять до зміни об’єму клітин. Їх називають ізотонічними. Прикладом ізотонічного розчину, або фізіологічного, є 0,85%-й розчин NaCl (146,0 моль/м3). Розрахункове значення осмотичного тиску цього розчину при 37ºС дорівнює: π = 2·146,0·8,314·310·10–3 = 7,5·102 кПа. Ізотонічним щодо плазми крові є 4,5–5,0% розчин глюкози. Такий розчин можна вводити внутрівенно в організм. Гіпертонічні розчини можна вводити тільки у невеликих дозах, бо великі дози призводять до втрати води еритроцитами з наступним плазмолізом. Зате зовнішньо такі розчини використовуються як пов’язки ран, для пришвидшення їх очищення. Гіпотонічні розчини не слід вводити внутрівенно, тому що це зумовить набрякання і руйнування еритроцитів – гемоліз. Часто при дослідженні властивостей розчинів біополімерів перевагу віддають кріометричним методам визначення осмотичного тиску. Вимірювання температури замерзання не супроводжується зміною у структурі розчинених речовин та розчину. Так, “осмотичну” концентрацію біологічних рідин (крові, лімфи, сечі), яку неможливо визначити звичайними методами кількісного аналізу, вимірюють кріометрією за формулою:
а осмотичний тиск:
Осмотичний тиск розчинів у деяких випадках визначається ебуліоскопічним методом, який базується на вимірюванні підвищення температури кипіння розчину порівняно з температурою кипіння чистого розчинника. Різниця температур кипіння ΔТк визначається метастатичним термометром. Теоретичною основою є закони Рауля: для безмежного розбавлення розчину нелеткої речовини і відсутності електролітичної дисоціації ΔТк пропорційна моляльній концентрації розчину: ΔТк = ЕCm. (3.25) Ебуліоскопічний метод мало придатний для визначення осмотичного тиску біологічних рідин, тому що ебуліоскопія призводить до руйнування структур біополімерів. Значення осмотичного тиску, осмосу в біологічних процесах. Кров, лімфа і всі тканинні рідини є водними розчинами які володіють певним осмотичним тиском. У багатоклітинних організмів відповідний осмотичний тиск підтримується вибірковою проникністю біологічних мембран для різних речовин і активним транспортом йонів. Відносна стійкість осмотичного тиску в організмі тварини і людини забезпечується водносольовим обміном – всмоктування, розподіл, використання і виділення води, солей, кислотно-основних компонентів. У живих організмах існує осмотичний гомеостаз, який визначається видом і віком організму, фізіологічним станом. Так, осмотичний тиск у ссавців – 0,66-0,8 МПа. Осмотичний тиск більшості біологічних рідин організму відповідає осмотичному тиску крові. З явищем осмосу пов’язані процеси росту і розвитку рослин. Клітинні оболонки рослин володіють напівпроникністю. Крізь них у клітину проникає вода і поживні речовини (ендосмос) та виділяються у міжклітинний простір продукти обміну (екзоосмос). Осмотичний тиск у клітині забезпечує їй відповідну пружність – тургор, що дає живим рослинам міцність, еластичність і збереження клітинами, тканинами та організмами рослин відповідної форми, необхідної для їх існування. Осмотичний тиск виконує функції механізму надходження в клітину окремо і в рослину в цілому поживних речовин і води. Достатня кількість води в клітинах необхідна для проходження численних фізичних і хімічних реакцій обміну, пов’язаних з процесами гідратації, гідролізу, окиснення та відновлення, біосинтезу багатьох речовин. Втрата клітинами і тканинами рослин стану тургору веде до їх прив’янення, засихання та загибелі. Для організму людини і тварин характерна сталість осмотичного тиску – ізоосмія. Вона виражається в осмотичному тиску таких біологічних рідин, як кров, лімфа, ліквор і сягає величини – 0,66-0,8 МПа. Зниження осмотичного тиску через уведення в організм великої кількості води або втрати солей призводить до патології – виникають судоми, запаморочення і навіть смерть. Підвищення осмотичного тиску веде до перерозподілу води в організмі – виникають набряки, особливо при хворобах нирок, фасціольозі та ін.
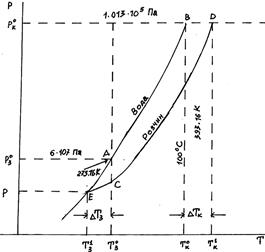
Рис. 3.4. Схема осередку запалення (за С.Афонським): 1 – зона інфільтрату; 2 – центр осередку; 3 – зона периферичного набряку; 4 – здорова тканина. Порушення осмотичного тиску відбувається локально в зоні запального процесу (абсцесів, фурункулів, пухлин, набряків). Так, в осередку запалення (рис. 3.4) осмотичний тиск тканинної рідини досягає 1,7-0,97 МПа, тоді як в нормальній тканині – 0,68 МПа. Підвищення температури кипіння і зниження температури кристалізації розбавлених розчинів нелетких речовин. Другий закон Рауля. Температура кипіння і замерзання розчинів залежить від тиску насиченої пари над розчином. Рідина закипає при тій температурі, при якій тиск її насиченої пари зрівноважується із атмосферним тиском. Внаслідок зниження тиску пари над розчином температура кипіння розчину завжди вища, ніж чистого розчинника. Так, для чистої води тиск насиченої пари дорівнює атмосферному тиску (1,013·105 Па) при 393,16 K (100°С) (Т°к). Коли ж розчинити у воді будь-яку речовину, то тиск насиченої пари знижується. Тому, щоби розчин закипів, потрібно нагріти його до температури, вищої 100ºС. Зміна температури кипіння розчину залежить від концентрації розчиненої речовини; із збільшенням її концентрації знижується тиск насиченої пари і підвищується температура кипіння розчину. Замерзає рідина при тій самій температурі, при якій тиск насиченої пари речовини у твердому стані зрівноважуюється з тиском пари цієї речовини в рідкому стані. Так, тиск пари льоду і тиск пари води одинакові і дорівнюють 4,6 мм рт. ст. (6,107 Па) при 273,16 K (0,00°С) (Т°з), тому 0°С вважається температурою замерзання води. Коли ж узяти розчин будь-якої речовини у воді, то внаслідок зниження тиску пари при 0°С він матиме менший тиск пари, ніж у чистій воді. Лише при температурі, нижчій від нуля, тиск насиченої пари над розчином зменшиться настільки, що зрівноважиться з тиском насиченої пари льоду при тій самій температурі. Отже, розчин замерзає не при 0°С, а при нижчій температурі. Наприклад, розчин із вмістом 10 г NaCl в 100 г води замерзає при –2,5ºС.
|
|||||||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 3; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.124.21 (0.009 с.) |
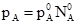 ;
; 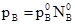 (3.15)
(3.15)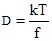 , (3.17)
, (3.17)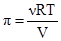 . (3.20)
. (3.20) виражає молярну концентрацію розчину, то остаточне рівняння матиме вигляд:
виражає молярну концентрацію розчину, то остаточне рівняння матиме вигляд: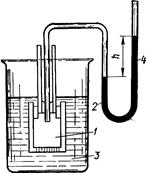
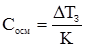 , (3.23)
, (3.23)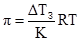 . (3.24)
. (3.24)