
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамічна константа дисоціації. Активність, коефіцієнти активності. Йонна сила розчину.Содержание книги
Поиск на нашем сайте
Н Н H:N:+AlCl3 → H:N+:AlCl3–. H H Молекула амоніаку має неподільну пару електронів і виступає як основа, а координаційно-насичена молекула AlCl3 – кислота. На основі визначення Льюїса, всі звичайні ліганди (NH3, CN–, F–, Cl–, SO32– та ін.) можна розглядати як основи, а всі йони металів – як кислоти. Ступінь спорідненості йона металу до ліганда називають льюїсівською кислотністю, а тенденція ліганда утворювати зв’язки з йонами металів називається льюїсівською основністю. Сила кислоти і основи Льюїса може змінюватися залежно від природи партнера. Йони металів володіють різною спорідненістю до лігандів, тому їх прийнято поділяти на дві групи. Метали одної групи утворюють найбільш стійкі зв’язки за донорно-акцепторним механізмом з легкими лігандами (наприклад, F–, Cl–, Br–, J– або з лігадами типу R3N, R3P, R3As, R3Rb). Для металів другої групи характерна протилежна тенденція. Величина константи дисоціації електроліту, що виражається рівнянням типу (3.43) або (3.44), не змінюється при зміні концентрації. Наприклад, зменшення концентрації кислоти (зменшення знаменника) приводить до зменшення концентрації йонів (зменшенням чисельника) у зв’язку з чим константа залишається постійною. Однак при значному збільшенні концентрації електроліту (при С>0,2 моль/л) число йонів в розчині збільшується, сила взаємодії їх між собою і з розчинником зростає, що викликає деякі зміни константи дисоціації. Незначні зміни в константі дисоціації при зміні концентрації (йонної сили) кількісно враховують концентраційним параметром, який називається активністю. Активність визначається як величина, яку можна використати замість концентрації в термодинамічному рівнянні того чи іншого розчину: аВ = СВyВ, (3.50) де аВ – активність речовини В, моль/л; СВ – концентрація речовини В, моль/л; yВ – молярний коефіцієнт активності (безрозмірна величина). Якщо концентрацію виражають в моляльності, то коефіцієнт активності позначають νВ і називають моляльним коефіцієнтом активності. Коефіцієнт активності (а також і активність) міняється при зміні концентрації таким чином, що введення а замість с у вираз для константи дисоціації призводить до незалежності числового значення константи від концентрації. Рівняння (3.43), наприклад, перетворюється у вираз
де Kа – термодинамічна канстанта дисоціації. Вона залишається сталою при всіх значеннях йоннної сили. У розбавлених розчинах коефіцієнти активності рівні одиниці, а активність і молярна концентрація ідентичні. Коефіцієт активності є мірою відхилення властивостей реального розчину від ідеального (безмежно розбавленого). Коефіцієнт активності практично мало залежить від природи електроліту, а визначається лише йонною силою розчину (табл. 3.7). Згідно теорії Льюїса-Рендела, коефіцієнт активності любого йона один і той же в усіх розбавлених розчинах, що мають одинакову йонну силу. Таблиця 3.7.
|
||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 6; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.65.85 (0.006 с.) |

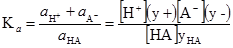 , (3.51)
, (3.51)


