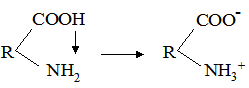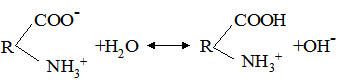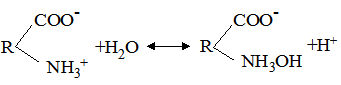Содержание книги
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
При невеликих значеннях α можна вважати, що 1–α = 1 і
У загальному вигляді
Якщо у рівняння (3.44) ввести значення рівноважних концентрацій йонів [H+] = [A–] = Cα і недисоційованих молекул с–сα = с(1–α), то одержимо рівняння
яке називають законом розведення Оствальда.
Отже, ступінь дисоціації зростає обернено пропорційно квадратному кореню із величини концентрації електроліту. Наприклад, при зменшенні концентрації в 100 разів ступінь дисоціації зростає в 10 разів. Ступінь дисоціації електроліту залежить не тільки від концентрації, а й від природи розчинника, електроліта і температури. Теорія електролітичної дисоціації С.Арреніуса мала виключно важливе значення для розвитку теорії слабких електролітів. До початку ХХ ст. на її основі були пояснені багаточислені дані по колігативних властивостях розчинів. При використанні закону розведення В.Оствальда була широко вивчена ступінь дисоціації електролітів у водних розчинах. Однак в дальнішому стало очевидним, що теорія С.Арреніуса має ограничене застосування. Суттєвим недоліком теорії Арреніуса є те, що вона не пояснює причини дисоціації електролітів на йони. Роль розчинника при дисоціації, Арреніусом не розглядалася. Не зовсім вірним виявилося визначення понять кислоти і основи. Із практики відомо що багато органічних сполук, в тому числі лікарські речовини (фенобарбітал сульфадимезин та ін.), при дисоціації не виділяють йон гідрогену, але проявляють кислотні властивості. Також відомо, що багаточисленні речовини (амідопірин, антипірин, гексаметилентетрамін, триметиламін) не мають у своєму складі гідроксильних груп і не виділяють гідроксил-йони при дисоціації, однак є типовими основами. Так як теорія Арреніуса не розглядала взаємодії йонів з розчинником, вона не могла передбачати того, що йон гідрогену існує у сольватованому стані. Як виявилося, у зв’язку з великою густиною заряду в атомі гідрогену у йона Н+ проявляється велика активність, тому він сольватується розчинником. У воді він знаходиться у вигляді йона гідроксонія Н3О+, в етанолі - у вигляді йона етоксонія С2Н5ОН2+ і т.п. Не пояснює теорія Арреніуса і те, що багато речовин,будучи нейтральними у воді, в льодовій ацетатній кислоті проявляють основні вдастивості, а в рідкому амоніаку – кислотні. Вказані факти свідчать про те, що йони не просто механічно розподілені у розчиннику, а між ним і розчиненою речовиною має місце взаємодії і природа розчинника при цьому відіграє значну роль.
Недоліком теорії Арреніуса є і те, що вона не пояснює поводження розчинів сильних електролітів. Протонна теорія кислот і основ Бренстеда-Лоурі. У 1923 р. з’явилися дві теорії кислот і основ – Бренстеда-Лоурі і Льюїса. Згідно з протонною теорією Бренстеда-Лоурі, кислоти – це речовини, які можуть відщеплювати протони (донори протонів), а основи – речовини, які здатні приєднувати протони (акцептори протонів). Із цього випливає, що реакція нейтралізації зводиться до перенесення протонів від кислоти до основи. Втрачаючи протон, кислота перетворюється в основу, тому що в результаті оборотної реакції утворена речовина здатна приєднувати протон. Аналогічно, основа, приєднуючи протон, стає кислотою. Такий взаємозв’язок між кислотами і основами можна виразити рівняннями, сума яких є реакцією нейтралізації. А1 ⇄ В1 + Н+ кислота1 основа1 протон В2 + Н+ ⇄ А2 основа2 протон кислота2 А1 + В2 ⇄ А2 + В1 кислота1 основа2 кислота2 основа1 Речовини А1 і В1 називають спряженою системою або парою, тому що кислота А1, втрачаючи протон, утворює спряжену її основу В1, а основа В2 утворює спряжену її кислоту А2 за рахунок приєднання протону. Наприклад, при взаємодії хлорнуватистої кислоти з водою HСlО + Н2О ↔ ClО– + Н3О+ кислота1 основа2 основа1 кислота2 молекула HClО віддає протон молекулі води. Отже, вона – кислота1. Молекула Н2О приймає протон і утворює йон гідроксонію Н3О+, виступаючи як основа2. Разом з тим у оборотній реакції Н3О+ буде кислотою, а ClО– - основою. Кислотами і основами можуть бути нейтральні молекули, позитивні або негативні йони, наприклад: Кислота
Основа СН3СООН ⇄ Н++СН3СОО– NH4+ ⇄ H++NH3 H2PO4– ⇄ H++HPO42– [Al(H2O)6]3+ ⇄ Н++[Al(H2O)5OH]2+. Згідно з Бренстедом-Лоурі, вода, як і багато інших речовин, здатна не тільки віддавати, але й приєднувати протони, проявляючи властивості амфолітів. У присутності сильніших основ вода веде себе як кислота, а в присутності сильніших кислот – як основа: NH3+H2O ⇄ NH4++OH–;
кислота HCl+H2O ⇄ H3O++Cl–. основа Кислотні властивості певної речовини проявляються тільки у присутності акцептора протона, а основні властивості – у присутності донора протона. Речовини, що здатні віддавати або приєднувати протони, називаються протолітами. Протолітична реакція характеризується станом протолітичної рівноваги. Остання, згідно з законами термодинаміки, завжди зміщуватиметься у бік утворення слабших протолітів. Наприклад у реакції: H3O++NH3 ⇄ H2O+NH4+ рівновага зміщена вправо, тобто у бік утворення слабкого електроліту – води. Протодонорна і протоакцепторна здатність речовин визначається спорідненістю до протона, тобто ентальпією реакції приєднання протона. Для встановлення відносної сили протолітів слід знати силу протолітів щодо певного еталону. Для водних розчинів протолітів таким еталоном кислотності і основності є вода. Сильні кислоти реагують з водою у розведених розчинах необоротно. Тому їх сила у водному розчині максимальна і дорівнює силі йона гідроксонію Н3О+ (найсильніша кислота у водному розчині). Сильними кислотами у воді є HBr, HBrO3, HBrO4, HCl, HClO4, H2CrO4, HJ, HJO3, HMnO4, HCNS, HNO3, H4P2O7, H2SO4, H2SeO4 та ін. Найсильнішою основою у водному розчинів є йон ОН–. Реакція протолізу слабких електролітів є оборотною: H2SO3 + H2O ⇄ HSO3– + H3O+. кислота1 основа2 основа1 кислота2 За Бренстедом-Лоурі слабкими основами є всі аніони, спряжені зі слабкими кислотами: S2–+H2O ⇄ HS–+OH–. Слабка кислота НА у водному розчині зазнає зворотного протолізу:
НА+Н2О ↔ А–+Н3О+. Константа рівноваги цієї реакції:
К[Н2О] = де: B+Н2О ↔ HB++OH–. Кількісною характеристикою цієї рівноваги є: К[Н2О] = Кb = де: Кb – константа основності. Чим більше значення Кα (Кb), тим більшою за силою слабкою кислотою (слабкою основою) вважається протоліт – реагент у водному розчині. Деякі речовини проявляють властивості кислоти і основи у тому ж розчиннику. Такі речовини називають амфотерними, або амфолітами. До них належать аніони Н2РО4–, НРО42–, НСО3–, НSO4–, HS–, гідроксиди Be(OH)2, Zn(OH)2, Al(OH3), Cr(OH)3, а також амінокислоти. Наприклад, протолітична реакція гідросульфід-йона: НS–+Н2О ⇄ S2–+Н3О+; НS–+Н2О ⇄ Н2S+ОН–. Амфотерні гідроксиди металів важкорозчинні у воді. Та частина, що переходить у розчин, вступає у дві протолітичні реакції: як кислота і як основа: Zn(OH)2+Н2О ⇄ [Zn(OH)3]–+Н3О+; Zn(OH)2+Н2О ⇄ [ZnOН+(H2О)]+ОН–. Амфотерність амінокислот обумовлена наявністю у їх молекулах двох функціональних груп – аміногрупи та карбоксильної групи. У розчині амінокислоти існують у вигляді цвіттерйонів (або амфійонів):
цвіттерйон Група СОО– у цвіттерйоні проявляє основні властивості, група NH3+ – кислотні:
катіонна форма
аніонна форма
Характеристика кислот і основ за Бренстедом дала змогу систематизувати цілий ряд хімічних реакцій, і перш за все, це реакції, які за Арреніусом розглядаються як гідроліз. Наприклад: а) гідроліз калій карбонату: електролітична дисоціація: К2СО3 ⇄ 2К++СО32–; протоліз: СО32–+Н2О ⇄ НСО3–+ОН– (І); рКв = 3,67, рН>7; розчин буде мати лужну реакцію. б) гідроліз натрій дигідроортофосфату: електролітична дисоціація: NаН2РО4 ⇄ Na++H2PO4–; протоліз: Н2РО4–+Н2О ⇄ НРО42–+Н2О+ (І); рКα = 7,21; рН<7; Н2РО4–+Н2О ⇄ Н3РО4+ОН– (ІІ); рКв = 11,86. Протоліз йонів Н2РО4– як кислоти переважає, оскільки рКα<рКв. Отже розчин буде мати кислу реакцію. Реакція нейтралізації за Бренстедом оборотна автопротолізу води. Оскільки ступінь перебігу останнього незначний, то реакція нейтралізації практично йде до кінця. Реакція нейтралізації між HCl i NaOH у водному середовищі характеризується такими процесами: протоліз: HCl+Н2О ⇄ Cl–+Н3О+; електролітична дисоціація: NaOH ⇄ Na++OH–; нейтралізація: Н3О++OH– ⇄ 2Н2О. Теорія кислот і основ Г.Льюїса. Більш загальне поняття про природу кислот і основ висунув Г.Льюїс: кислота – це речовина, яка є акцептором електронної пари; основа – це речовина, яка виступає донором електронної пари. Взаємодія між кислотою і основою, згідно з теорією Льюїса, полягає у виникненні ковалентного зв’язку за донорно-акцепторним механізмом:
|
|||||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 3; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.176.228 (0.008 с.) |
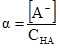 або
або 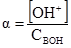 (3.47)
(3.47)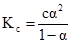 (3.48)
(3.48)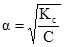 (3.49)
(3.49)

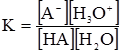 , так як [Н2О]= const, то
, так як [Н2О]= const, то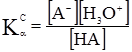 ,
,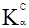 – константа кислотності: кількісна характеристика протолітичної рівноваги реакції між слабкою кислотою НА та основою Н2О. Аналогічно для слабкої основи рівняння зворотного протолізу:
– константа кислотності: кількісна характеристика протолітичної рівноваги реакції між слабкою кислотою НА та основою Н2О. Аналогічно для слабкої основи рівняння зворотного протолізу:

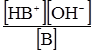 ,
,