
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
електролітів при 298°K (λ, См·моль–1·м2).Содержание книги
Поиск на нашем сайте
електролітів при 298°K (λ, См·моль–1·м2). Катіон λ+104 Аніон λ–104 H3O+ Li+ Na+ K+ Ag+ NH4+ Mg2+ Ca2+ Ba2+ Cu2+ Zn2+ Al3+ 349,81 38,68 50,10 73,50 61,90 73,50 53,05 59,90 63,63 56,60 52,80 63,00 OH– F– Cl– Br– J– NO3– HCO3– CH3COO– SO42– HCOO– C6H5COO– C2O42– 198,30 55,40 76,35 78,14 76,88 71,46 44,50 40,90 80,02 54,60 32,30 74,10
§2. Кондуктометричне визначення ступеня і константи йонізації слабкого електроліту. За молярною електропровідністю можна розраховувати ступінь дисоціації слабких електролітів. При розбавленні слабких електролітів ступінь їх дисоціації α зростає, число йонів збільшується; пропорційно до цього збільшується і молярна електропровідність, досягаючи максимуму (λmax) при дисоціації всіх молекул електроліту (тобто при безмежному розведенні). Таким чином, молярна електропровідність буде пропорційна ступеню дисоціації електроліту: λС = kα. (4.11) При повній дисоціації α = 1, а λmax = k. Підставиши це значення у рівняння (4.8), одержимо: λC = λmaxα, звідки ступінь дисоціації електроліту при даному розведенні буде дорівнювати:
де: λC – молярна електропровідність при даному розведенні; λmax – молярна електропровідність при безмежному розведенні. Величину λmax знаходять у довідникових таблицях як суму рухливостей катіонів і аніонів, а λC визначається еспериментально. Визначення проводять за допомогою містка Кольрауша, який працює за принципом компенсації, тобто порівнюється опір електроліту з відомим опором. Якщо у рівняння закону розведення
то можна вирахувати константи дисоціації слабких електролітів:
Рівняння (4.13) дозволяє визначити К безпосередньо за знайденими величинами електропровідності. При розведенні слабкого електроліту збільшується ступінь дисоціації α, а константа дисоціації K не змінюється. Для сильних електролітів співвідношення молярних електропровідностей при даному і безмежному розведеннях характеризується коефіцієнтом електропровідності f:
Коефіцієнт електропровідності залежить від міжйонної взаємодії в розчинах і при високих значеннях розведення дорівнює одиниці. Константа йонізації для кожного електроліту при даній температурі є величина стала. Вона є мірою сили електроліту. Чим більше значення К, тим сильніший електроліт. У табл. 4.4 наведені значення констант йонізації деяких слабких електролітів. Таблиця 4.4. Константи йонізації слабких основ та основ у водних розчинах при 298 K. Кислота K, моль/л pK Бензойна Борна Трихлорацетатна Ацетатна Молочна Форміатна Карбонатна Фосфатна C6H5COOH H3BO3 CCl3COOH CH3COOH C2H4OHCOOH HCOOH H2CO3 (I) H3PO4 (I) 6,14·10–5 5,83·10–10 0,2 1,75·10–5 1,38·10–4 1,77·10–4 4,45·10–7 7,11·10–3 4,21 9,23 0,7 4,76 3,86 3,75 6,35 2,15 Основа K, моль/л pK Амоній гідроксид Етиламін Діетиламін NH4OH C2H5NH2 (C2H5)2NH 1,77·10–5 4,3·10–4 5,6·10–4 4,75 3,37 3,06 §3. Кондуктометричне титрування. Вимірювання електропровідності розчинів є основою кондуктометричних методів аналізу. Ці методи використовують для визначення не тільки ступеня і константи дисоціації електролітів, а й для визначення концентрації електролітів у розчинах, їх розчинності та основності кислот. Велике практичне значення має метод кондуктометричного титрування, який використовується при дослідженнях каламутних чи забарвлених розчинів, у яких неможливе застосування індикаторів. В основі методу лежить присутність у розчинах кислот (або основ) високорухливих йонів Н3О+ (або ОН–), які обумовлюють добру електропровідність. При титруванні відбуваються реакції нейтралізації і замість йонів Н3О+ і ОН– у розчині накопичуються йони солей, що володіють меншою рухливістю: Н3О++Cl–+Na++ОН– → 2Н2О+Na+Cl–. У той момент, коли вся кислота (або основа) буде нейтралізована еквівалентною кількістю основи (або кислоти), електропровідність розчину буде мінімальною, досягнувши точки еквівалентності. Тоді в розчині будуть знаходитися тільки йони Cl– і Na+. При введенні надлишку основи (або кислоти) знову з’являються високорухливі йони ОН– (або Н3О+) і електропровідність починає різко зростати (рис. 4.3.1).
Рис. 4.3. Криві кондук-тометричного титруван-ня: 1 – сильної кислоти; 2 – слабкої кислоти; 3 – суміші сильної і слабкої кислот. При титруванні слабкої кислоти зміна електропровідності титрованого розчину відбуватиметься по іншому. На рис. 4.3.2 приведено криву титрування ацетатної кислоти натрій гідроксидом: СН3-СООН+Na++ОН– → Н2О+Na++СН3СОО–. Ацетатна кислота, до додавання лугу, знаходиться у розчині у молекулярній формі і лише незначна її частина – у вигляді йонів Н+ та СН3СОО–, тому електропровідність початкового розчину невелика. При титруванні електропровідність розчину повільно збільшується внаслідок заміни ацетатної кислоти (слабкого електроліту) на натрій ацетат (сильний електроліт). Після досягнення моменту еквівалентності електропровідність цього розчину різко зростає, бо в ньому з’являється надлишок високорухливих йонів ОН–. Титрування суміші сильної і слабкої кислот дає на кривій титрування дві точки еквівалентності (рис. 4.3.3). Сильна кислота HCl зменшує дисоціацію слабкої кислоти СН3СООН, остання знаходиться в розчині у молекулярній формі, тож і не впливає на електропровідність. До першої точки еквівалентності титрується сильна кислота, і електропровідність зменшується. Після першої точки еквівалентності починає титруватися слабка кислота, при цьому електропровідність розчину повільно збільшується до другої точки еквівалентності. Після другої точки еквівалентності більш різке збільшення електропровідності відбувається за рахунок введення в розчин надлишку високорухливих гідроксид-йонів. Такі ж криві одержують при титруванні суміші сильної і слабкої основи сильною кислотою. Визначивши за графіком (рис. 4.3 криві 1, 2) точки еквівалентності та об’єм розчину NaОН, витраченого на титрування, із співвідношення СкVк = СлVл, знаходимо молярну концентрацію еквівалента кислоти:
де: Vк – об’єм розчину кислоти; Ск – молярна концентрація еквівалента кислоти; Vк – об’єм розчину лугу, витрачений на титрування; Сл – молярна концентрація еквівалента лугу. При титруванні суміші сильної та слабкої кислот об’єм лугу, витраченого на титрування слабкої кислоти Vл, дорівнює різниці об’ємів V2 і V1.
§4. Значення електропровідності для біологічних систем. Живий організм – це складна фізико-хімічна система, яка складається з клітин і міжклітинного простору. У складі клітин і міжклітинної рідини присутні йони і рухливі полярні молекули органічного і неорганічного походження, які й обумовлюють електропровідність живої тканини. Електропровідність різних тканин і біологічних рідин неоднакова: найбільшою електропровідністю володіють спинно-мозкова рідина, лімфа, жовч, кров; добре проводять струм м’язи, підшкірна клітковина, сіра речовина головного мозку. Значно нижча електропровідність легень, серця, печінки. Дуже низька вона у жировій і кістковій тканинах. Найгірше проводить електричний струм шкіра (роговий шар). Сухий епідерміс майже не володіє електропровідністю. Рідина міжклітинного простору набагато краще проводить струм, ніж клітини, оболонки яких чинять суттєву перепону руху багатьох йонів. Біля оболонок накопичуються однойменно заряджені йони, виникає поляризація. Все це призводить до різкого (10-100 разів) падіння сили постійного струму, що проходить через тканини, вже через 0,0001 сек після його замикання. При руйнуванні клітинних мембран різниця у величині електропровідностей тканин для постійного і змінного струмів зникає. У біологічних та медико-діагностичних дослідженнях електропровідність клітин і тканин вимірюють при різних частотах струму. Частотний характер залежності провідності дає змогу зробити висновки про розмір і форму клітин, проникність мембран, порівняти об’єми клітин і міжклітинного простору, визначити вміст йонів та води у клітинах. Метод електропровідності не є руйнівний і дуже оперативний для визначення клінічного стану організму. Так, у нормі питома електропровідність сечі людини знаходиться у межах 165-229 См·м–1. При хворобах нирок (нефрит, нефросклероз) електропровідність знижується до 86-138 См·м–1. У хворих на діабет електропровідність сечі також знижена (90-144 См·м–1). Зниження електропровідності крові спостерігається при пневмоніях, гепатиті В, кетонурії. Визначення кровонаповнення органів і судин здійснюють на основі вимірювання опору. Кров порівняно з іншими клітинними рідинами має меншу електропровідність, опір серця і судин при їх наповненні кров’ю збільшується. Метод реєстрації кровонаповнення органів на основі вимірювання опору називають реографією. Вона дає можливість дослідити кровообіг у печінці, нирках, серці, магістральних та дрібних судинах. §5. Електродні потенціали. Рівняння Нернста. Електрохімічні елементи та електрорушійні сили.
Рис. 4.4. Схема виникнення подвійного електричного шару. Якщо метал занурити у воду, проходить відрив катіонів від кристалічної решітки металу під впливом полярних молекул води. В результаті на металі залишається надлишок електронів, які надають поверхні металу негативного заряду. Позитивно заряджені гідратовані йони, які перейшли у розчин, під дією електростатичного притягання залишаються безпосередньо біля поверхні металу і утворюють так званий подвійний електричний шар (рис. 4.4). Між металом і розчином виникає стрибок потенціалу, який називають електродним потенціалом, а систему, що складається з металу (металева пластинка) і розчину електроліту – електродом. Поряд з переходом йонів з металу в розчин відбувається і зворотний процес переходу дегідратованих йонів з розчину на метал. Якщо занурити металеву пластинку в розчин власної солі, то можуть відбуватися такі процеси: а) у розведених розчинах швидкість переходу йонів з металу в розчин υ1
може бути більшою від швидкості зворотного процесу переходу йонів з розчину на металеву пластинку υ2
Це зумовить зменшення кількості позитивних йонів у металі і збільшення їх кількості у розчині. Поверхня металевої пластинки набуде негативного, а прилягаючий шар розчину – позитивного заряду. Чим більша різниця υ1–υ2, тим негативнішим буде заряд металевого електрода. Величина υ2 залежить від вмісту йонів металу в розчині: більшим їх концентраціям відповідає більша швидкість υ2. Отже, із збільшенням концентрації йонів у розчині зменшується негативний заряд металевого електрода; б) у концентрованих розчинах швидкість переходу йонів металу у розчин υ1 буде меншою за швидкістю зворотного процесу υ2: υ1<υ2. У цьому випадку на металевому електроді буде надлишок позитивних йонів, а в розчині, навпаки, їх не вистачатиме. Це призведе до того, що електрод набуде позитивного заряду, а розчин – негативного. Рівноважний стан різниці потенціалів на межі поділу метал-розчин називають електродним потенціалом. Він обмежує процес подальшого переміщення йонів з металу або на метал, у зв’язку з чим кожному металу і певній концентрації його солі відповідає той чи інший потенціал. Оскільки перехід йонів з металу в розчин є зворотним процесом, що відбувається без зміни температури, то при цьому виконується максимальна корисна робота, і для реакції Ме ⇄ Мen+ + ne– вона становить: A = RT(lnK – ln де: R – універсальна газова стала; Т – температура реакції; К – константа рівноваги реакції; Робота переходу 1 моля йонів з металу в розчин: A = nFe, (4.16) де: n – число електронів, що втрачає атом металу; e – потенціал електрода; F – стала Фарадея. Із (4.15) і (4.16) випливає: nFe = RT(lnK–ln Після перетворення і заміни натуральних логарифмів на десяткові вираз (4.17) набуває вигляду:
При сталій температурі перший член правої частини рівняння (4.18) містить лише сталі величини. Їх добуток також є сталою величиною. Цю сталу величину позначають через е0:
Якщо її ввести у рівняння (4.18), то вираз набуде вигляду:
Це рівняння вивів у 1890 р. В.Нернст. Якщо у це рівняння ввести значення сталих величин (R = 8,314 В·Кл/моль·K; F = 9,65·104 Кл/моль; стандартну температуру Т = 298°K), то його можна записати так:
Якщо електродний потенціал вираховується при іншій температурі, то використовуються такі рівняння:
тому:
Якщо активність йонів металу в розчині становить 1 кмоль/м3, то Таблиця 4.5. Нормальні потенціали металів при 25ºС (298 K). Електрод (метал/йон) e0, B Електрод (метал/йон) e0, B Li/Li+ K/K+ Na/Na+ Al/Al3+ Mn/Mn2+ Zn/Zn2+ Fe/Fe2+ Ni/Ni2+ –3,02 –2,92 –2,713 –1,66 –1,05 –0,763 –0,441 –0,23 Pb/Pb2+ H2/2H+ Cu/Cu2+ Ag/Ag+ Hg/Hg+ Hg/Hg2+ Pt/Pt2+ Au/Au+ –0,126 0,000 +0,34 +0,80 +0,799 +0,854 +1,20 +1,70
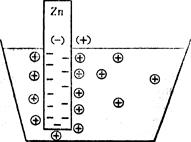
Відповідно до вищенаведених явищ можна скласти електрохімічний (гальванічний) елемент – це пристрій, у якому хімічна енергія окиснювально-відновного процесу перетворюється в електричну. Самі ж процеси окиснення та відновлення просторово розділені. Найпростіший гальванічний елемент складається з двох напівелементів-електродів, сполучених між собою. Наприклад, елемент Якобі-Даніеля, схема якого зображена на рис. 4.5, складається з цинкового електрода (цинкової пластинки у розчині ZnSO4), що схематично можна записати Zn|ZnSO4, і мідного електрода (мідної пластини у розчині CuSO4) – Cu|СuSO4. Виходячи з даних табл. 4.5, цинк заряджається негативно, а мідь – позитивно. При замиканні кола виникає електричний струм, причому електрони від цинку переходять на мідний електрод, приєднуючись до йонів міді, що осідають. Цинк поступово розчиняється, а мідь, навпаки, виділяється із розчину на електроді. Утворений надлишок йонів Zn2+ у лівій частині елемента дифундує через агарозну трубочку, що містить КCl, у праву частину, а SO42– – у ліву, взаємно нейтралізуючись.
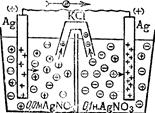
Рис. 4.5. Схема гальва-нічного елемента Якобі-Даніеля. Хімічну реакцію, яка відбувається у мідно-цинковому елементі, можна записати в йонній формі: Zn+Cu2+ → Zn2++Cu, або в молекулярній формі: Zn+CuSO4 → Cu+ZnSO4+Q, де Q = 230 кДж/моль – величина хімічної енергії, яка перетворюється в електричну. Якщо електроди виготовлені із однакового металу, то в розчині солей вони обидва набувають однойменного заряду. У елементі, схема якого наведена на рис. 4.6, на правому електроді, де концентрація солі більша, потенціал буде вищий. Отже, при замиканні зовнішнього кола потік електронів спрямується зліва направо; в результаті на правому електроді буде виділятися срібло, а лівий електрод поступово розчинятиметься. У правій частині елемента почнуть накопичуватися аніони NO3–, а у лівій – катіони Ag+, які будуть дифундувати назустріч один одному через агарозний сифон з KCl. Такий елемент називається концентраційним.
Рис. 4.6. Схема конце-нтраційного елемента. Для схематичного запису елемента слід дотримуватися відповідних умов. Наприклад, елемент Якобі-Даніеля схематично записується так: усі електрохімічні елементи записуються за правилом “правого плюса”, тобто зліва знаходиться негативний електрод, справа – позитивний. Іноді полярність електрода додатково записують у дужках. Електроди позначають хімічними символами, межу між електродом і розчином – вертикальною рискою, або, якщо дифузний потенціал не усунутий, штрихом. Отже, елемент Якобі-Даніеля записується так: (–)Cu|Zn|ZnSO4||CuSO4|Cu(+), eк e– eд=0 e+ де: eк – контактний потенціал; e– і e+ – електродні потенціали; eд – дифузний потенціал. Важлива кількісна характеристика електрохімічного елемента – електрорушійна сила (е.р.с., або Е), яка дорівнює різниці електродних потенціалів: Е = е+–е–, (4.22) де: Е – е.р.с. елемента; е+ і е– – потенціали позитивного та негативного електродів. Електрорушійна сила гальванічного елемента є величина позитивна, бо вона завжди відповідає процесу, що відбувається самочинно, і дає позитивну роботу. Щоб електрорушійна сила завжди була позитивною, необхідно від потенціалу позитивного електрода віднімати потенціал негативного. Якщо використати рівняння (4.20) і (4.22) можна знайти величину електрорушійної сили мідноцинкового елемента при 298 K:
Різницю нормальних електродних потенціалів називають стандартною електрорушійною силою і позначають Е0, тому наведене вище рівняння можна записати так:
Електрорушійну силу будь-якого електрохімічного елемента можна обчислити, користуючись рівнянням (4.22). Для елемента Якобі-Даніеля Е0 = +0,34·В–(–0,76)·В = 1,10·В (за стандартних умов). Найбільше застосування у практиці знайшов компенсаційний метод вимірювання е.р.с. Він грунтується на включенні у зовнішнє коло джерела струму, який може урівноважити (скомплексувати) е.р.с. досліджуваного елемента.
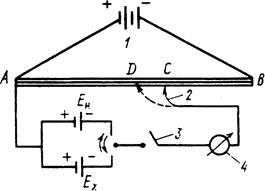
Рис. 4.7. Компенсаційна схема виміру е.р.с.: 1 – акумулятор; 2 – рухомий контакт4 3 – перемикач струму; 4 – гальванометр. Принципова компенсаційна схема вимірювання е.р.с. подана на рис. 4.7. Від акумулятора 1 на реохорд АВ з великим опором подається напруга (2-4 В). Рухливий контакт 2 дозволяє брати від акумулятора різні значення напруг. За допомогою перемикача струму у коло підключають нормальний елемент Вестона з відомим значенням е.р.с. (Ен = 1,018 В при 298 K) так, щоб струм від елемента Вестона прямував назустріч струму акумулятора, тобто однойменними полюсами. Пересуваючи контакт 2 реохорда АВ, знаходять таке положення, при якому спад напруги на ділянці АС дорівнює е.р.с. елемента Вестона (Ен). При цьому стрілка гальванометра 4 не повинна відхилятися від нуля. При такому стані струм у колі не протікає, як і при розімкнутих електродах. Однак, при розімкнутих електродах система далека від рівноваги, у наведеному ж стані елемент перебуває у рівновазі внаслідок рівності напруги акумулятора протилежно направленому спаду напруги на ділянці АС. У стані рівноваги спад напруги на ділянці АС дорівнює е.р.с. елемента Вестона. Це дозволяє визначити ціну поділок реохорда: Ен/АС (В/м). За допомогою перемикача 3 замість елемента Вестона підключають аналогічно досліджуваний елемент, е.р.с. якого (Ех) необхідно виміряти. Рухомим контактом 2 знаходять положення, при якому спад напруги на ділянці АD дорівнює Ех. При цьому стрілка гальванометра також не повинна відхилятися від нуля. У такому стані елемент перебуває у рівновазі через рівність напруги акумулятора протилежно направленому спаду напруги на ділянці АD. Такий стан рівноваги можна виразити відношенням:
Компенсаційна схема виміру е.р.с. лежить в основі високоомних потенціометрів. Для виміру е.р.с. елементів, у яких один із електродів є скляний, використовують електронні потенціометри, які одержали назву рН-метрів.
Рис. 4.8. Схема елемента Вестона (ртутнокадмієвий): 1 – повітря; 2 – кристали СdSO4; 3 – паста Hg2SO4+CdSO4; 4 – амальгама кадмію (Hg0Cd). Елемент Вестона (–)(Hg)Cd|CdSO4 На негативному і позитивному електродах відбуваються реакції: Cd0 ⇄ Cd2++2e– i Hg22++2e– ⇄ 2Hg0. Сумарний потенціаловизначальний процес в елементі Вестона виражається рівнянням: Hg2SO4+Cd ⇄ CdSO4+2Hg Оскільки ртуть є у контакті зі своєю важкорозчинною сіллю Hg2SO4 (L = [Hg22+]2[SO42–] = 6,3·10–7), а кадмій – з кристалами CdSO4 §6. Стандартні електроди. Якщо виготовити електрод із відповідного металу і розчину його солі відомої концентрації, то його потенціал буде мати визначену сталу величину. Такий напівелемент може служити стандартом для порівняння з ним інших електродів з невідомими потенціалами. Стрибок потенціалу на межі метал- розчин, як і різницю потенціалів між двома точками, які перебувають у різних фазах, експериментально виміряти неможливо. Виміряти можна лише е.р.с. електрохімічного елемента, тобто різницю потенціалів. Отже, дослідним шляхом вимірюють е.р.с. кола, що складається із даного електрода та якогось стандартного електрода, потенціал якого умовно приймають рівним нулю. Таким електродом прийнято вважати нормальний, або стандартний водневий електрод (рис. 4.9).
Рис. 4.9. Водневий електрод: 1 – посу-дина; 2 – платинова пластинка; 3 – скляна трубка; 4 – крани; 5 – сифон сполучення з другим електродом. Стандартний водневий електрод – це платинова пластинка, занурена у розчин сульфатної кислоти з активністю йонів Н+, що дорівнює одиниці при температурі 298 K. Платинова пластинка насичується воднем під тиском 1 атм (101,325 кПа). Схематично стандартний водневий електрод записується так: Pt,H2│2H+ ( На електроді відбувається реакція: 2Н3О++2е– ⇄ Н2+2Н2О. Рівняння Нернста для потенціалу водневого електрода при 298ºК і еводн = еº+0,059lgа Вважаючи, що еºводн = 0,000 (таблиця нормальних електродних потенціалів), кінцеве рівняння набуде вигляду: еводн = 0,059lgа Для визначення стандартних електродних потенціалів складають таке гальванічне коло: Pt,H2│2Н3О+║Меn+│Me, а Е.р.с цього кола
Оскільки еºводн = 0, то
§7. Класифікація електродів. В електрохімії, залежно від типу оборотності, застосовують електроди кількох груп. Електроди першого роду. До цього типу належать електроди, які складаються з металевої пластини, зануреної в розчин власних солей. Електроди першого роду оборотні відносно катіона або аніона і двофазні. Напариклад, Zn|Zn2+, Cu|Cu2+. Електродні реакції в таких напівелементах відповідають реакціям окиснення, якщо в гальванічному колі електрод негативний: Ме → Меn++nе–, або реакціям відновлення, якщо електрод позитивний: Меn++nе– → Ме. Отже, на електродах першого роду відбувається процес переходу катіонів з металу в розчин або з розчину на метал, тобто ці електроди оборотні відносно катіона. Рівняння для потенціалу електрода першого роду має вигляд:
Електроди другого роду. Такі електроди побудовані з металу, покритого його важкорозчинною сіллю (або оксидом чи гідроксидом) і зануреного в розчин добре розчинної сполуки з тим же аніоном. Схематично ці електроди зображаються так: Ме|МеА,Аn–. Наприклад, Ag|AgCl, KCl чи Hg|Hg2Cl2, KCl. Електроди другого роду оборотні відносно як катіона, так і аніона, однак можна змінювати концентрацію тільки аніона і тільки таким чином впливати на величину потенціалів електродів другого роду. Рівняння Нернста для потенціалу електродів другого роду має вигляд:
Окиснювально-відновні електроди. Це інертні металічні провідники, занурені у розчин йонів одної речовини, але різних валентностей Pt|Sn2+,Sn4+; Pt|Fe2+,Fe3+; Pt|гідрохінон,хінон. Хоча в основі всіх електродних реакцій є окисно-відновний процес, однак у електрохімії окиснювально-відновними прийнято називати такі електроди, метал яких не бере участі у цих реакціях, а є тільки носієм електронів. Процес же окиснення-відновлення відбувається між речовинами, що знаходяться у розчині, в який занурено даний електрод. Отже, до окиснювально-відновних процесів, або редокс-електродів, належать напівелементи, які складаються з інертного металу (золото, платина), зануреного в розчин, у якому містяться окиснена та відновлена форма однієї і тієї ж речовини. Наприклад: Pt|Fe2+,Fe3+. Електродну реакцію можна записати так: Fe3++е– → Fe2+. Йони Fe3+ відновлюються до Fe2+ за рахунок електронів, одержаних від платини. Атоми самої платини не беруть участі в електродному процесі, вони є тільки носіями електронів. У результаті цього процесу електрод отримує позитивний заряд і притягує аніони з розчину. На поверхні електрода утворюється подвійний електричний шар з певним стрибком потенціалу. Величина цього електродного потенціалу залежить від активності йонів Fe2+ і Fe3+. При надлишку відновленої форми (Fe2+) йде процес її окиснення, причому електрод набуває негативного заряду. В результаті реакція зміщується у той чи інший бік до втановлення динамічної рівноваги. При цьому електрод набуває так званого редокс-потенціалу, величина якого визначається рівнянням Нернста (4.19):
де: е0 – нормальний редокс-потенціал; αOx – активність окисненої форми речовини; αRed – активність відновленої форми речовини. Для порівняння різних редокс-систем введено поняття про нормальний редокс-потенціал е0, який виникає на електроді, зануреному в систему, що містить рівні концентрації окисненої і відновленої форми речовини (табл. 4.6). Таблиця 4.6. Нормальні редокс-потенціали деяких систем у водних розчинах при 25ºС (298 K). Редокс-системи e0, в Cr3++e ↔ Cr2+ Те3++е ↔ Те2+ 2H++2e ↔ H2 Cu2++e ↔ Cu+ Хінон+2е ↔ гідрохінон Fe3++e ↔ Fe2+ Hg2++e ↔ Hg+ Со3++е ↔ Со2+ –0,41 –0,37 +0,167 +0,6994 +0,771 +0,901 +1,84
Біологічне значення редокс-потенціалів. Окиснювально-відновні потенціали мають велике значення у фізіології людини і тварин. До числа редокс-системи належать такі системи крові і тканини, як гем/гематин і цитохроми, у яких міститься дво- і тривалентне залізо; аскорбінова кислота (вітаміни С), яка є в окисненій і відновленій формах; система глутатіону, цистин-цистеїну, бурштинової і фумарової кислот та ін. Важливий процес біологічного окиснення, а саме перенесення електронів і протонів від субстрату на кисень, здійснюваний в тканинах за допомогою чітко визначеного ряду проміжних ферментів-носіїв, також є ланцюгом окиснювально-відновних процесів. Кожна ланка цього ланцюга відповідає тій чи іншій редокс-системі, яка характеризується відповідним редокс-потенціалом:
Оксидація субстрату ↓ (–0,42 в) Дегідрогеназа ↓ (–0,32 в) Флавіновий фермент ↓ (–0,006 в) Цитохроми ↓ (від +0,04 до +0,55 в) ½О2 ↓ (+0,82 в)
Флавіновий фермент має нормальний потенціал –0,06 в (білок, що входить до складу фермента, підвищує потенціал активної небілкової частини фермента від –0,208 до –0,06 в). Цей фермент може відновлювати редокс-системи тільки з вищими потенціалами, зокрема цитохроми, а окиснювати системи з вищими потенціалами (у наведеній схемі – дегідрогеназа). Ця обставина пояснює однобічну направленість перенесення електронів і протонів (зверху вниз у схемі). У випадку зворотного процесу повинно було би відбуватися проходження відновлюваної системи з нижчим потенціалом. А це суперечить викладеній теорії. Крім того, чітка послідовність ферментів у ланцюгу окиснення викликає різку різницю між потенціалами двох взаємодіючих систем, а це обумовлює поступове виділення енергії окиснення. Вказані особливості біологічного окиснення дозволяють організму повніше регулювати одержання і використання енергії. Найширше застосування серед електродів другого роду мають хлорсрібний та каломельний. Хлорсрібний електрод містить срібну дротину або пластину з нанесеним на неї шаром аргентум хлориду, занурену в розчин КCl:
|
||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 8; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.239.135 (0.013 с.) |

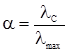 , (4.12)
, (4.12)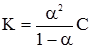 ввести
ввести 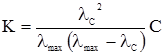 . (4.13)
. (4.13)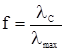 (4.14).
(4.14).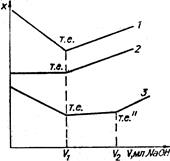
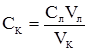 ,
,
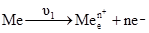
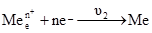 .
.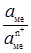 ), (4.15)
), (4.15)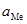 – активність металу;
– активність металу; 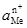 – активність йонів металу в розчині.
– активність йонів металу в розчині.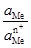 ). (4.17)
). (4.17)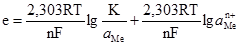 . (4.18)
. (4.18)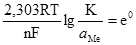 .
.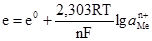 . (4.19)
. (4.19)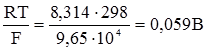 ;
;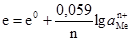 . (4.20)
. (4.20)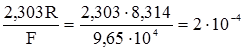 ,
,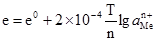 . (4.21)
. (4.21)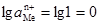 , тобто другий член правої частини рівняння перетворюється на нуль, тоді е = е0. Отже е0 – це електродний потенціал, який виникає при зануренні металу в розчин, у якому активність йонів цього металу дорівнює 1 кмоль/м3. Ця величина названа нормальним (або стандартним) електродним потенціалом. Значення нормальних електродних потенціалів наведені в табл. 4.5.
, тобто другий член правої частини рівняння перетворюється на нуль, тоді е = е0. Отже е0 – це електродний потенціал, який виникає при зануренні металу в розчин, у якому активність йонів цього металу дорівнює 1 кмоль/м3. Ця величина названа нормальним (або стандартним) електродним потенціалом. Значення нормальних електродних потенціалів наведені в табл. 4.5.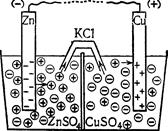
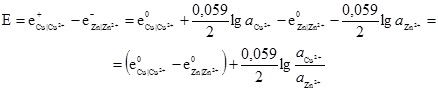 .
.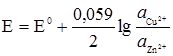 .
.
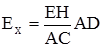 . (4.23)
. (4.23)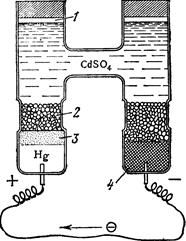
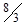 H2O, CdSO4(насич)|Hg2SO4|Hg(+) (рис. 4.8) являє собою гальванічний елемент з точно відомим значенням е.р.с. Ен = 1,018 В при 25°С. Негативний електрод складається із амальгами кадмію (розчин кадмію у ртуті), розміщеної у насиченому розчині CdSO4, у якому містяться кристалогідрати CdSO4
H2O, CdSO4(насич)|Hg2SO4|Hg(+) (рис. 4.8) являє собою гальванічний елемент з точно відомим значенням е.р.с. Ен = 1,018 В при 25°С. Негативний електрод складається із амальгами кадмію (розчин кадмію у ртуті), розміщеної у насиченому розчині CdSO4, у якому містяться кристалогідрати CdSO4 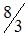 Н2О. Позитивним електродом є ртутносульфатний, побудований із ртуті, пасти HgSO4+CdSO4, над якою є кристали CdSO4
Н2О. Позитивним електродом є ртутносульфатний, побудований із ртуті, пасти HgSO4+CdSO4, над якою є кристали CdSO4 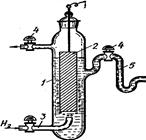
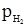 = 101,3 кПа; ан+ = 1 моль/л).
= 101,3 кПа; ан+ = 1 моль/л).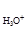 . (4.24)
. (4.24)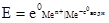 ,
,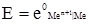 .
.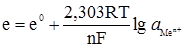 . (4.26)
. (4.26)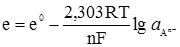 . (4.27)
. (4.27)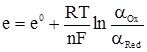 , (4.28)
, (4.28)


