
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Константи дисоціації слабких кислот і основ, при 293 K.Содержание книги
Поиск на нашем сайте
рH Середовище кисле слабкокисле нейтральне слабколужне лужне
У біологічних, медичних, клінічних дослідженнях необхідно чітко розрізняти загальну, потенційну та активну кислотність: а) загальна, або аналітична, кислотність відповідає загальній концентрації кислоти; б) активна кислотність відповідає концентрації вільних гідратованих гідроген-йонів; в) потенційна кислотність відповідає концентрації нейонізованих молекул кислоти і може бути вирахувана, як різниця між загальною і активною кислотністю. Концентрація гідроген-йонів в розчині слабкої кислоти набагато менша за загальну концентрацію кислоти, оскільки більшість молекул слабкої кислоти перебуває у недисоційованому стані: СН3СООН+Н2О ⇄ СН3СОО–+Н3О+ потенційна активна загальна кислотність Поряд з розчинами слабких кислот у рідинах слабких основ розрізняють загальну, активну та потенційну лужність. У випадку розчинів сильних кислот (основ) внаслідок повної йонізації молекул активна кислотність (лужність) дорівнює загальній. Але для деяких біологічних рідин, наприклад, шлункового соку, який представлений кислотами різної сили, при визначенні активної кислотності (вимірюванням рН) і загальної кислотності (титруванням) результати будуть неоднакові. Навіть однакові концентрації кислот чи основ мають різну активну кислотність (основність). Так, 0,1 М розчини хлоридної і ацетатної кислот, маючи однакову загальну кислотність, водночас мають різні значення рН (для HCl рН = 1,02, для СН3СООН рН = 2,89). Один з давніх способів визначення рН ґрунтується на властивості деяких речовин, що називаються індикаторами, змінювати своє забарвлення залежно від ступеня активної кислотності або лужності. Кожен індикатор характеризується інтервалом переходу забарвлення. Інтервал переходу забарвлення індикатора – зона між двома значеннями рН, в якій відбувається помітна для ока зміна кольору індикатора. Так, фенолфталеїн змінює своє забарвлення від безбарвного до малинового в межах рН 8,0-9,6, метиловий оранжевий – у межах 3,1-4,4. Метод визначення концентрації гідроген-йонів або гідроксид-йонів, що ґрунтується на зміні забарвлення індикаторів, називають колориметричним (від. лат. color – колір і грецьк. metrio – виміряю, визначаю). Застосовують і універсальні індикатори, за зміною забарвлення яких одразу визначають рН середовища. Універсальні індикатори – це суміші звичайних індикаторів. Наприклад, для приготування універсального індикатора, що змінює забарвлення в межах рН від 2 до 10, використовують суміш диметиламіноазобензолу, бромтимолового синього, метилового червоного, фенолфталеїну і тимолфталеїну. Звичайні й універсальні індикатори можуть використовуватися у вигляді розчинів або у вигляді індикаторних папірців.
Теоретичною основою застосування колориметричного методу є закон Ламберта-Бера (1760): для двох розчинів, однаково поглинаючих світло, добуток їх концентрації С на товщину шару розчину h є величиною сталою: C1h1 = C2h2 = const. (3.60) Із цього закону випливає, що при рівному поглинанні світла двома розчинами, із яких концентрація одного відома (стандартного), концентрація другого розчину буде такою ж. При колориметричному методі визначення рН користуються приладом Міхаеліса. Прилад містить набір запаяних пробірок – еталонів з відповідним забарвленням розчинів з відомими значеннями рН. До приладу додається набір індикаторів, якими можна визначати рН досліджуваних розчинів. У пробірку наливають досліджуваний розчин і вносять вибраний індикатор. Після цього пробірку поміщають у компаратор і за інтенсивністю забарвлення підбирають відповідний еталон.
Рис. 3.7. pН-метр. Точнішим є електрометричний метод визначення рН, в основі якого лежить вимірювання електрорушійної сили (е.р.с.), яка виникає в результаті різниці потенціалів двох електродів – індикаторного і електрода порівняння (стандартного). Потенціал індикаторного електрода залежить від концентрації [Н3О+] у досліджуваному розчині. Для визначення рН використовують спеціальні потенціометри і рН-метри (рис. 3.7). Водневий показник (рН) використовують при біохімічних дослідженнях, а також у клінічній практиці для характеристики кислотно-основних властивостей різних біологічних середовищ.
Таблиця 3.8. Значення рН фізіологічних рідин. Рідини (свині) Ймовірне значення рН Можливі коливання Кров (плазма) Шлунковий сік (пристінковий)
Панкреатичний сік Кишковий сік Сеча Слина Піт Міхурцева жовч Печінкова жовч 7,36 1,05 7,5 6,51 5,80 6,4 5,4 6,2 7,8 7,35-7,45 0,90-1,50 7,00-8,00 5,07-7,07 5,00-6,50 6,20-7,00 4,5-7,5 5,6-7,2 7,4-8,0
Йонам гідрогену і гідроксильним йонам належить особливе місце серед інших йонів завдяки різко вираженому впливові їх на фізико-хімічні властивості речовин і перебіг багатьох хімічних реакцій. Багато процесів у живих організмах відбувається при певному значенні рН. Наприклад, шлунковий сік людини має рН 1,0-1,5. Усі ферментні процеси відбуваються при певних значеннях рН. Так, цукраза дріжджів проявляє максимум дії при рН 5, амілаза слини – при рН 6,8. З наведених прикладів видно, що рН внутрішніх середовищ організму, які є водними розчинами, впливає на життєдіяльність клітин, тканин, органів і організму в цілому. Значення рН біологічних рідин регулюється фізіологічними механізмами і буферними системами. §11. Буферні розчини, склад, механізм дії, значення для живих організмів. Однією з характерних властивостей внутрішнього середовища організму є сталість концентрації йонів гідрогену (ізогідрія). Так, наприклад, рН крові 7,36. Збереження цього показника забезпечується спільними діями цілого ряду фізико-хімічних і фізіологічних механізмів, із яких дуже важлива роль належить буферним системам. Буферними системами називають розчини, які здатні підтримувати сталість концентрації гідроген-йонів. За складом буферні системи (розчини) бувають трьох основних типів: а) системи, що містять слабку кислоту і її сіль; б) слабку основу і її сіль; в) солі багатоосновних слабких кислот. Найбільш поширеними буферними системами, в тому числі і у живих організмах, є такі:
Кожна буферна система характеризується відповідною концентрацією йонів гідрогену [Н+], яку вона старається зберегти при задаванні кислот чи лугів. Наприклад, ацетатна буферна суміш: СН3СООН ⇄ СН3СОО–+Н+; СН3СООNa = СН3СОО–+Na+. Зі схеми видно, що в ацетатному буферному розчині концентрація йонів гідрогену буде залежати від ступеня дисоціації молекул кислоти. Згідно з законом дії мас константа дисоціації ацетатної кислоти буде:
звідси:
При додаванні до слабкої ацетатної кислоти ( СН3СООН ⇄ СН3СОО–+Н+. Отже, слабка дисоціація ацетатної кислоти буде ще більше пригнічена, і практично концентрація недисоційованих молекул СН3СООН може бути прийнята рівною загальній концентрації кислоти. Оскільки сіль повністю дисоціює, можна прийняти загальну концентрацію аніонів рівною загальній концентрації солі у буферному розчині. Виходячи з цього, рівняння (3.62) можна зобразити так:
рН буферного розчину можна розрахувати за рівнянням Гендерсона-Гассельбаха:
Для лужного буфера, яким є, наприклад, аміачний, відповіно буде:
і
Із наведених рівнянь видно, що рН буферних сумішей залежить від константи дисоціації кислоти або основи і від співвідношення концентрацій буферних компонентів. Отже, для приготування буферних сумішей з необхідним значенням рН слід використовувати кислоти або основи з відповідними константами дисоціації та підбирати відповідні співвідношення компонентів (табл. 3.9).
Таблиця 3.9. Буферні системи.
рН буферних систем ацетатна фосфатна амонійна 9:1 8:2 7:3 6:4 5:5 4:6 3:7 2:8 1:9 3,72 4,05 4,27 4,45 4,63 4,80 4,99 5,23 5,57 5,91 6,24 6,47 6,64 6,81 6,98 7,17 7,38 7,73 10,28 9,95 9,73 9,55 9,37 9,20 9,01 8,77 8,43 При однакових співвідношеннях компонентів (наприклад Таблиця 3.10.
|
|||||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 11; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.17.171 (0.012 с.) |


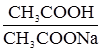 – ацетатна;
– ацетатна; 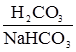 – гідрокарбонатна;
– гідрокарбонатна;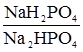 – фосфатна;
– фосфатна; 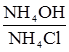 - амоніачна (амонійна);
- амоніачна (амонійна);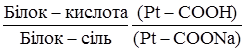 – білкова.
– білкова.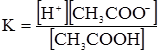 , (3.61)
, (3.61)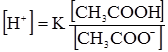 . (3.62)
. (3.62)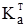 = 1,8·10–5) її солі відбувається різке збільшення концентрації спільного аніона (СН3СОО–). За законом дії мас, це зумовить зміщення рівноваги вліво, тобто призведе до збільшення потенційної кислотності:
= 1,8·10–5) її солі відбувається різке збільшення концентрації спільного аніона (СН3СОО–). За законом дії мас, це зумовить зміщення рівноваги вліво, тобто призведе до збільшення потенційної кислотності: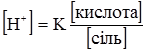 (3.63)
(3.63)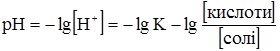 . (3.64)
. (3.64)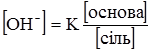
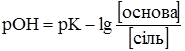 ,
,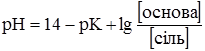 .
.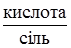 або
або 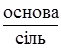
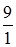 ) в ацетатній, фосфатній або амонійній буферній системі значення рН буде різне, що залежить від різної величини константи дисоціації кислот і основ (табл. 3.10).
) в ацетатній, фосфатній або амонійній буферній системі значення рН буде різне, що залежить від різної величини константи дисоціації кислот і основ (табл. 3.10).


