
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ізоелектричні точки деяких білків.Содержание книги
Поиск на нашем сайте
Гемоглобін 0,3-0,07 - - Яєчний альбумін 2,5 1,5 1,5 Декстрин 20,0 1,25 25,0 Крохмаль картоплі 20,0 - - Сапонін 115,0 35,0 115,0
Найбільша захисна здатність спостерігається у тих випадках, коли частинки золю і ВМС у розчинах мають однакові заряди. Наприклад, два розчини - гідрозоль As2S3 і розчин желатини. Їх частинки у розчинах заряджені негативно. Додавання розчину желатини до гідрозолю підвищує стійкість його до дії електролітів не тільки через адсорбцію його частинками білка, а й внаслідок збільшення негативного заряду частинок дисперсної фази. Колоїдному захисту належить важлива роль у біології, медицині, ветеринарній медицині. Карбонати і фосфати кальцію утримуються у біологічних рідинах в певних концентраціях завдяки захисній дії на їх частинки білкових речовин. Білки плазми крові підвищують розчинність СаСО3 майже у 5 разів і сіль знаходиться у захищеному стані. Поява жовчних і ниркових каменів пов’язана з недостатньою захисною дією муцинів та інших речовин, які синтезуються слизовими оболонками жовчо- і сечовивідних шляхів. Патологічні відкладання деяких речовин у тканинах при подагрі пов’язані з порушенням захисних властивостей білків. При атеросклерозі на стінках кровоносних судин відкладаються стерини, стериди та інші речовини. Наявність у молоці жирних кульок визначається наявністю у них білкових оболонок. Колоїдний захист застосовується для одержання стійких лікарських препаратів (протарголу і коларголу), стабільних розчинів золів благородних металів при виготовленні фотографічних емульсій. В’язкість розчинів ВМС. Розчини високомолекулярних сполук володіють високою в’язкістю, яка обумовлена силами зчеплення між молекулами рідини. Під час протікання рідини крізь трубку різні її шари, розташовуючись концентрично від стінок трубки до її середини, рухаються з різною швидкістю: біля стінок шар молекул нерухомий, наступні шари рухаються все з більшою швидкістю, але постійною для кожного шару. Такий потік називається ламінарним. При збільшенні швидкості шари утворюють завихрення і перемішуються: ламінарний потік переходить у турбулентний. Ламінарний потік характеризується двома законами. Перший (постулат Ньютона) визначає силу в’язкого опору рідини F за рівнянням:
де: η – в’язкість;
де: х – відстань між шрами; υ – відносна швидкість шарів. Другий закон – закон Пуазейля – визначає кількість рідини, що протікає через капіляр:
де: r – радіус капіляра; l – довжина капіляра; р – перепад тиску на кінцях капіляра; τ – час. Ці закони діють тільки при ламінарному потоці рідини і прийняті для чистих рідин, істинних розчинів і деяких колоїдів. У розчинах ВМС виявляється аномальна в’язкість: вона дуже висока і зменшується зі збільшенням тиску на плинну рідину. Висока в’язкість цих розчинів залежить від ступеня спорідненості між молекулами: сили зчеплення гідрофільних молекул білків і полісахаридів з молекулами води дуже високі, і в’язкість їх навіть у сильно розведених розчинах також буде високою. На величину в’язкості впливає форма частинок. Якщо витягнуті частинки розташовуються впоперек потоку, то вони чинять найбільший опір. При збільшенні зовнішнього тиску на рідину ці частинки орієнтуються вздовж потоку, в результаті в’язкість розчину зменшується. Зі збільшенням концентрації в’язкість розчинів ВМС різко зростає, тому що при цьому розчинені частинки структуризуються. Збільшення зовнішнього тиску зумовлює руйнування структур, розчинник вивільнюється, в’язкість зменшується. Коли вся структура руйнується, розчини ВМС підкоряються постулату Ньютона і закону Пуазейля. Тому аномальну в’язкість таких розчинів називають також структурною в’язкістю. Збільшення в’язкості (рис. 8.3), пов’язане зі зміною концентрації при розчиненні полімеру, прийнято характеризувати питомою в’язкістю:
де: ηс – в’язкість розчину; ηо – в’язкість чистого розчинника.
Рис. 8.3. Залежність в’яз-кості від концентрації ко-лоїду: 1 – розчин поліме-ру; 2 – золь. Г.Штаудінгером встановлена залежність питомої в’язкості від молекул одної маси полімеру: ηпит = КМС, (8.7) де: К – константа для певного полімергомологічного ряду речовин; С – концентрація ВМС в розчині; М – її молекулярна маса.
Рівняння (8.7) можна подати як
Величина Межа [η] = КМ.
Рис. 8.4. Залежність При визначенні молекулярної маси полімеру віскозиметричним методом спочатку встановлюють ηс, ŋ0; потім розраховують ηпит і
Характеристична в’язкість [η] розчинів полімерів не залежить від їх концентрації, а визначається тільки природою розчинника та полімеру. Саме тому її використовують для визначення молекулярної маси полімерів. За рівнянням Штаудінгера знаходять молекулярну масу жорстких паличкоподібних макромолекул. Для гнучких глобулярних молекул застосовують рівняння Марка-Куна-Хаувінка:
де α – ступінь згортання та гнучкості ланцюга. Характеристична в’язкість часто виступає як показник, еквівалентний молекулярній масі (табл. 8.2). Значна кількість глобулярних білків має характеристичну в’язкість у межах 3·103 м3/кг.
Таблиця 8.2. Значення молекулярних мас та в’язкостей для біополімерів. Біополімер М [η]·103 м3/кг Форма молекули Рибонуклеаза Сироватковий альбумін Гемоглобін Міозин ДНК 13 683 67 500 64 450 440 000 6 000 000 3,4 3,7 3,6 217,0 5 000 Глобула Глобула Глобула Паличкоподібні Глобула
На в’язкість розчинів білків впливає рН. Найменшу в’язкість розчини білків мають в ізоелектричній точці, оскільки макромолекули згорнуті в клубок і опір течії рідини – найменший. Із збільшенням або зменшенням рН в’язкість розчинів білків зростає у зв’язку зі зміною структури макромолекул. За графіком залежності в’язкості від рН розчинів можна визначити ізоелектричну точку білків.
§3. Поліелектроліти. Особливості розчинів білків. Поліелектролітами називають ВМС, які містять йоногенні групи. За характером утворюваних йонів поліелектроліти поділяють на три групи. 1. Поліелектроліти кислотного типу, що містять групи -СОО– (розчинний крохмаль, гуміарабік), або – OSO3– (агар-агар). 2. Поліелектроліти основного типу, які містять, наприклад, групу -NH3+. Такі полімери одержують синтетичним шляхом. 3. Поліамфоліти – ВМС, які містять і кислотні і основні групи (білки з групами –СОО– і –NH3+). Білки побудовані із залишків амінокислот, сполучених між собою пептидними зв’язками. Амінокислоти є амфотерними електролітами, молекули яких містять карбоксильну (-СООН) і амінну (-NH2) групи. До складу білків входить в основному 20 амінокислот. Схематично молекулу білка можна зобразити як NH2-R-СООН, де R – залишок молекули білка без функціональних груп. Цей залишок виникає внаслідок взаємодії сотень тисяч амінокислот: NH2-R'-СООН+NH2-R''-COOH+NH2-R'''-COOH → NH2-R'-CО-NH-R''-CО-NH-R’’’-COOH + 2HOH. Молекулярна маса білків коливається від декількох тисяч (47 000 – інсулін) до сотень мільйонів (322 000 000 – білок вірусу грипу). В молекулі білка є один або декілька поліпетидних спіралізованих ланцюгів. Розрізняють чотири рівні структурної організації молекули білка – первинний, вторинний, третинний і четвертинний. Є дві основні просторові форми молекули білка – глобулярна і фібрилярна. У фібрилярних молекул довжина макромолекули у тисячі разів перевищує товщину. Так, довжина молекули проколагену – 300 нм, ширина – десяті частки нанометра, тоді як довжина молекул глобулярних білків ≈ 30 нм, ширина ≈ 20-30 нм.
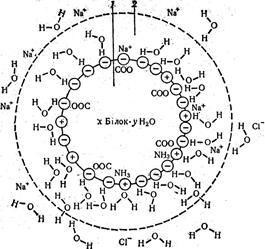
Поверхня молекули білка містить велику кількість гідрофільних груп, які утворюють гідратну оболонку (рис. 8.5). Гідрофобні частини молекули в основному розміщені всередині. При формуванні молекули білка деяка частина молекул води утягується всередину її і складає інтерміцельну воду. Будучи амфолітами, білки у водному середовищі проявляють кислотні:
і основні властивості: H2N-R-COOH+НОН ↔ H3+N-R-CООН+OН–.
Рис. 8.5. Схема будови молекули білка у водному розчині, стабілізованому розчи-ном NaCl (за Мусілу,Новаковою, Кунцу): 1 – молекула білка; 2 – гідратна оболонка Ці властивості проявляються при взаємодії білка з кислотами і основами. Якщо до розчину білка додати розчин сильної кислоти, то дисоціація карбоксильних груп (слабша кислота) буде зменшуватися і макромолекула набуде позитивного заряду: H2N-R-COOH+Н++Cl– ↔ H3+N-R-CООН+Cl. Якщо в розчин білка додати основу, то білок проявлятиме властивості кислоти: H2N-R-COOH+Nа++ОН– ↔ H2N-R-CОО–+Na++Н2О. Ізоелектрична точка білків. Заряд білкової молекули у нейтральному середовищі визначає співвідношення кількості вільних -СООН і -NН2 груп та ступінь дисоціації їх. Чим більше карбоксильних груп -СООН, тим вищий негативний заряд, і білок буде проявляти властивості слабкої кислоти. Перевага амінних груп надає білку основних властивостей і позитивного заряду.
У кислому середовищі білок заряджається позитивно:
У лужному середовищі – негативно:
Таким чином, заряд білка залежить від реакції середовища і від співвідношення кількості карбоксильних і амінних груп та їх ступеня дисоціації. Значення рН, при якому білок знаходиться в ізоелектричному стані, тобто у такому стані, при якому число різнойменних зарядів у білковій частинці однакове і її загальний заряд дорівнює нулю, називається ізоелектричною точкою цього білка. Більшість білків містить 25-30% дикарбонових амінокислот (глутамінової і аспрагінової) і, звичайно, належать до кислих білків. Існує невелика група основних білків, з домінуванням вільних -NН2 груп за рахунок підвищеного (до 80%) вмісту диамінових амінокислот (аргініну, лізину, орнітину, цитруліну). Ізоелектрична точка кислих білків лежить у слабокислому, основних – у слаболужному середовищі (табл. 8.3).
Висолювання або драгління білків найкраще проводити в ізоелектричному стані, тому що у ізоелектричній точці білки мають інші властивості, ніж у звичайних умовах. В умовах ізоелектричного стану білки не володіють електрофоретичною рухливістю, характеризуються мінімальною стійкістю, розчинністю, гідратацією, в’язкістю, осмотичним тиском, електропровідністю, ступенем набрякання. Таблиця 8.3. Білки Ізоелектрична точка
|
||||||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 10; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.172.149 (0.012 с.) |

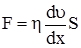 , (8.4)
, (8.4)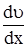 – градієнт швидкості потоку; dυ – різниця швидкостей двох сусідніх шарів; dx – віддаль між шарами; S – площа контакту шарів. Із рівняння (8.4) можна визначити розмірність в’язкості (у системі СІ):
– градієнт швидкості потоку; dυ – різниця швидкостей двох сусідніх шарів; dx – віддаль між шарами; S – площа контакту шарів. Із рівняння (8.4) можна визначити розмірність в’язкості (у системі СІ):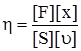 ;
; 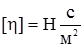 , або Па´с,
, або Па´с,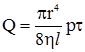 , (8.5)
, (8.5)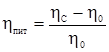 , (8.6)
, (8.6)
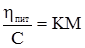 .
.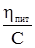 одержала назву приведеної в’язкості.
одержала назву приведеної в’язкості.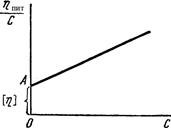
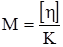 .
.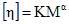 ,
,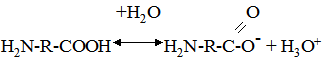
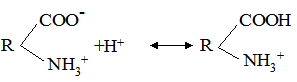 .
.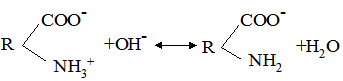 .
.


