Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ag|AgCl,KCl.. Дифузні потенціали в розчинахСодержание книги
Поиск на нашем сайте
Ag|AgCl,KCl. Аргентум хлорид у незначній кількості розчиняється у воді і дисоціює з утворенням йонів Ag+ і Cl–: AgCl ↔Ag++Cl–. Цей процес є потенціалвизначальним. У присутності KCl розчинність аргентум хлориду зменшується. Отже при заданій концентрації калій хлориду і температурі концентрація йонів Ag+ постійна, чим і забезпечується необхідна постійність хлорсрібного електрода. На електроді встановлюється рівновага: AgCl+e ↔ Ag+Cl–. Потенціал хлорсрібного електрода виникає на поверхні зіткнення срібної пластинки з розчином йонів срібла і може бути виражений таким рівнянням:
Через малу здатність срібла переходити у розчин потенціал має позитивний заряд відносно потенціалу нормального водневого електрода. Аргентум хлорид погано розчинний у воді. При 298 K його добуток розчинності становитиме: ДР = [Ag+][Cl–] = 1,7·10–10 моль2/л2. (4.30) При постійній температурі добуток розчинності є сталою величиною, тому збільшення концентрації йонів хлору впливає на концентрацію Ag+ і відповідно на величину потенціалу хлорсрібного електрода. Із рівняння (4.30) випливає, що:
Якщо підставити цей вираз у рівняння (4.29), то
або
Об’єднавши сталі при даній температурі величини exc0 та
тоді при температурі 298К exc = excº–0,059lg[Cl–]. Каломельний електрод складається з ртуті, покритого шаром погано розчинної у воді каломелі (Hg2Cl2). Ця система є у контакті з розчином калій хлориду певної концентрації: Hg|Hg2Cl2,KCl. На електроді відбувається процес: Hg2Cl2+2е ↔ 2Hg+2Cl–. Потенціал каломельного електрода залежить тільки від активності хлорид-йонів у розчині:
Каломельний електрод при даній концентрації йонів хлору (тобто концентрації KCl) має цілком певний потенціал і може використовуватися як електрод порівняння. Так, у насиченому розчині КCl потенціал хлорсрібного електрода дорівнює +0,222 В, а каломельного +0,248 В.
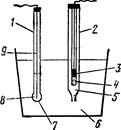
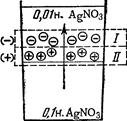
Рис. 4.10. Загальна схема ланцюга включення скляного і каломельного електродів: 1 – скляний електрод; 2 – каломельний електрод; 3 – ртуть; 4 – паста Hg2Cl2; 5 – насиче-ний розчин KCl; 6 – досліджуваний розчин; 7 – скляна мембрана; 8 – HCl; 9 – внутрішній електрод. §8. Індикаторні електроди. Як індикаторні електроди використовують скляні електроди, які у практичному відношенні є найбільш зручними. Скляний електрод складається з скляної трубочки з видутою на одному кінці кулькою товщиною близько 0,01 мм. Трубочку заповнюють розчином зі сталим рН (наприклад 0,1 М КСl) і вводять допоміжний (його називають ще внутрішнім електродом) хлорсрібний електрод (рис. 4.10). Принцип роботи скляного електрода можна пояснити, наприклад, на основі йонообмінної теорії Б.Нікольського: між поверхневим шаром мембрани і розчином, в який занурюється електрод, проходить обмін йонами. Скло віддає катіони Na+, одержуючи натомість Н+, в результаті встановлюється рівновага, що визначається концентрацією цих йонів у склі і розчині та коефіцієнтом їх розподілу у цих двох фазах. У кислих розчинах йони Nа+ в склі майже повністю витісняються йонами Н+ і скляний електрод працює подібно водневому електроду. У лужних розчинах, навпаки, у склі переважають йони Na+, електрод діє як натрієвий. Таким чином, на межі розділу скляна мембрана – досліджуваний розчин виникає потенціал, величина якого залежить від концентрації водневих йонів (і, отже, рН) в розчині. Цей потенціал можна віднести до міжфазових потенціалів. Потенціал на скляній мембрані електрода швидко встановлюється і не залежить від присутності окиснювачів і відновників, солей та ін. Скляним електродом можна користуватися у великому інтервалі значень рН від –2 до 12. Властивість мембран у різних, навіть однотипних, скляних електродів неоднакові, тому перед роботою їх необхідно калібрувати за розчинами з точно відомим значенням рН. §9. Електрометричне визначення рН розчинів. Дифузійний і мембранний потенціали і їх біологічне значення. Визначення рН розчину електрометрією зводиться до встановлення потенціалу електрода визначення, зануреного в досліджуваний розчин, і грунтується на залежності величини потенціалу ех від рН. Величину ех визначають за е.р.с. ланцюга, складено із електрода з відомим потенціалом – електрода порівняння (наприклад, хлорсрібного, каломельного, нормального водневого) і електрода визначення. Електрометричне визначення рН особливо зручне для дослідження біологічних рідин та каламутних і забарвлених розчинів. При стиканні розчинів різних концентрацій розчинена речовина дифундує в розчин з меншою концентрацією. Якщо йони електроліту володіють різною швидкістю дифузії, то стають попереду менш рухливих. Утворюються ніби дві хвилі різнозаряджених йонів. У результаті цього менш концентрований розчин набуває потенціалу зі знаком заряду “швидких” йонів, а більш концентрований – потенціалу зі знаком заряду “повільних” йонів (рис. 4.11). На межі поділу розчинів виникає так званий дифузний потенціал, який гальмує “швидкі” і прискорює “повільні” йони.
Рис. 4.11. Виникнення ди-фузного потенціалу внаслідок різної швидкості руху йонів. І – “швидкі” йони, за-ряджені негативно; ІІ – “по-вільні” йони, заряджені по-зитивно. У гальванічних елементах на межі розчинів можуть виникати дифузні потенціали. Для зменшення помилки при вимірюванні е.р.с. елемента, пов’язаного з виникненням дифузного потенціалу, електроди сполучають містком із агар-агару, насиченого КСl. Йони калію і хлору мають майже однакові рухливості, тому їх використання вирівнює швидкість руху різнойменних йонів. Шкідливий вплив дифузійного потенціалу на е.р.с. елемента при цьому значно зменшується (табл. 4.7). Дифузні потенціали виникають і в біологічних об’єктах: при пошкодженні поверхневого шару клітин порушується вибірковість їх проникності і електроліти дифундують в клітину або з неї залежно від різниці концентрацій. При цьому виникає потенціал пошкодження, дифузійний по суті. Величина його може досягати 30-40 В. Поступово, по завершенні процесу дифузії, потенціал знижується до нуля. Як правило, пошкоджена тканина заряджається негативно стосовно непошкодженної.
Таблиця 4.7.
|
||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 6; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.57.186 (0.005 с.) |

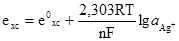 . (4.29)
. (4.29)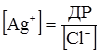 . (4.31)
. (4.31)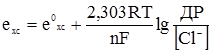 (4.32)
(4.32)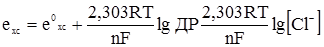 . (4.33)
. (4.33)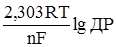 в одну і позначивши через e0, одержимо рівняння потенціалу хлорсрібного електрода:
в одну і позначивши через e0, одержимо рівняння потенціалу хлорсрібного електрода: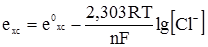 , (4.34)
, (4.34)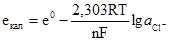 . (4.35)
. (4.35)