
Содержание книги
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Наближені значення коефіцієнтів активності різно заряджених йонів у водному середовищі.
Наближені значення коефіцієнтів активності різно заряджених йонів у водному середовищі. Йонна сила розчину, І Коефіцієнт активності Однозарядні йони Двозарядні йони Тризарядні йони 1,00 1,00 1,00 0,001 0,97 0,87 0,73 0,002 0,95 0,82 0,64 0,005 0,93 0,74 0,51 0,01 0,90 0,66 0,39 0,05 0,81 0,44 0,15 0,1 0,76 0,33 0,08
Йонна сила розчину – це величина, яка характеризує силу електростатичної взаємодії йонів у розчині електроліту. Вона не залежить від природи електроліту, а визначається концентрацією йонів і їх зарядом і дорівнює півсумі добутків концентрацій всіх йонів на квадрат їх валентностей: де С1, С2, С3 – молярні концентрації різних йонів в розчині; z1, z2, z3 – заряди відповідних йонів. При визначенні йонної сили необхідно користуватися істинною йонною концентрацією. У випадку слабкого електроліту ця величина одержується шляхом множення його концентрації на ступінь дисоціації. Йонна сила розчину недисоційованих молекул приймається рівною нулю. Про фізичний зміст йонної сили див. §13. §10. Дисоціація води. Йонний добуток води. Водневий і гідроксильний показники. Виступаючи як універсальний розчинник, вода є основою рідин живої природи. Організм тварини містить 65,9% води, жива клітина – 85%. За теорією Бренстеда, вода є амфолітом: Н2О ⇄ Н++ОН– та Н2О+Н+ ⇄ Н3О+. Така реакція називається автопротолізом води: Н2О+Н2О ⇄ Н3О++ОН–, або 2Н2О ⇄ Н3О++ОН–. Кількісно автопротоліз води характеризується йонним добутком води. Константа рівноваги при 298К:
Оскільки ступінь електролітичної дисоціації води дуже низький (дисоціює 1 на 550 млн. молекул), то можна вважати її концентрацію постійною і рівною масі 1 л води при 25ºС (998,07 г), поділеного на її молярну масу:
Виходячи з (3.53):
де Кw – йонний добуток води. Згідно з (3.54), [Н3О+] = [ОН–] = 10–7 кмоль/м3. Якщо водний розчин має нейтральну реакцію, то це означає, що у ньому концентрації Н3О+ і гідроксид-йонів є однакові і рівні [Н3О+] = [ОН–] = 10–7 (при 298 K).
У кислих розчинах [Н3О+]>10–7 кмоль/м3, у лужних [Н3О+]<10–7 кмоль/м3. Розрахунок концентрації гідроген-йонів Н3О+ і гідроксил-йонів за допомогою йонного добутку води проводять, виходячи з постійного значення: Кw = [Н3О+][ОН–] = 1,00·10–14 (кмоль/м3)2. (3.55) При будь-яких змінах молярних концентрацій гідроген-йонів[Н3О+] і гідроксид-йонів добуток їх концентрацій при постійній температурі залишається незмінним. Наприклад, якщо до чистої води додати HCl, концентрація якої рівна 0,001 М, то відповідно до (3.40):
Якщо до чистої води додати лугу, з концентрацією 0,02 М, то концентрація йонів Н3О+ становитиме:
Слід зазначити, що характеризувати кислотність або основність розчину числами з від’ємними показниками ступеня незручно. Тому кислотність розчинів виражають не концентрацією йонів [Н3О+], а її від’ємним десятковим логарифмом. Цю величину називають водневим показником йонів Гідрогену і позначають через рН: рН = –lg[H3O+]. Показник рН вперше був запропонований як міра середовища С.Зеренсеном у 1909 р. Визначається загальною формулою:
Аналогічно рОН – це від’ємний десятковий логарифм активності йонів ОН–:
Оскільки активності йонів у чистій воді приблизно дорівнюють їх концентраціям, то р-форма (3.55) має вигляд: –lgКw = –lg[Н3О+]+(–lg[ОН–]) = –lg(1·10–14); рКw = рН+рОН = 14. (3.59) Рівняння (3.44) дає змогу розрахувати значення рН, якщо відома одна з величин. Наприклад, концентрація йонів [Н3O+] становить 10–6 кмоль/м3, то рН = –lg[Н3O+] = –lg10–6 = 6. Залежність між [Н3O+], величиною рН і характером середовища ілюструє схема:
Залежність між концентрацією Гідроген-йонів і рН середовища. [H3О+] 100 10–1 10–2 10–3 10–4 10–5 10–6 10–7 10–8 10–9 10–10 10–11 10–12 10–13 10–14
|
|||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 2; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.31.125 (0.006 с.) |
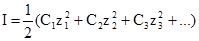 , (3.52)
, (3.52)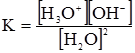 ; К = 3,24·10–18. (3.53)
; К = 3,24·10–18. (3.53)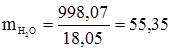 кмоль/м3.
кмоль/м3.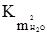 = [Н3О+][ОН–]= (55,35)2´3,24·10–18 (кмоль/м3)2 =1,00·10–14 (кмоль/м3)2 = Кw, (3.54)
= [Н3О+][ОН–]= (55,35)2´3,24·10–18 (кмоль/м3)2 =1,00·10–14 (кмоль/м3)2 = Кw, (3.54)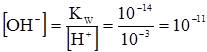 кмоль/м3. (3.56)
кмоль/м3. (3.56)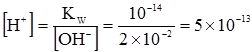 кмоль/м3.
кмоль/м3.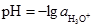 . (3.57)
. (3.57)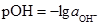 . (3.58)
. (3.58)


