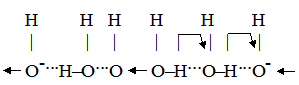Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електролітична рухливість йонів у водних розчинахСодержание книги
Поиск на нашем сайте Речовина К Форміатна кислота НСООН Ацетатна кислота СН3СООН Фосфатна кислота Н3РО4 Карбонатна кислота Н2СО3 Амоній гідроксид NН4ОН 2,00·10–4 1,85·10–5 1,00·10–7 (K2) 3,30·10–7 (K1) 1,87·10–5
В основі механізму дії буферних систем лежить здатність нейтралізувати гідроген-йони або гідроксид-йони. Розглянемо механізм дії буферних систем, утворених слабкою кислотою і її сіллю. В результаті повної дисоціації солі в розчині знаходиться велика кількість аніонів, які практично повністю пригнічують дисоціацію слабкої кислоти. Якщо до цього розчину додати сильну кислоту HCl, то, згідно з теорією Бренстеда, у системі відбуваються такі процеси: електролітична дисоціація СН3СООNа ⇄ СН3СОО– + Nа+; протоліз НСl + Н2О ⇄ Cl– + Н3О+; нейтралізація СН3СОО– + Н3О+ ⇄ СН3СООН + Н2О. Гідроген-йони сильної кислоти взаємодіють з аніонами слабкої кислоти. При цьому утворюються слабодисоційовані молекули кислоти, тому реакція середовища майже не змінюється. Якщо до розчину додати сильну основу, то гідроксильні йони будуть взаємодіяти з гідроген-йонами (або молекулами кислоти СН3СООН). У системі відбуватимуться процеси: електролітична дисоціація NaОН ⇄ Na+ + ОН–; протоліз СН3СООН + Н2О ⇄ СН3СОО– + Н3О+; нейтралізація Н3О+ + ОН– ⇄ 2Н2О. Механізм дії буферної системи створеної слабкою основою і її сіллю, при додаванні сильної кислоти зводиться до взаємодії йонів гідрогену з амоніаком: NН3·Н2О + Н3О+ ⇄ NН4+ + 2Н2О, і реакція розчину не змінюється. При додаванні до цього буферного розчину лугу гідроксид-йони зв’язуються з йонами амонію: ОН– + NН4+ ⇄ NН3 + Н2О, і в цьому випадку рН середовища також не змінюється. Цікава особливість фосфатного буфера в тому, що обидва його компоненти є сильними електролітами, але, незважаючи на це, буфер задовольняє вимоги, що ставляться до буферних систем, які складаються із слабких кислот і їх солей сильних основ. Тим паче, залежно від співвідношень цих солей можуть бути одержані буферні суміші з різними значеннями рН, в основному від 5,90 до 7,80. Фосфатні буферні системи часто використовуються у лабораторній практиці, тому що значення їх рН відповідає найважливішим у фізіологічному відношенні значенням реакції середовища. Аніон фосфатної кислоти, що утворюється при дисоціації однозаміщеного фосфату Н2РО4–, слабо дисоціює (К = 1,54·10–7) і тому поводить себе як слабка кислота. Другий компонент фосфатного буфера – Nа2РО4– дисоціює майже повністю і виступає як сіль цієї кислоти сильної основи. При додаванні сильної кислоти (HCl) пройдуть процеси: електролітична дисоціація Nа2НРО4 ⇄ НРО42– + 2Nа+; протоліз HCl + Н2О ⇄ H3О+ + Cl–; нейтралізація H3О+ + НРО42– ⇄ Н2РО4– + Н2О. Утворений аніон Н2РО4– слабо дисоціює і тому середовище не змінюється. Якщо в буферну систему вводити луг (NаОН), то це зумовить такі процеси: електролітична дисоціація NаОН ⇄ Nа+ + ОН–; протоліз Н2РО4– + Н2О ⇄ H3О+ + НРО42–; нейтралізації H3О+ + ОН– ⇄ 2Н2О. В обох випадках реакція розчину не змінюється. Буферна ємність. Здатність буферних систем стійко утримувати на відповідному рівні концентрацію йонів гідрогену є обмеженою. Зміщення рН буферного розчину залежить від кількості доданих до нього кислот чи основ і, у зв’язку з цим, від зменшення концентрації одного з компонентів (слабкої кислоти або її солі), що входять до складу буфера. Здатність буферних розчинів протидіяти зміні рН називають буферною дією. Межі, в яких проявляється дія, називають буферною ємністю – це розрахункова величина, яка визначається молярною масою еквівалента сильної кислоти nНCl, (n½H2SO4) або сильної основи nNaOH, [n½Ba(OH)2], що слід додати до 1 л буферного розчину, щоб рН змінився на одиницю. Буферна ємність залежить від природи і концентрації компонентів буферного розчину, а також від співвідношення їх концентрації. Чим більша концентрація компонентів буферного розчину і чим ближче співвідношення концентрацій
і
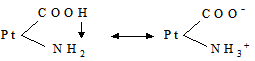
де: В – буферна ємність; n[H3O+] і n[OH–] – молярні маси еквівалентів; рН0 – показник гідрогену до додавання сильної кислоти чи основи; pН1 – водневий показник після додавання. У процесі обміну речовин утворюється велика кількість кислих продуктів. Так, в організмі людини щодобово утворюється 20-30 л 1 н кислоти, а у жуйних у передшлунках утворюється до 5 кг кислот за добу. Збереження сталості кислотності середовища організму забезпечується, перш за все, наявністю буферних систем. Показник гідрогену різних біологічних рідин коливається від 1,0 до 9,0, крові – 7,2-7,95. При деяких захворюваннях реакція крові зміщується в кислу (при виразці шлунка і дванадцятипалої кишки) або в лужну (при пневмонії) зону. Зміщення кислотності середовища крові у кислу зону називається ацидозом, в лужну – алкалозом. При ацидозі збільшується вміст аніонів в організмі і рН знижується на 0,2-0,5. Це призводить до коматозного стану і загибелі тварин. При алкалозі в крові зростає концентрація катіонів і збільшується числове значення рН. Внаслідок цих змін настає смерть тварини. У тваринному і людському організмах для підтримання сталості рН, перш за все крові, на гідрокарбонатний буфер припадає близько 7%, фосфатний – 1%, гемоглобіновий і оксигемоглобінів – 81%, білковий – 10% і на кислотний близько 1%. Гідрогенкарбонатна буферна система характеризується рівновагою молекул слабкої карбонатної кислоти і сіллю цієї ж кислоти. Гідрогенкарбонатна система – найсильний буфер плазми крові і позаклітинної рідини. Значення рН плазми залежить від співвідношення компонентів буферної системи, яке для рН = 7,4 становить Функція гідрогенкарбонатної буферної системи спрямована на нейтралізацію кислих і лужних продуктів. У системі, якщо до неї надходять кислі продукти (наприклад HCl), відбуваються наступні процеси: протоліз HCl + Н2О ⇄ Н3О+ + Cl–; нейтралізація Н3О+ + НСО3– ⇄ Н2СО3 + Н2О. Таким чином, надлишкова концентрація гідроген-йонів нейтралізується завдяки їх взаємодії з гідрогенкарбонатними йонами. Надлишок карбонатної кислоти гідролізується карбоангідразою: Н2СО3 ⇄ СО2 + Н2О. Карбон (IV) оксид вилучається через легені і співвідношення концентрації кислоти і солі буферної системи знову стабілізується. При надходженні лужних продуктів у реакцію вступає кисла частина буферної системи: Н2СО3 + ОН– ⇄ НСО3– + Н2О. У цьому випадку сильна основа замінюється йоном гідрокарбонату, надлишок якого виводиться нирками. При рН = 7,4 співвідношення компонентів фосфатного буфера Білковий буфер – це система із протеїну (Рt) і його солі. Компоненти цього буфера можуть бути виражені як Рt–СООН – слабодисоційована білок-кислота і її сіль Рt–СООNa: Рt–СООН ⇄ Рt–СОО– + Н+; Рt–СООNa ⇄ Рt–СОО– + Na+. При збільшенні концентрації йонів Гідрогену сіль білка буде реагувати з кислотами, утворюючи слабкодисоційовану білок-кислоту: Протоліз НСl+Н2О ⇄ Н3О++Cl– Нейтралізація При взаємодії з лугами в реакцію вступає білок-кислота і замість сильної основи утворюється слабколужна сіль: Нейтралізація Отже, білковий буфер діє аналогічно буферним системам, які розглянуті раніше. Однак білки володіють також амфотерними властивостями, бо до складу молекул білка входять кислотні і основні групи. Тому навіть окрема білкова молекула проявляє буферну дію:
цвіттерйон Протоліз НСl+Н2О ⇄ Н3О++Cl– Нейтралізація Аналогічно при додаванні сильної основи: Нейтралізація Найпотужнішою буферною системою крові є гемоглобінова і оксигемоглобінова. Буферні властивості гемоглобіну за механізмом дії ідентичні білковим буферним системам. Крім того, система оксигемоглобін-гемоглобін бере участь ще в одному механізмі підтримання сталості рН крові. Як відомо, венозна кров містить велику кількість карбонатної кислоти. Через легені вона видаляється у повітря; однак зміщення рН крові у лужний бік не проходить, тому що утворений оксигемоглобін є сильнішою кислотою, ніж гемоглобін. У тканинах, в артеріальній крові під дією низького парціального тиску кисню оксигемоглобін дисоціює і кисень дифундує в тканини. Утворений гемоглобін, однак, не обумовлює зміни рН крові у лужний бік, тому що в кров із тканин надходить карбонатна кислота. Враховуючи, що сталість кислотно-основної рівноваги в організмі відіграє суттєву роль у проходженні всіх біохімічних процесів, у клініці при аналізі крові значна увага надається визначенню резервної лужності крові. Для цього у досліджуваній плазмі крові визначають кількість СО2, яка є у зв’язаному стані, головним чином, у формі гідрогенкарбонатів. Одержана величина, виражена в об’ємних процентах (кількість мл СО2 у 100 мл плазми), називається резервною лужністю крові. У нормі резервна лужність людини буває від 50-65 об% СО2; при ацидозі ж спостерігається зниження. Таким чином, у підтриманні кислотно-основної рівноваги беруть участь декілька буферних систем (оксигемоглобінова, білкова, карбонатна, фосфатна), а також ряд органів – легені, нирки, шкіра, печінка.
§12. Особливості властивостей сильних електролітів. Раніше (§8) вказувалось, що для пояснення поводження розчинів сильних електролітів теорія Арреніуса непримінима. Непримінимість її виражається у тім, що константа дисоціації розрахована за рівняннями типу (3.43) і (3,44), не повинні залежати від концентрації, а практично вона збільшується приблизно в 10 разів для 1,1-валентних електролітів, в 100 разів для 1,2-валентних і в 50 000 разів для 3,1-валентних електролітів при збільшенні концентрації від 0,001 до 0,1 моль/л. В 1906 р. Е.Сезерленд, а потім А.Ганч висловили точку зору, згідно якої відхилення в поводженні сильних електролітів пояснюється їх повною дисоціацією. Тепер ця точка зору є загально прийнятою. До числа вагомих доказів повної дисоціації сильних електролітів відносять наступні: 1. Кристали багатьох речовин побудовані з йонів, тому можливість сполучення йонів в молекули при розчиненні цих речовин є малоймовірним. 2. При пропусканні променів світла через забарвлений розчин інтенсивність поглинання світла пропорційна концентрації. Згідно теорії Арреніуса, концентрація йонів збільшується зі збільшенням ступеня дисоціації. Отже, можна було би очікувати збільшення інтенсивності поглинання при розбавленні розчину. Одначе інтенсивність поглинання в широкій області концентрацій сильного електроліту не змінюється, тобто кількість йонів при розбавленні розчину не збільшується. 3. При нейтралізації водних розчинів НClO4, HCl і інших сильних кислот сильною основою NaОН, КОН незалежно від природи кислоти і основи виділяється одна і таж кількість теплоти. Це можна пояснити повною дисоціацією реагентів і протікання одної і тої ж реакції Н++ОН– ⇄ Н2О + 56 кДж/моль. Не дивлячись на незаперечливі факти, що доказують повну дисоціацію сильних електролітів, ефективна (активна) концентрація їх розчинів часто виявляється нижчою загальної (аналітичної) концентрації. Для пояснення цього факту виникла потреба нового теоретичного підходу до вивчення властивостей сильних електролітів. Такий підхід був запропонований Дебаєм і Хюккелем. §13. Основні поняття електростатичної теорії сильних електролітів Дебая і Хюккеля. Розрахунок коефіцієнтів активності. У розчинах сильних електролітів внаслідок високої концентрації йонів у порівнянні з розчинами слабких електролітів тієї ж концентрації електростатична взаємодія між йонами набуває великого значення. Теорія сильних електролітів П.Дебая і Е.Хюккеля мала мету відобразити вплив електростатичної взаємодії між йонами на різні властивості розчинів і пояснити причину зменшення активної концентрації електроліту у порівнянні з його загальною аналітичною концентрацією. В основу теорії покладена ідея про наявність навколо кожного йона йонної атмосфери пояснюється тим, що однойменно заряджені йони взаємно відштовхуються, а різнойменно заряджені взаємно притягуються. Тому кожний йон оточується йонами протилежного знаку. Йонна атмосфера містить і позитивні, і негативні йони, одначе в середньому навколо кожного позитивного йона мається надлишок негативних йонів, а навколо кожного негативного - надлишок позитивних. Густина йонної атмосфери максимальна біля центрального йона, з віддаленням від нього зменшується. На певній віддалі, яку можна рахувати межею йонної атмосфери, кількість йонів кожного знаку стає одинакова. Розмір і густина йонної атмосфери Дебай і Хюккель пов’язали з термодинамічними властивостями розчинів електролітів. Зокрема, товщина йонної атмосфери
де е – одиничний електричний заряд, тобто заряд електрона; ε – діелектрична проникність розчинника, яка показує, у скільки разів притягання чи відштовхування між йонами нижче в розчиннику, ніж у вакуумі; k – стала Больцмана; NA – стала Авогадро; zK i zA – заряди катіона і аніона електроліту; І – йонна сила розчину. Товщина йоннної атмосфери
зменшується з ростом заряду е і концентрації йонів, тобто зі збільшенням йонної сили розчину І. Зростання температури Т зумовлює збільшення товщини йонної атмосфери, але при цьому зменшується діелектрична проникність ε, що викликає протилежний ефект. Таким чином, товщина йонної атмосфери залежить від тих же факторів, від яких залежить і коефіцієнт активності (температури, діелектричної проникності, заряду йонів zK i zA, йонної сили розчину). Теорія Дебая і Хюккеля приводить до такого виразу для коефіцієнта активності йона:
Він відомий як граничний закон Дебая. Коефіцієнт
називають граничним коефіцієнтом або коефіцієнтом граничного закону Дебая. ρ0 –густина розчинника. Для 1,1-валентного електроліту (KCl, NaCl) І = m. Приймаючи
У другому приближенні теорія Дебая-Хюккеля для коефіцієнта активності дає вираз
де а – емпірична константа, яка відображає розміри йонів (вона підбирається таким чином, щоби розраховані за рівнянням (3.68) коефіцієнити активності співпадали з дослідними). По порядку величини константа а близька до розміру йонів 10–8 см. Коефіцієнт В вираховують за рівнянням:
Для води він дорівнює 0,3287´108 при 25°С і мало міняється при зміні температури. Рівняння (3.69) для водних розчинів може бути використане аж до йонної сили ~0,1. Для більш широкої області концентрації електроліту використовується рівняння, яке називається третім наближенням Дебая:
де bІ – характеризує лінійну залежність lgy± = f(I). Коефіцієнт b визначають із експериментальних даних за залежністю lgy± від концентрації
Для електроліту, який розпадається у розчині на ν+ позитивних і ν– негативних йонів, середній йонний моляльний коефіцієнт активності вираховують за формулою:
де ν = ν++ν– Знаючи коефіцієнт активності, можна визначити інші властивості розчину, зокрема активність: а± = (СM±)(y±) або а± = (СM±)(y±) (3.71) де а±, СM± ,СM± – середні йонні активності, моляльність і молярність, моль/л; y± і y± – середні йонні моляльний і молярний коефіцієнт активності.
§14. Основні поняття теорій асоціацій і сольватацій (гідратацій) йонів. Теорія П.Дебая і Е.Хюккеля пояснила багато властивостей розчинів сильних електролітів. Однак, за допомогою цієї теорії неможливо пояснити наявність аномальної електричної провідності, виявленої І.Каблуковим (1870) під час дослідження розчинів в аміловому спирті. Питома електропровідність концентрованих розчинів зменшується при додачі електроліту. І.Каблуков виявив факт зростання питомої електричної провідності з подальшим ростом концентрації HCl. Потрібна концентраційна залежність питомої електронної провідності було виявлено в інших неводних і водних розчинах. Сучасні теорії розчинів електролітів пояснюють аномальну електричну провідність утворенням йонних асоціатів. У певній області концентрацій в розчині утворюються йонні пари типу К+А–, які понижують електричну провідність. При зростанні концентрації до йонної пари приєднюється третій йон. Утворюються трійники типу К+А–К+ або А–К+А–. Вони володіють електричним зарядом і здатні переносити струм. У зв’язку з цим питома електрична провідність зростає. Теорія утворення йонних асоціацій вперше запропонована В.Семенченком (1924), а потім детально розглянута Н.Б’єррумом (1926). В теорії йонної асоціації доказано, що йони утворюють асоціат, якщо знаходяться на віддалі меншій 3,57´10–10 zKzAm. Константа асоціації (Касоц) зв’язана з константою дисоціації співвідношенням: Касоц = Кс (3.72) Йони взаємодіють не тільки один з одним,а й з молекулами розчинника. Характер цих взаємодій різний і залежить від типу йонів і природи сил взаємодії (сил короткої дії і сил далекої дії). Взаємодії між частинками в розчині за рахунок сил короткої дії можуть бути сильними і слабкими. Сильні хімічні взаємодії спостерігаються між йонами і молекулами розчинника і супроводжуються узагальненям електронів. Прикладами можуть бути взаємодія йона Н+ і Н2О, йона металу і води, що призводить до утворення йона гідроксонію Н3О+, аквакомплексів типу Cr(Н2О)63+. Слабкі хімічні взаємодії спостерігаються між молекулами і йонами і при цьому утворюються комплекси типу НА…А–. Під сольватацією (гідратацією) розуміють сукупність енергетичних і структурних змін, які проходять в розчині при взаємодії частинок розчиненої речовини з молекулами розчинника. Згідно теорії сольватації, навколо частинки розчиненої речовини розташовані дві сольватні оболонки: первинна і вторинна. У первинну сольватну оболонку входять молекули розчинника, які здійснюють рух в розчині разом з частинками речовини. Число молекул розчинника у первинній оболонці називають коефіцієнтним числом сольватації. Значення його залежить від природи розчиненої речовини і розчинника. У вторинну сольватну оболонку входять молекули розчинника, які знаходяться на значних відстанях від частинок розчиненої речовини. Сольватація сильно проявляється у водних розчинах електролітів за рахунок взаємодії йонів з полярними молекулами води (гідратації). Термодинамічна стійкість сольватів визначається величиною енергії Гіббса (∆Gсол). Так як ∆Gсол = ∆Нсол–Т∆Sсол, то чим менше ∆Gсол, тим стійкіший комплекс. Основний внесок у величину ∆Gсол вносить ентальпія сольватації ∆Нсол яку знаходять із співвідношення:
де ∆Нсол = ∆НКсол+∆НАсол, де ∆НКсол і ∆НАсол – ентальпії сольватації відповідно катіона і аніона.
КОНТРОЛЬНІ ЗАВДАННЯ 1. Що таке розчин? 2. Вказати значення розчинів взагалі і водних розчинів зокрема. 3. Типи розчинів. 4. Які властивості води відомі? Значення їх для живих організмів. 5. Вказати фактори, які впливають на розчинність твердих речовин у розчинах. 6. Сформулювати закон Генрі. 7. Способи вираження складу розчинів. 8. Визначити молярність розчину, який містить 4,0 г NaOH у 100 мл розчину. 9. Характеристика ідеальних розчинів. 10. Від чого залежить зниження тиску насиченої пари над розчином? Сформулювати закон Рауля. 11. Написати формули, які виражають залежність зниження температури замерзання від концентрації в розчинах неелектролітів і в розчинах електролітів. 12. Дати визначення кріоскопічної і ебуліоскопічної сталої розчинника. 13. Застосування кріоскопічного методу. 14. Дати визначення процесу дифузії. Написати математичний вираз коефіцієнта дифузії. 15. Суть процесу осмосу. 16. Написати формули залежності осмотичного тиску від концентрації для розчинів неелектролітів і для розчинів електролітів. 17. Значення осмосу в біологічних процесах. 18. Дати визначення ізотонічного, гіпотонічного і гіпертонічного розчинів. 19. Вирахувати осмотичний тиск при 18°С: а) 0,2 М розчину амоній нітрату; б) 0,15 М розчину глюкози; в) 0,05 М розчину кальцій хлориду (дисоціація солей 100%). 20. Характеристика неідеальних розчинів. Хімічний потенціал у цих розчинах. 21. Що таке йонний добуток води? 22. Дати визначення поняття рН. В яких межах змінюється рН? 23. Поняття про кислоти і основи згідно з протолітичною теорією Бренстеда-Лоурі. 24. Поняття про природу кислот і основ за Льюїсом. 25. Які розчини називаються буферними, який їх склад? 26. Від яких факторів залежить рН буферних розчинів? 27. Від яких факторів залежить буферна ємність? 28. Написати схему механізму дії білкового буферного розчину. 29. Написати схему механізму дії карбонатного буферного розчину. 30. Значення буферних систем крові. 31. Дати характеристику понять активності, коефіцієнт активності, йонна сила електроліту. 32. Дати загальну характеристику електростатичної теорії сильних електролітів Дебая-Хюккеля. 33. Охарактеризувати поняття асоціації і сольватації йонів.
Розділ IV ЕЛЕКТРОХІМІЯ Електрохімія – розділ фізичної хімії, який вивчає перетворення хімічної енергії в електричну і навпаки. Електрохімічні явища, що відбуваються у живому тваринному і людському організмі, пов’язані з багатьма життєво важливими процесами – від руху скелетних м’язів та скорочення серцевого м’яза до збудження і гальмування клітин центральної нервової системи, проведення імпульсів нервовими волокнами. Широко використовуються прилади, які вимірюють ті чи інші електричні характеристики живого організму з діагностичною і лікувальною метою: електрокардіографія, електроенцефалографія, електроміографія та ін. Біологічні тканини і рідини містять значну кількість електролітів та володіють досить високою електропровідністю. На основі цього у фізіотерапії застосовують явища йонофорезу, електрофорезу та ін. §1. Електропровідність. Швидкість руху йонів. Електропровідністю називають здатність речовини проводити електричний струм. Електропровідність L є величиною, оберненою до опору провідника струму:
має розмірність См (Сименс) або Ом–1. Розрізняють дві основні форми електропровідності: електронну та йонну. Відповідно до цього провідники поділяють на дві групи: 1-го та 2-го роду. До провідників 1-го роду належать майже всі метали, карбіди металів, нітрити, графіти, йод і деякі оксиди. Характерною особливістю провідників першого роду є те, що при проходженні струму в них не відбувається помітних змін і їх електропровідність пов’язана з переміщенням електронів. У провідниках 2-го роду проходження струму відбувається завдяки переміщенню йонів. При проходженні постійного електричного струму по провідниках 2-го роду останні розкладаються завдяки хімічним реакціям, які відбуваються на електродах. Найбільш типовими провідниками 2-го роду є розчини і розплави солей, кислот та основ. Речовини, які в розчинах або розплавах є провідниками 2-го роду, називають електролітами. Електропровідність провідників 2-го роду у багато разів менша, ніж провідників 1-го роду. Визначення електропровідності практично зводиться до вимірювання опору шару розчину даного електроліту, що знаходиться між двома електродами. При цьому використовують змінний струм, оскільки при постійному відбуваються електрохімічні реакції на електродах, що призводить до зміни концентрації електроліту. Для визначення електропровідності розчинів використовують спеціальні прилади – кондуктометри. Відомо, що опір провідника прямо пропорційний довжині l і обернено пропорційний поперечному перерізу S провідника:
де: ρ – питомий опір, який залежить від природи провідника. Якщо у рівняння (4.1) ввести R, то воно набуде такого вигляду:
Величину
Питома електропровідність – це електропровідність розчину електроліту, розміщеного між електродами, площа яких 1 см2 (або 1 м2) і відстань між якими 1 см (або 1 м). У розчинах електролітів величина питомої електропровідності залежить від швидкості руху і концентрації йонів в одиниці об’єму та від температури. Залежність від температури є досить складною, оскільки температура впливає на кілька характеристик такої системи, як розчин електроліту (в’язкість, ступінь йонізації, гідратацію йонів, швидкість руху, тощо), однак, у більшості випадків χ розчинів завжди збільшується при підвищенні температури (табл 4.1). Таблиця 4.1. Питома електропровідність розчинів. Температура, °С χ розчину KCl CM м–1 0,01 кмоль/м3 0,02 кмоль/м3 0,1 кмоль/м3 0.1147 0,1278 0,1413 0,2243 0,2501 0,2762 1,0480 1,1670 1,2880
Виникла необхідність виразити електропровідність так, щоб вона стосувалася до певного значення концентрації. Це зробив Е.Ленц, ввівши поняття про молярну електропровідність. Молярною електропровідністю λС називають електричну провідність об’єму розчину, в якому міститься 1 моль розчиненого електроліту, розміщеного між електродами, віддаленими один від одного на відстань 1 м (або 1 см). Поняття молярної електропровідності пов’язане зі змінним об’ємом, який залежить від концентрації електроліту. Наприклад, концентрація розчину електроліту становить С моль на 1 л. Тоді об’єм, в якому міститься 1 моль, буде дорівнювати
Рис. 4.1. Залежність молярної електропровідності від розве-дення.
де: коефіцієнт 1000, необхідний для перерахунку концентрації в моль/м3 (1 л = 10–3 м3). Розмірність молярної електропровідності СМ´моль–1´м2. Якщо ввести розведення V (величину, обернену концентрації
Рис. 4.2. Залежність мо-лярної електро-провідності від квадратного ко-реня з концент-рації розчинів електролітів. Молярна електропровідність зручна при порівнянні величин електропровідності різних електролітів, а також при з’ясуванні впливу концентрації на електропровідність одного і того ж електроліту, оскільки вона характекризує електропровідність 1 моля електроліту. Ця величина зростає зі зменшенням концентрації, тобто зі збільшенням розведення, бо кількість молекул розчиненого електроліту при будь-якому розведенні залишається незмінним. Вона дорівнюватиме 1 молю, а число йонів у процесі розведення збільшуватиметься згідно з законом Оствальда. Проте це зростання має відповідну межу. Молярна електропровідність досягає максимуму, коли ступінь йонізації внаслідок розведення дорівнюватиме одиниці і всі молекули продисоціюють на йони. Подальше розведення розчину не змінюватиме величини молярної електропровідності, тому що число носіїв електрики та їх швидкість не змінюватимуться. А оскільки відстань між електродами залишається незмінною, то незмінною буде і електропровідність (рис. 4.1). Таке максимальне граничне значення молярної електропровідності називають граничною електропровідністю і позначають символом λmax. Це електропровідність гіпотетичного розчину, в якому електроліт повністю йонізований і відсутня міжйонна взаємодія. Експериментально одержати такий розчин неможливо, тому λmax знаходять графічно, шляхом екстраполяції (рис. 4.2). Однак цей метод не дає задовільних результатів для слабких електролітів. Таблиця 4.2. Гранична молярна електропровідність для деяких електролітів у воді при 298 K. Електроліт λmax 104, CM моль–1м2 HCl CH3COOH KCl NaCl KNO3 NaNO3 426,16 380,71 149,85 126,45 144,96 121,56
У табл. 4.2 наведені значення λmax деяких електролітів. Ф.Кольрауш, порівнюючи величину λmax двох електролітів, які мають спільний аніон або катіон, помітив закономірність. Наприклад:
Отже, різниця λmax у кожній парі електролітів з різними катіонами, але з однаковими аніонами не залежить від того, з яким аніоном зв’язані дані катіони, а залежить тільки від цих катіонів. Це може бути тільки тоді, коли катіон і аніон вносять до загального значення λmax свою незалежну частину електропровідності і тоді при відніманні
Аналогічні результати були одержані Кольраушом із електролітами, в яких у кожній парі аніони різні, а катіони однакові:
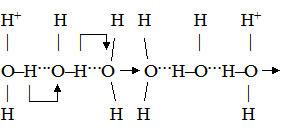
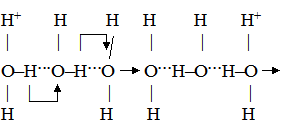
Було зроблено висновок, що гранична молярна електропровідність складається із незалежних одна від одної граничних молярних електропровідностей або електричних рухливостей катіона λ+ і аніона λ–: λmax = λ++λ–. (4.7) Вираз (4.7) є математичним записом закону Кольрауша, який називають ще законом адитивності граничної молярної електропровідності, або законом незалежності руху йонів. Електролітична рухливість йона є величина стала для кожного йона. Вона пропорційна його абсолютній швидкості і залежить від температури та природи розчинника. Рухливість йона дорівнює добутку абсолютній швидкості U і сталої Фарадея F: λ+ = FU+; (4.8) λ– = FU–, (4.9) де: F = 96500 Кл/моль; U+ і U– – абсолютна швидкість руху йонів, тобто швидкість руху йонів у безмежно розведеному розчині, в 1м/с при спаді потенціалу поля в 1 В/м; розмірність U+, Виходячи з цього рівняння (4.7), можна записати так: λmax = FU+ + FU– = F(U+ + U–). (4.10) У табл. 4.3 наведено дані про електролітичну рухливість деяких йонів. Найбільшу рухливість у воді мають йони Н3О+ і ОН–. Таку високу рухливість можна пояснити тим, що рух протона під впливом електричного поля відбувається двома шляхами: рухом разом зі своєю гідратною оболонкою у напрямку поля та “перестрибуванням” по водневому зв’язку від одної молекули до іншої у тому ж напрямку:
Швидкість “перестрибування” значно більша за швидкість поступального руху, внаслідок чого ефективна швидкість руху йонів гідроксонію дуже висока. При цьому протони проходять не весь шлях до катода, а тільки відстань між молекулами води. Вони ніби передаються естафетою від однієї молекули води до другої, тому такий механізм руху йонів названий естафетним. У випадку гідроксильних йонів можна навести таку схему руху:
Велика швидкість руху йонів ОН– пояснюється таким самим механізмом, але при цьому протон передається від молекули води до гідроксильного йона. У результаті цей процес виглядає як переміщення ОН–-йонів до анода. Таблиця 4.3.
|
||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 42; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.017 с.) |

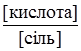 і
і 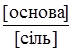 до одиниці, тим більша буферна ємність. При рівності концентрацій обох компонентів буферна ємність набуває максимального значення. Обчислення ведеться за формулами:
до одиниці, тим більша буферна ємність. При рівності концентрацій обох компонентів буферна ємність набуває максимального значення. Обчислення ведеться за формулами: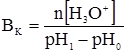 (3.64)
(3.64)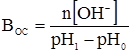 , (3.65)
, (3.65)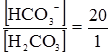 .
.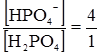 . Фосфатна буферна система функціонує так само, як гідрокарбонатна, і є найсильним внутріклітинним буфером.
. Фосфатна буферна система функціонує так само, як гідрокарбонатна, і є найсильним внутріклітинним буфером.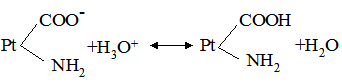
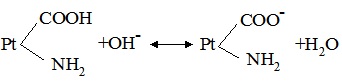
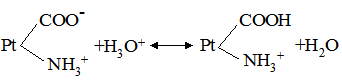
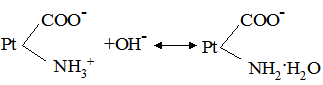
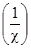 , виражена в одиницях довжини, ввійшла у вираз для коефіцієнта активності.
, виражена в одиницях довжини, ввійшла у вираз для коефіцієнта активності.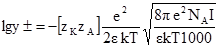 ,
,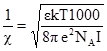
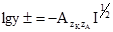 (3.66)
(3.66)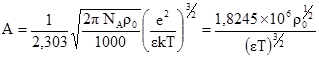
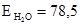 , одержують А = 0,508. І тоді
, одержують А = 0,508. І тоді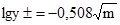 . (3.67)
. (3.67)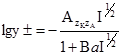 , (3.68)
, (3.68)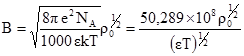 (3.69)
(3.69)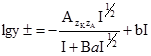 , (3.71)
, (3.71)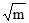 . У рівняннях (3.67) - (3.70) y± – середній йонний мольний коефіцієнт активності, що є середнім геометричним коефіцієнтів активності, яка характеризує цей електроліт в цілому, для 1,1-валентного електроліту
. У рівняннях (3.67) - (3.70) y± – середній йонний мольний коефіцієнт активності, що є середнім геометричним коефіцієнтів активності, яка характеризує цей електроліт в цілому, для 1,1-валентного електроліту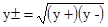 .
.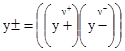 ,
,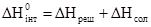 ,
,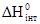 – перша інтегральна теплота розчинення речовини у даному розчиннику;
– перша інтегральна теплота розчинення речовини у даному розчиннику; 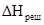 – енергія кристалічної решітки розчиненої речовини.
– енергія кристалічної решітки розчиненої речовини.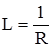 , (4.1)
, (4.1)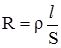 , (4.2)
, (4.2)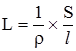 . (4.3)
. (4.3) , обернену до питомого опору, називають питомою електропровідністю і позначають χ. Таким чином:
, обернену до питомого опору, називають питомою електропровідністю і позначають χ. Таким чином: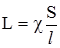 . (4.4)
. (4.4) л. Молярна електропровідність виражається:
л. Молярна електропровідність виражається: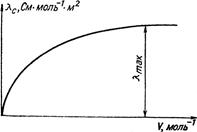
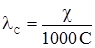 , (4.5)
, (4.5)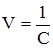 ) замість молярної концентрації СM, то можна записати:
) замість молярної концентрації СM, то можна записати: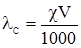 . (4.6)
. (4.6)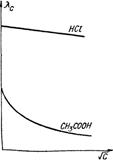
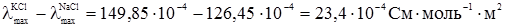 ;
;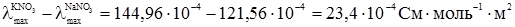 .
.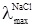 від
від 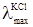 однакові електропровідності йона Cl– взаємно виключаються з розгляду. Так само взаємно виключаються з розгляду електропровідності йона NO3– при відніманні
однакові електропровідності йона Cl– взаємно виключаються з розгляду. Так само взаємно виключаються з розгляду електропровідності йона NO3– при відніманні 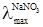 від
від 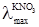 і різниці λmax в обох випадках залишаються однаковими, зумовленими тільки різницею електропровідностей йонів К+ і Na+:
і різниці λmax в обох випадках залишаються однаковими, зумовленими тільки різницею електропровідностей йонів К+ і Na+: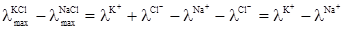 ;
;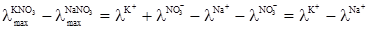 .
.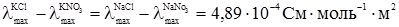 .
.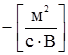 .
.