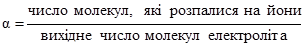Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рис. 3.6. Системи з позитивними (а) і негативними (б) відхиленнями від закону Рауля.Содержание книги
Поиск на нашем сайте
На рис. 3.6 приведені системи з позитивними і негативними відхиленнями від закону Рауля. Знак і величина відхилення залежить від природи розчинника і розчиненої речовини. Позитивні відхилення виникають у тому випадку, коли енергія взаємодії різнорідних молекул (А-В) менша, як однорідних (А-А, В-В). У цьому випадку сила взаємодії між молекулами у розчині менша і вони легше переходять у пару. Негативне відхилення спостерігається тоді, коли енергія взаємодії різнорідних молекул вища, ніж енергія взаємодії однорідних молекул. Стосовно до неідеальних розчинів залишається факт, що при утворенні розчину підвищується ентропія (∆S>O) і зменшується вільна енергія системи (енергія Гіббса). Однак залежність ∆G i ∆S від р, Т і складу більш складна, ніж у випадку ідеальних розчинів. Неідеальні розчини утворюються з виділенням або поглинанням теплоти, зміною об’єму і теплоємності, тому для неідеальних розчинів ∆Hзміш ≠ 0, ∆Vзміш ≠ 0. Різницю між змішуванням ідеальних і неідеальних розчинів називають надлишковими функціями. У випадку ідеального розчину як розчинник, так і розчинена речовина підкоряються закону Рауля і при всіх концентраціях такого розчину здатні до використання рівняння для хімічного потенціала μА = μА+RTlnNA, μB = μB+RTlnNB, (3.36) де NА і NВ мольна частка відповідно розчинника і розчиненої речовини; У випадку неідеального розчину розчинник і розчинена речовина не підкоряються закону Рауля і до таких розчинів використовують вираз для хімічного потенціалу розчинника і розчиненої речовини у формах μА = μB = де Для розчинника у якості стандартного стану приймають стан чистого розчинника, тобто вважають, що NA = аА = 1. У якості стандартного стану розчиненої речовини приймають стан при безмежному розбавленні розчину, коли активності розчиненої речовини рівні одиниці, тобто NВ = аВ = 1. Таким чином, стандартним станом розчинника і розчиненої речовини буде їх стан в безмежно розбавленому розчині, в якому активності співпадають. При аА = 1 і аВ = 1 хімічні потенціали
Рівняння (3.37) – (3.40) показують, що всі відхилення від ідеальності визначаються членами RTlnγA і RTlnγB.
§8. Розчини електролітів. Йонна рівновага. Електролітами називають розчини, при взаємодії з розчинником піддаються дисоціації на йони, які зумовлюють електропровідність розчину. Число йонів кожного знаку визначається стехіометрчними коефіцієнтами в формі електроліту. Так як молекула електронейтральна, сума позитивних зарядів завжди рівна сумі негативних. Наприклад СаCl2 розпадається на йон Са2+ і два йони хлору: CaCl2 → Са2++2Cl–. Розчин залишається електронейтральним. Якщо при дисоціації електроліту утворюються однозарядні йони, то електроліт називають 1,1-валентним (NaCl, KCl і т.п.), якщо утворюються двохзарядні йони – 2,2- валентними (ZnSO4, CuSO4 і т.п.). У залежності від ступеня дисоціації електроліти умовно ділять на сильні і слабкі. До сильних електролітів відносять речовини, які повністю розпадаються на йони. Як правило їх решітка побудована із йонів (NaCl, KCl, BaCl2 і т.п.). до слабких електролітів відносять речовини, які розпадаються на йони лише частково (NH4OH, CH3COOH, HCOOH і т.п.). Це в основному речовини з ковалентним зв’язком. Ступінь дисоціації електроліту залежить від розчинника, температури, концентрації. Так, електроліти, сильні у воді, як правило, дисоціюють у неводних розчинниках не повністю. Слабкі електроліти. Теорія С.Арреніуса.Рівновага в розчинах слабких електролітів. Теорія електролітичної дисоціації С.Арреніуса (1883) стала першою науково обгрунтованою теорією розчинів. Згідно цієї теорії, процес розпаду речовини у розчині на йони називають електролітичною дисоціацією. За Арреніусом кислотами є речовини, які містять водень і дисоціюють на йон гідрогену і аніон, а основами - сполуки, які містять гідроксильні групи і при дисоціації дають гідроксил-йон і катіон. Процесом нейтралізації називають реакцію сполучення Н+ і ОН– утворюючи молекулу води.
Сіллю називають сполуки, які дисоціюють з утворенням катіона і аніона. Загальною властивістю солей є їх повна дисоціація у воді. На відміну від солей кислоти і основи дисоціюють не повністю. В результаті дисоціації у розчині встановлюються рівноважні концентрації йонів і молекул за сталих умов, які незмінні у часі. Наприклад, в системі вода-ацетатна кислота встановлюється рівновага СН3СООН ⇄ Н++СН3СОО– Число молекул, які розпалися за одиницю часу, рівне числу молекул, які утворилися за рахунок сполучення йонів Н+ і СН3СОО–. Реакція дисоціації підкоряються закону дії мас. Константи рівноваги реакції дисоціації називають константою дисоціації. Наприклад, вираз для константи дисоціації ацетатної кислоти має вигляд
де [Н+] і [СН3СОО–] – рівноважні концентрації відповідних йонів, моль/л; [СН3СООН] – рівноважна концентрація недисоційованих молекул кислоти, моль/л. Аналогічно в системі Н2О-NH4ОН встановлюється рівновага NH4OH ⇄ NH4++OH–
Константи дисоціації, що виражені рівняннями (3.41) і (3.42), називають класичними (або концентраційними) константами і позначають Кс на відміну від термодинамічних констант, які позначають Ка). У загальному вигляді для кислоти НА і основи ВОН (1,1-валентних електролітів)
У рівняннях (3.43) і (3.44) [Н+] = [А–] і [В+] = [ОН–], бо із 1 моль кислоти (основи) одержується рівна кількість позитивних і негативних йонів. Рівноважні концентрації дисоційованих молеку рівні [НА] = СНА–[Н+], [ВОН] = СВОН–[ОН–], де [Н+] і [ОН–] – концентрації дисоційованих молекул, моль/л; СНА і СBOH – загальні (вихідні) концентрації кислоти і основи, моль/л. але [Н+]<<CНА і [ОН–]<<CВОН, то
Значення КсНА і КсВОН у рівняннях (3.43) і (3.44) залежать від природи розчинника, природи електроліта, температури, але не залежать від концентрації електроліта. КсНА і КсВОН можуть у деякій мірі змінюватися у зв’язку з електростатичною взаємодією йонів у розчині. У протилежність константі дисоціації електроліту ступінь дисоціації залежить від концентрації. Ступенем електролітичної дисоціації (α) називають відношення числа молекул, які розпалися на йони, до вихідного числа молекул:
|
||||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 8; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.70.100 (0.009 с.) |

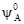 і
і 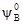 – стандартний хімічний потенціал, характеризуючий відповідно розчинник і розчинену речовину в індивідуальному (стандартному) стані (при NA = 1 i NB = 1).
– стандартний хімічний потенціал, характеризуючий відповідно розчинник і розчинену речовину в індивідуальному (стандартному) стані (при NA = 1 i NB = 1).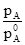 =
= 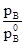 =
= 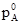 і
і 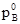 – тиск насиченої пари над речовиною А і В над розчином; aA і aB – активності речовин А і В, рівні
– тиск насиченої пари над речовиною А і В над розчином; aA і aB – активності речовин А і В, рівні 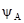 =
= 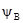 =
= 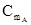 +RTlnγA, (3.39)
+RTlnγA, (3.39)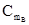 +RTlnγB (3.40)
+RTlnγB (3.40)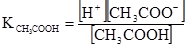 , (3.41)
, (3.41)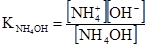 . (3.42)
. (3.42)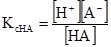 ; (3.43)
; (3.43)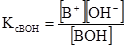 . (3.44)
. (3.44)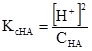 ,
, 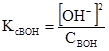 , звідки
, звідки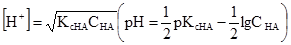 , (3.45)
, (3.45)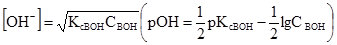 (3.46)
(3.46)