Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розчинність в 100 г розчинника, гСодержание книги
Поиск на нашем сайте
G = U+pV–TS = F+pV. Звідси зміна енергії Гіббса виразиться рівнянням: –∆G = –∆F–p∆U, а з врахуванням (1.41): –∆G ≥ W’–p∆U ≥ W*. (1.42) Зменшення енергії Гіббса більше або рівне максимально корисній роботі процесу (W*). Енергія Гіббса, як і енергія Гельмгольца, характеризує працездатність системи, тобто визначає ту частину енергії, яка у ізобарно-ізотермічному процесі (при p, T = const) перетворюється у роботу. Енергію Гіббса і енергію Гельмгольца називають також “вільною” енергією. Ці два термодинамічні потенціали є функціями стану. Вони залежать від природи речовин (учасників реакції), їх маси і температури. Абсолютні значення термодинамічних потенціалів невідомі, а для розрахунків використовують зміни потенціалів (∆F і ∆G, кДж/моль). Зміна внутрішньої енергії системи відбувається не тільки внаслідок віддачі або одержання теплоти чи виконання роботи, а й за рахунок зміни мас компоненнтів, що входять до її складу. Зміна маси речовини системи зумовлює зміну її внутрішньої енергії, про що свідчить рівняння U = f(V, S, m1, m2, … mi), де U – внутрішня енергія; V – об’єм; S – ентропія; m – маса компонента системи. Якщо одиниця маси спричинює зміну внутрішньої енергії системи на ψ, то зміна внутрішньої енергії, що викликана зміною маси dm, буде дорівнювати ψdm. Тоді сумарна зміна внутрішньої енергії dU = TdS–pdV–ψdm (1.43) Якщо V і T сталі, то одержимо –(TdS–dU) = ψdm, звідки –(TdS–dU) = dF.
Звідси випливає, що ψ при сталих об’ємі і температурі є зміною енергії Гельмгольца, що відповідає зміні маси системи на одиницю. Аналогічно при сталих об’ємі і температурі одержимо
де ψ – зміна енергії Гіббса, що відповідає зміні маси системи на одиницю. З рівняння (1.42) випливає, що
Величину ψ, яка визначає зміну внутрішньої енергії системи, звязаної зі зміною маси компоненнтів, що входять до неї, називають хімічним потенціалом. Віднесений до 1 г речовини хімічний потенціал називають питомим ψпит, а до 1 моль речовини – мольним ψM. Хімічний потенціал є функцією стану, що визначає напрямок і межі довільного переходу даного компонента з однієї фази в іншу при певних перетвореннях (випаровуввання, розчинення, взаємодії, кристалізації). Загальною умовою можливого довільного перебігу процесу є нерівність Sψidνi<0, (1.47) а стану рівноваги відповідає рівність Sψidνi=0, (1.48) де ψ – хімічний потенціал; dν – зміна кількості молів речовини.
§6. Термодинаміка хімічної рівноваги. Хімічні реакції можуть одночасно відбуватися у двох напрямках: у бік утворення продуктів реакції (вправо – пряма реакція) і у бік перетворення продуктів у вихідні речовини (вліво – оборотна реакція). Такі реакції називають хімічно оборотними. З часом швидкість прямої реакції зменшується, а оборотної – збільшується. Коли їх швидкості зрівняються, настає стан хімічної рівноваги – динамічний процес, який характеризується постійністю рівноважних концентрацій усіх складових реакцій, під час якого не змінюються зовнішні умови і термодинамічні потенціали мають мінімальне значення. У загальному вигляді, для реакції υ1 nAA+nBB ⇄ nСС+nDD, υ2 коли швидкість прямої реакції υ1 дорівнюватиме швидкості оборотної реакції υ2, концентрації стають рівноважними:
де C’A, C’B, C’C, C’D – рівноважні концентрації компонентів реакції. KС називають константою хімічної рівноваги, або класичною константою. У випадку реальних систем концентрації замінюють на рівноважні активності (
де Ка – термодинамічна константа хімічної рівноваги. Якщо у реакції беруть участь газоподібні речовини, то константи хімічної рівноваги виражають через рівноважні парціальні тиски (
Рівняння (1.49), (1.50) і (1.51) виражають закон дії мас: відношення добутку рівноважних концентрацій (активностей) продуктів реакції, взятих у ступенях, рівних їх стехіометричним коефіцієнтам, до такого ж добутку концентрацій (активностей) вихідних речовин є величина стала при даній температурі й називається константою хімічної рівноваги. Константи рівноваги залежать від природи реагуючих речовин, температури і не залежать від концентрації (KС), активності (Kа), тиску (KP) і фугітивності (Kf). Константи рівноваги KC і KP безрозмірні тільки для тих реакцій, які відбуваються без зміни числа молів газоподібних компонентів. У інших випадках KP має розмірність тиску, а KC – розмірність концентрації у ступенях ∆n: Δn = Σnпрод–Σnвихідн = (nС+nD)–(nA+nB), [KP] = [тиск]Δn і [KC] = [моляльність]Δn, де Δn – алгебраїчна сума стехіометричних коефіцієнтів. Константи рівноваги, виражені через активності і фугітивності, безрозмірні, тому що активність і фугітивність – величини відносні і залежать від вибору стандартного стану. Якщо у виразі (1.45) рівноважні парціальні тиски виразити за допомогою рівняння Менделєєва-Клапейрона як КP = КC(RT)∆n. (1.52) У випадку гетерогенних реакцій у вираз константи хімічної рівноваги входять парціальні тиски (або концентрації) тільки газоподібних компонентів. Парціальні тиски і концентрації індивідуальних речовин у твердому чи рідкому станах приймаються сталими, бо їх хімічні потенціали постійні. Наприклад, для реакції: СаСО3(т) ⇄ СаО(т)+СО2(г) КP =
КОНТРОЛЬНІ ЗАВДАННЯ 1. Які фізичні величини характеризують стан системи? 2. Що таке термодинамічний процес? 3. Поняття про ізохорні та ізобарні умови. 4. Яку систему називають відкритою і закритою? 5. Формулювання першого закону термодинаміки. 6. Яку функцію стану називають ентальпією? 7. Поняття про внутрішню енергію системи? 8. Охарактеризувати залежність Н = U+pV. 9. Фізична характеристика поняття робота (W). 10. Сформулювати перший закон термодинаміки згідно з Q = ΔU+W. 11. На основі QV =∆U i QP = ∆U+p∆V = ∆H сформулювати закони Гесса. 12. Сформулювати і пояснити перший наслідок, що випливає із закону Гесса. 13. Сформулювати і пояснити другий наслідок, що випливає із закону Гесса. 14. Що таке істинна, молярна і середня теплоємність? 15. Написати вирази для ізохорної та ізобарної теплоємностей. 16. Сформулювати другий закон термодинаміки. 17. Яку термодинамічну функцію називають ентропією? Написати математичний вираз ентропії Клаузіуса. 18. Сформулювати третій закон термодинаміки і записати вираз рівняння для абсолютної ентропії. 19. Які відомі термодинамічні потенціали? 20. Написати вираз для енергії Гельмгольца і енергії Гіббса. 21. Поняття про хімічну рівновагу. 22. Що таке константа хімічної рівноваги? Написати вираз констант рівноваги. 23. Сформулювати закон дії мас.
Розділ ІІ АГРЕГАТНИЙ СТАН РЕЧОВИНИ §1. Загальна характеристика станів речовини. Агрегатний стан речовини є функцією температури і тиску. Однак, це не означає, що, змінюючи температуру і тиск, для будь-якої речовини можна реалізувати всі три агрегатні стани: газ, рідина, тверда речовина. Так, білкові речовини не можуть набути газуватого стану, бо при нагріванні вони розпадаються. Такі ж властивості мають і ряд неорганічних сполук: кальцій карбонат при нагріванні розпадається на простіші речовини (СаСО3 У твердих тілах відстань між молекулами мінімальна і сила притягання між ними дуже велика. Тому тверде тіло зберігає свою форму та об’єм і щоб змінити їх, потрібно виконати певну роботу. Молекули і атоми чи йони, з яких складаються тверді тіла, розміщені в певному порядку і частинки виконують лише коливальні рухи відносно положення рівноваги. Відстані між молекулами у рідині дещо більші, ніж у твердих тілах. Сили притягання між молекулами менші, але ще настільки значні, що молекули рідин не рухаються безладно, а лише “ковзають” одна біля одної. Рідини легко змінюють свою форму, наприклад, при переливанні з однієї посудини в іншу. Цю властивість рідини називають плинністю. При зниженні температури рідина набуває більш упорядкованої структури, тобто наближається до структури твердого тіла. Основна риса газуватого стану – мала густина речовини, значна відстань між молекулами, малі сили притягання, в результаті чого газ прагне зайняти максимальний об’єм. Внаслідок великих міжмолекулярних віддалей гази, на відміну від твердих тіл і рідин, здатні стискатися. За певних умов речовина може бути в четвертому агрегатному стані – плазмовому. У процесі нагрівання до високих температур (тисячі і мільйони градусів), вона переходить в йонізований стан – плазму: це суміш атомів, позитивно заряджених йонів і атомних ядер, які безперервно переміщуються. Плазмовий стан буває у блискавках, електричній дузі. Найбільним згустком плазми є зірки, в тому числі й Сонце.
§2. Газуватий стан речовини. До початку ХVІІ ст. слово “газ” не використовували. Його ввів бельгійський фізик Ж.Б.ван Гельмонт (1577-1644) після того, як виникла нова ідея про існування різних видів “повітря”. Ван Гельмонт відкрив утворення невідомого газу (який тепер називають карбон (IV) оксидом) при взаємодії вапна з кислотою, цей газ важчий від повітря і не підтримує життя. Протягом ХVІІ і ХVІІІ ст. були відкриті інші гази, в тому числі водень, кисень і азот. Але майже до самого кінця ХVІІІ ст. ці три гази не вважали простими речовинами. Фундамент сучасної хімії був закладений тільки тоді, коли Лавуазьє визнав, що кисень є простою речовиною, а горіння – процес сполучення речовини з киснем. Дослідним шляхом було встановлено, що при низькій густині всі звичайні гази ведуть себе приблизно однаково. Характер цієї поведінки описується законами ідеальних газів (часто для спрощення називають – газові закони). Якщо газ дуже розріджений, то відстань між окремими молекулами така велика, що силами міжмолекулярної взаємодії можна знехтувати. При цьому можна знехтувати і об’ємом молекул, оскільки він надзвичайно малий порівняно з об’ємом, що його займає газ. Газ, який перебуває в такому стані, коли можна знехтувати силами міжмолекулярної взаємодії й об’ємом його молекул, називають ідеальним газом. Фізичний стан ідеального газу визначається трьома параметрами: температурою Т, тиском p і об’ємом V. Усі ці величини пов’язані між собою; залежність між ними називають рівнянням стану. Воно випливає з трьох газових законів: Бойля-Маріотта, Гей-Люссака і Шарля. Вивчаючи залежність об’єму V даної маси газу від тиску p, Бойль (Велика Британія) і Маріотт (Франція) незалежно відкрили такий закон: об’єм даної маси газу при сталій температурі обернено пропорційний тиску, під яким газ перебуває, тобто:
або p1V1 = p2V2 = К, (2.2) де К – стала величина. Із закону випливає, що добуток об’єму газу на тиск при певній температурі – величина стала. Досліджуючи теплове розширення газів, Гей-Люссак встановив залежність об’єму газу від температури: для даної маси ідеального газу об’єм при сталому тиску прямо пропорційний абсолютній температурі. Цей закон дістав назву закону Гей-Люссака: V = KТ, (2.3) де: V – об’єм газу; Т – абсолютна температура (за шкалою Кельвіна, 1 К = 273ºС); К – константа. За нормальних умов (н.у.) вираз (2.3) повинен мати вигляд: Vо = KТо. (2.4) Тут Vо – об’єм газу за нормальних умов; То – температура, що дорівнює 0ºС або 273 К. Нормальними називають умови, коли температура дорівнює 273 К (0ºС), а тиск становить 101325 Па (1 атм, або 760 мм рт. ст.). За цих умов, як випливає з закону Авогадро, 1 моль будь-якого газу займає об’єм 22,4 л (а 1 кмоль – 22,4 м3). Число молекул, що міститься в 1 молі, називають числом Авогадро: NА = 6,02´1023. Якщо рівняння (2.3) поділити на (2.4), то одержуємо залежність:
звідки
Залежність тиску газу від температури за сталого об’єму відображає закон Шарля: для даної маси ідеального газу тиск прямо пропорційний абсолютній температурі: p = KТ, (2.6) де: р – тиск газу; Т – абсолютна температура; K – константа. Для нормальних умов вираз (2.6) набуває вигляду: pо = KТо, (2.7) pо – тиск газу за нормальних умов; То – абсолютна температура. При діленні (2.6) на (2.7) виникає залежність:
Бувають процеси, коли одночасно змінюються всі три параметри, що характеризують стан газу. Співвідношення, яке одночасно пов’язує між собою значення тиску, об’єму і температури (р, V, Т), називають рівнянням стану ідеальних газів:
У рівнянні (2.9), що відображає закони Бойля-Маріотта і Гей-Люссака, величини ро, Vо, То – сталі, отже відношення Підставивши у (2.9) замість
Рівняння (2.10) використане для 1 моля газу. Для ν молів газу рівняння набуває більш загального вигляду: pV =νRТ. (2.11) Це рівняння називають рівнянням Клапейрона-Менделєєва. Оскільки число ν можна визначити як відношення маси речовини m до її молярної маси M, тобто
Цим рівнянням користуються, розраховуючи різні параметри, що характеризують газ чи його стан: тиск р, об’єм V, температуру Т, масу m, молярну масу М. Щоб використати рівняння Клапейрона-Менделєєва, потрібно знайти значення універсальної газової сталої R. Її визначає розмірність ро і Vо. Якщо ро виражена в атмосферах, а Vо – у літрах, то:
Якщо тиск виражений у міліметрах ртутного стовпа, а об’єм у кубічних сантиметрах, то:
У міжнародній системі одиниць (СІ) R = 8,314·103 Дж/моль·K. У законах ідеальних газів не враховуються сили міжмолекулярної взаємодії і об’єм самих молекул. При значному зниженні температури та підвищенні тиску ці фактори слід враховувати. За законом Бойля-Маріотта, pV при сталій температурі для ідеальних газів – величина стала, тобто pV = const. Для газів, що існують у природі й перебувають в умовах порівняно високого тиску і низьких температур (реальні гази), потрібно враховувати сили міжмолекулярної взаємодії (Ван-дер-Ваальса сили) і об’єм самих молекул. Так, для азоту при p = 1 атм pV = 1000, а при p = 430,86 атм pV =126,96 (тим часом для ідеального газу, згідно з законом Бойля-Маріотта, pV також має дорівнювати 100). Тому для реальних газів слід використовувати рівняння Ван-дер-Ваальса:
де: b – поправка на об’єм молекул (вона приблизно на 2,5% більша об’єму одного моля даної речовини у рідкому стані); Основна цінність рівняння Ван-дер-Ваальса не стільки в розрахунку величин р, V, Т , скільки у тому, що величини а і b пов’язані з критичними параметрами газів. Якщо збільшувати тиск і понижувати температуру, то всі гази можна перетворити в рідину. Однак на таку просту схему накладаються умови, суть яких в тому, що для кожного газу є гранична температура, вище якої газ не зможе зріджуватися навіть при дуже високому тиску. Це так звана критична температура. Для зрідження газів необхідна температура нижче критичної, і чим нижча, тим менший вимагається тиск.
Рис. 2.1. Ізотерми карбон (IV) оксиду. Критичній температурі відповідає критичний тиск і критичний об’єм. Стан газу, що перебуває під критичним тиском при критичній температурі й займає критичний об’єм, називають критичним станом. Наприклад, критичний стан 1 моля карбон (IV) оксиду характеризується такими величинами: температура +31,3ºС, тиск 72,9 атм. (7384,7 кПа), об’єм 0,096 л. Отже, СО2 переходить у рідкий стан при температурі 31,3ºС і тиску 79,2 атм (7384,7 кПа). Якщо температура вища від критичної, то СО2 не переходить у рідкий стан, незалежно від величини тиску. Залежність між тиском і об’ємом реальних газів при сталій температурі показано на рис. 2.1. Такі криві називають ізотермами. Ізотерма має три ділянки – АВ, ВС і СD. Ділянка АВ свідчить, що при малому об’ємі газу відбуваються великі зміни тиску. Це характерно і для рідин. На ділянці СD між об’ємом і тиском існує обернено пропорційна залежність, що характерно для газів. Ділянка ВС відображає перехід газу в рідину і навпаки. Наведена ізотерма типова для СО2. З підвищенням температури відбувається зменшення ділянки ВС, і при 31,3ºС (критична точка) вона перетворюється в зону згину. Вище цієї точки ізотерма характеризує лише зміну стану газу. На ізотермі є точка К, вище якої газ за жодних умов не може перейти в рідину. Ця температура називається критичною (31,3ºС). Тиск і об’єм, які відповідають даній температурі, називають критичними (рк = 73,84·105 Па; Vк = 0,096 л). Експериментальні дані мають практичну цінність, тому що використовуються для зрідження газів. Щоб зрідити газ, необхідно створити критичну температуру, нижче якої він перетвориться в рідину. Для ряду газів розраховані критичні константи (табл. 2.1). Таблиця 2.1. Критичні константи деяких речовин. Речовина Критична температура, ºС Критичний тиск, ×105 Па Критичний об’єм, л Н2 N2 O2 CO2 H2O –239,9 –147,0 –118,8 +31,3 +374,2 12,966 83,935 50,346 73,847 221,036 0,064 0,090 0,078 0,096 0,056
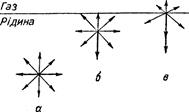
Зріджені гази, особливо кисень, азот, повітря використовуються в техніці, побуті, медицині, ветеринарній медицині, тваринництві, біотехнології. §3. Рідкий стан речовини. Рідина характеризується наявністю відповідно об’єму і відсутністю форми. Щодо своїх властивостей рідини займають проміжне місце між газами і твердими тілами. Так само як і гази, рідини плинні й однорідні за властивостями в усіх напрямах, тобто ізотропні. Сили міжмолекулярного притягання не дають молекулам рідини віддалятися одна від одної на великі відстані і кожна молекула перебуває у сфері дії сусідніх молекул. Тому рідини характеризуються сталістю об’єму. Хоч сили міжмолекулярної взаємодії і великі, та все-таки недостатні, щоб утримувати молекули в певних точках простору. Тому рідина не має сталої форми, а набуває форми тієї посудини, в якій перебуває. Молекули рідини намагаються зайняти деяке впорядковане розміщення в просторі; рідина має об’ємну пружність, як і тверді тіла, бо пружно протидіють не лише всебічному стисканню, а й всебічному розтягненню. Властивості рідини залежать також від об’єму молекул, форми і їх полярності. Рідини, які містять полярні молекули, відрізняються властивостями від неполярних. Полярні молекули орієнтуються різнойменними кінцями диполів одна відносно одної; при цьому між ними виникають сили електростатичного притягання. Відбувається асоціювання двох чи більше молекул у комплекс. Асоціювання може бути спричинено, зокрема, утворенням водневих зв’язків між молекулами рідини. Властивості рідин залежать від ступеня асоціації, оскільки для розриву міжмолекулярних зв’язків потрібна значна енергія. Тому асоційовані рідини (вода, спирт та ін.), мають високу температуру кипіння, меншу леткість тощо. Так, кількісний і якісний склад етанолу і диметилового етеру однаковий (С2Н6О), але спирт – полярна речовина і належить до асоціатів і кипить при вищій температурі, ніж етер (неполярна речовина), який належить до неасоційованих рідин. Важливою фізико-хімічною властивістю рідини є поверхневий натяг. Суть у тому, що поверхневий шар рідини за фізико-хімічними властивостями відрізняється від внутрішніх шарів. Кожна молекула всередині рідини притягує до себе інші навколишні молекули й одночасно з такою ж силою притягується рівномірно з усіх боків молекулами, що оточують її (рис. 2.2 а). Силове поле кожної молекули всередині рідини симетрично насичене. На молекули, які знаходяться поблизу поверхні, діють слабкі сили притягання з боку межі фаз (рис. 2.2 б). Положення таких молекул енергетично нескомпенсоване. При попаданні молекули рідини на межу фаз (рис. 2.2 в) некомпенсованість молекулярної взаємодії зростає. Це зумовлено тим, що інтенсивність взаємодії між молекулами рідини значно вища, ніж взаємодія між молекулами рідини та газу. На рис. 2.2 особливості взаємодії показані стрілками різної довжини.
Рис. 2.2. Стан молекул у поверхневому і глибинному шарах. Енергетична некомпенсованість молекул та межі фаз призводять до втягування молекул, розташованих на поверхні, у глибину рідини. Внаслідок цього виникає сила, під дією якої поверхня рідини на межі рідина-газ зменшується до мінімальних розмірів, а молекули поверхні наближаються до молекул нижчих поверхневих шарів. При цьому відстань між молекулами поверхневого шару менша, ніж між молекулами внутрішніх шарів. Молекули, розташовані на поверхні, не повністю реалізують свою здатність до взаємодії і тому мають нескомпенсований надлишок енергії, який називають вільною поверхневою енергією Gs. Відношення надлишку вільної поверхневої енергії Gs до одиниці площі поділу фаз S називають поверхневим натягом:
де: Gs – поверхнева енергія; S – площа поділу фаз; σ – поверхневий натяг. Поверхневий натяг – це запас поверхневої енергії даної системи. Для чистих рідин поверхневий натяг залежить від природи рідини і температури, а для розчинів – від природи розчинника, від природи і концентрації розчиненої речовини. Розчинені речовини можуть знижувати або підвищувати поверхневий натяг. Ті речовини, що значно знижують поверхневий натяг даної рідини, називають поверхнево-активними. Для води поверхнево-активними є спирти, мила, білки, жовчні кислоти, глікозиди. Додавання таких речовин до води покращує спінювання, тобто утворення великої кількості нових поверхневих плівок рідини, що пояснюється зниженням поверхневого натягу. Речовини, які підвищують поверхневий натяг рідини, називають поверхнево-неактивними. Поверхневий натяг води підвищується при розчиненні неорганічних кислот, лугів, деяких солей. Існує кілька методів визначення поверхневого натягу: за відривом краплі, за висотою підняття рідини в капілярі, найбільшого тиску бульбашок. Найчастіше використовується сталагмометричний метод, який базується на застосуванні приладу – сталагмометра (рис. 2.3).
Рис. 2.3. Сталагмометр. Прилад є капілярною трубкою з верхньою 1 і нижньою 2 мітками, а посередині – розширенням 3. Метод ґрунтується на тому, що крапля, яка утворюється на кінці капілярної трубки 4 сталагмометра, утримується силою поверхневого натягу. Крапля відривається у той момент, коли її вага зрівнюється з силою поверхневого натягу, що утримує краплю, або перевищить її на дуже незначну величину. Для рідини з більшим поверхневим натягом відрив крапель ускладнений, і утворювані краплі будуть більші, ніж у рідин з меншим поверхневим натягом, а тому кількість їх буде менша. Сталагмометр заповнюють рідиною і рахують число крапель n, що витікають з об’єму V. Потім прилад заповнюють дистильованою водою і рахують число крапель води n0, що витікає із цього самого об’єму V. Якщо з об’єму V витікає n крапель рідини, густина якої ρ, то вагу краплі визначають згідно з рівнянням:
де g – прискорення вільного падіння. Сила поверхневого натягу, що утримує краплю, дорівнює 2πrσ, де 2πr – довжина кола отвору капіляра, від якого відривається крапля. В момент відриву краплі досліджуваної рідини справедлива рівність:
а для води:
де: σо – поверхневий натяг води; ρо – густина води; nо – число крапель води. Ділення рівняння (2.15) на (2.16) призводить до залежності:
з якої можна одержати формулу визначення поверхневого натягу:
Рис. 2.4. Капілярне підняття і опускання змочуючої (а) і незмочуючої (б) рідин.
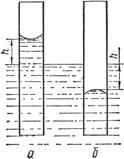
Для визначення вологості ґрунтів часто використовують метод капілярного підняття, який базується на вимірюванні висоти h рідини в капілярі (рис. 2.4). Поверхневий натяг вираховують за рівнянням:
де: r – радіус капіляра; h – висота підняття рідини в капілярі; ρ – густина рідини; g – прискорення вільного падіння. Таблиця 2.2. Поверхневий натяг деяких рідин при 20ºС (293 К). Рідина σ·103 Н/м Рідина σ·103 н/м Етанол Метанол Пропанол Ацетатна кислота Діетиловий етер 22,3 22,61 23,70 27,63 17,00 Бензол Гліцерол Вода Ртуть рідка 28,88 63,00 72,75 471,60
Поверхневий натяг виражається в одиницях сили на одиницю довжини (н/м2), або величиною енергії на одиницю площі (Дж/м2). Поверхневий натяг є одним із факторів, що визначає форму клітини і її частин. Локальним змінам поверхневого натягу належить важлива роль у процесах сприйняття і передачі нервових імпульсів, у фагоцитозі та проникності клітинних мембран. Визначення поверхневого натягу біологічних рідин є важливим для аналізу стану обміну речовин у клінічно здорового або хворого організму. Величина σ для сироватки крові різних тварин наведена у табл. 2.3. Таблиця 2.3. Поверхневий натяг сироватки крові при 20°С (293 K). Тварини σ·10–5 н/м Коні Худоба Вівці Собаки Кролі 73,5 70,2 71,7 55,5 71,5
При вивченні величин поверхневого натягу у біологічних рідинах слід розрізняти статичний і динамічний поверхневий натяги. Статичним поверхневим натягом вважають такий натяг, коли поверхневий шар рідини переходить у рівноважний стан. У чистих рідинах він досягається протягом тисячних часток секунди, а в колоїдних системах і розчинах високомолекулярних речовин – через декілька годин. Поверхневий натяг, виміряний в умовах до настання рівноважного стану, вважається динамічним поверхневим натягом. Величина його в біологічних рідинах органів коливається при різних захворюваннях. Особливо різко вона змінюється (сироватка крові і лімфа) при анафілактичному шоці, гепатитах. Будь-яка рідина складається з молекул (чи йонів), які перебувають у безперервному русі. Між цими частинками існують сили взаємного притягання. Ці сили й утримують частини рідини в певному об’ємі і є причиною поверхневих явищ. Для різних частин рідини існує неоднакова швидкість руху. Теплові рухи молекул є результатом спільних коливань і стрибків молекул із одних тимчасових рівноважних положень (центрів коливань) в інші. Частоти стрибків для низькомолекулярних рідин порівняно невеликі (близько 10–11-10–12 С–1) і різко зменшуються при збільшенні в’язкості. Для дуже в’язких рідин вони надзвичайно малі. З підвищенням температури швидкість руху молекул у рідині зростає. Частина її молекул, досягнувши поверхні, може долати сили міжмолекулярного притягання і переходити в простір над рідиною, створюючи пару. Перехід рідини в пару на межі двох фаз (рідини і газу) називається випаровуванням. Найвища температура, при якій можливий перехід рідини в пару, називається критичною. При критичній температурі tк густина насиченої пари і рідини однакова, межа між ними зникає і теплота пароутворення дорівнює нулю. Для води tк складає 647ºС, етанолу – 516,3ºС, кисню – 154,8ºС. Часткове випаровування з поверхневого шару рідини проходить при будь-якій температурі на межі двох фаз. Під час випаровування деяка частина молекул, які перейшли у пару, знову конденсується в рідину. Якщо число молекул, які переходять у пару, дорівнює числу молекул, які конденсуються в рідину, то такий стан називається динамічною рівновагою. Пара, що знаходиться в динамічній рівновазі з рідиною, називають насиченою, а тиск, який створює пара – тиском насиченої пари. При сталій температурі тиск насиченої пари даної рідини є величиною сталою. Він зростає з підвищенням температури, досягаючи найбільшого значення при критичній температурі. Вище критичної температури рідина не існує. Розрізняють дві форми пароутворення – випаровування і кипіння. Випаровування характеризується пароутворенням лише на вільній поверхні рідини, кипіння – по всьому об’єму рідини. Кипіння є процесом переходу рідини в пару. При цьому тиск пари над рідиною досягає величини зовнішнього атмосферного тиску і пара у процесі випаровування видаляється (тиск не збільшується), що і призводить до активного випаровування в усіх шарах рідини. Температура, при якій спостерігається це явище, називається температурою кипіння даної рідини. Із зростанням тиску температура кипіння зростає і навпаки. Тому в гірській місцевості температура кипіння рідини нижча, бо там нижчий атмосферний тиск.
§4. Твердий стан речовини. На відміну від рідин і газів, тверді речовини зберігають свою форму. Частинки твердих тіл так міцно зв’язані між собою, що вони можуть здійснювати лише коливальні рухи навколо положень рівноваги. Тверді тіла можуть бути кристалічними і аморфними. Кристалічні тіла мають чітку внутрішню структуру, зумовлену правильним розміщенням частинок у чітко визначеному періодично повторюваному порядку. Розміри кристалів можуть бути різні: від дуже дрібних до гігантських. Для кристалічних тіл характерним є визначена температура топлення, явище анізотропії. Це пов’язано з тим, що у кристалах теплопровідність, швидкість росту кристалів, механічна міцність, швидкість розчинення та інші властивості в різних напрямах неоднакові: слюда легко поділяється на пластівці тільки в одному напрямі (паралельно до її поверхні), в інших напрямах для руйнування слюди потрібно значно більше зусилля. Аморфні тіла не мають чітко визначеної температури топлення, вони розм’якшуються в певному інтервалі температур і поступово переходять у рідкий стан. Охолодження не супроводжується утворенням кристалічних структур. Типовими представниками аморфних тіл є звичайне силікатне скло. Для аморфних тіл, так само як і для газів та рідин, характерна властивість ізотропності, тобто сталість властивостей (теплопровідності, електропровідності, механічних властивостей) в усіх напрямках. І все ж чіткої межі між аморфними і кристалічними тілами немає. Наприклад, цукроза може бути як у кристалічному (цукровий пісок), так і аморфному (карамелізований цукор) станах. Крім того, деякі речовини, одержані в аморфному стані, загалом можуть кристалізуватися: кристалізація тієї ж карамелі. Властивості твердих кристалічних речовин визначаються особливостями їхніх кристалів. Атоми, молекули, йони, певним чином розміщуючись у просторі, утворюють просторову кристалічну решітку. Розрізняють чотири основні типи решіток: молекулярні, атомні, йонні і металічні. У вузлах молекулярних кристалічних решіток містяться нейтральні молекули, зв’язані силами міжмолекулярних взаємодій (вандервальсові сили). Сили ці порівняно слабші від електростатичних або від сил ковалентних зв’язків, тому речовини з молекулярним типом решітки мають малу твердість, низькі температури топлення і кипіння, їхні розчини мають малу електропровідність. До таких речовин належать органічні сполуки, вода (лід), карбон (ІV) оксид (сухий лід). Атомні кристалічні решітки побудовані з нейтральних атомів, певним чином розміщених у просторі й зв’язаних силами ковалентних зв’язків. Усі зв’язки в таких кристалах рівноцінні й дуже міцні, тому речовини з атомними кристалічними решітками є дуже тверді, з високою температурою топлення, поганою розчинністю. До таких речовин належать алмаз, графіт, силіцій, карбокорунд та ін. Вузли йонних кристалічних решіток заповнені позитивно і негативно зарядженими йонами, які зв’язані між собою електростатичними силами притягання різнойменних зарядів. Йонні решітки мають більшість солей і деякі оксиди, до складу яких входять елементи з дуже різною електронегативністю. Речовини з йонною кристалічною решіткою мало леткі, з високою температурою топлення, їхні розплави і розчини добре проводять електричний струм. Металічні решітки відрізняються від усіх розглянутих типів. У вузлах решіток типових металів містяться позитивно заряджені йони, між якими є електрони в особливому, так званому вільному, стані. Вони неначе скріплюють однойменно заряджені йони металу у дуже щільну кристалічну решітку. В свою чергу, самі електрони утримуються йонами металу і не можуть вільно покинути решітку. За рахунок вільних електронів метали володіють доброю електропровідністю, теплопровідністю, ковкістю. На рис. 2.5 наведено схеми кристалічних решіток різних типів. Міцність зв’язку між часточками, що утворюють кристали, характеризується енергією, яку потрібно докласти для зруйнування кристалічної решітки і віддалення частинок, з котрих вона складається, на таку відстань, при якій вони вже не взаємодіють. Цю величину називають енергією кристалічної решітки і виражають у кілоджоулях на 1 моль речовини. Чим вища енергія кристалічної решітки, тим міцніший кристал. Так, для NaCl ця енергія становить 771 кДж/моль, а для KJ – 687 кДж/моль.
Рис. 2.5. Схеми кристалічних решіток різних типів. Кристалічні решітки руйнуються при топленні, випаровуванні і розчиненні твердих речовин. Усі ці процеси вимагають затрати енергії, величина якої залежить від енергії кристалічної решітки. При топленні тверда речовина переходить у рідину при певній температурі і її називають температурою топлення. Перехід твердих тіл у газуватий стан називають сублімацією. При цьому тверді речовини переходять у газуватий стан, минаючи рідку фазу (випаровування йоду, сухого льоду).
КОНТРОЛЬНІ ЗАВДАННЯ 1. Охарактеризувати газоподібний, рідкий і твердий стан речовини. 2. Поняття про ідеальний газ. Якими параметрами визначається фізичний стан ідеального газу? 3. Сформулювати закон Бойля-Маріотта і написати формулу залежності об’єму газу від тиску. 4. Сформулювати закон Гей-Люссака і написати формулу залежності об’єму газу від температури. 5. Сформулювати закон Шарля і написати формулу залежності тиску газу від температури. 6. Написати рівняння Клапейрона-Менделєєва і пояснити зміст. 7. Написати рівняння Ван-дер-Ваальса для реальних газів. 8. Що таке критична температура? 9. Поняття про критичний стан газу. 10. Поняття про ізотропність речовини. 11. Фізико-хімічний зміст поверхневого натягу. 12. Дати характеристику вільної поверхневої енергії. 13. Написати формулу, за якою розраховують величину поверхневого натягу. 14. Поняття про поверхнево-активні та поверхнево-неактивні речовини. 15. Біологічне значення поверхневого натягу. 16. Що таке критична температура для рідин? 17. Поняття про насичену пару і тиск насиченої пари, випаровування і кипіння. 18. Явище анізотропії для кристалічних тіл. 19. Типи кристалічних решіток.
Розділ ІІІ РОЗЧИНИ Розчини – це гомогенні (однофазні) термодинамічно стійкі фізико-хімічні системи змінного складу, до яких входить два і більше компонентів. Хімічний склад і фізичні властивості одного розчину у всіх частинах його об’єму однакові. На відміну від простого змішування речовин при розчиненні відбуваються взаємодії між частинками, що утворюють розчин. Речовину, яка при розчиненні не змінює свого агрегатного стану, називають розчинником; її кількість у розчині, як правило, є більшою. Значення розчинів велике. Хімічні реакції, що обумовлюють існування живих істот, відбуваються у розчинах. Організм тварини і людини містить 65-66% води. Майже всі рідини, які є у природі, це розчини – гідросфера, нафта. Біологічні рідини (кров, лімфа, цитозоль та ін.) містять велику кількість розчинених речовин. Більшість ліків використовують у вигляді розчинів, а поживні речовини надходять в організм у розчиненому стані. §1. Типи розчинів. Залежно від агрегатного стану розчини розділяються на: тверді, рідкі та газуваті (пароподібні). До твердих розчинів належать сплави металів, чавун, сталь. Прикладом газоподібного розчину є повітря. У рідких розчинах розчиненими речовинами можуть бути гази, рідини або тверді речовини. У розчинах розчинені речовини знаходяться у різних ступенях дисперсності (подрібненості). Величина частинок служить важливою ознакою, яка обумовлює багато фізико-хімічних властивостей розчинів. За величиною частинок розчини поділяються на істинні (розмір частинок менше 1 ммк, або 10–7-10–8 см), які у свою чергу можуть бути йонні або молекулярні, залежно від того, дисоціює розчинювана речовина на йони чи залишається в недисоційованому стані (у вигляді молекул); колоїдні (розмір частинок від 1 до 100 ммк, або 10–7-10–5 см). Частинки більші від 100 ммк утворюють грубодисперсні системи (емульсії, суспензії, піни, порошки, пасти, аерозолі). Йонні розчини одержують при розчиненні у воді солей, кислот і лугів, наприклад, NaCl, KCl, Na2SO4, HCl, H2SO4, NaOH, KOH та ін. Молекулярні розчини утворюють глюкоза, цукроза, гліцерол та інші речовини, молекули яких практично не дисоціюють у воді. Всі істинні розчини є гомогенними і не мають фізичної межі між розчиненою речовиною і розчинником. До колоїдних відносять особливим способом приготовані розчини речовин, молекули яких за відповідних умов об’єднуються в частинки розміром від 1 до 100 ммк. Колоїдні розчини відрізняються за властивостями від істинних. Вони мікрогетерогенні, тобто мають межу поділу між фазами – розчиненою речовиною (дисперсна фаза) і розчинником (дисперсійне середовище). Розчини високомолекулярних сполук, білків, поліцукоридів мають властивості як істинних, так і колоїдних розчинів.
§2. Способи вираження складу розчинів. Важливою характеристикою будь-якого розчину є його склад та концентрація компонентів. Вміст розчиненої речовини виражають безрозмірними одиницями (частки, проценти) і розмірними величинами – концентраціями. Розглянемо найбільш розповсюджені способи вираження концентрації розчиненої речовини (параметри розчинника позначимо індексом А, а розчинених речовин – В, С і тощо). Згідно з міжнародною системою одиниць СІ під терміном моль розуміють кількість речовини, що має стільки визначених умовних частинок, скільки атомів міститься у 0,012 кг вуглецю 12С. Під умовними одиницями розуміють молекули, йони, електрони, частки молекул та йонів. Якщо застосовується термін “моль”, то необхідно завжди зазначати, про які саме умовні частинки йдеться. Наприклад, 1 моль молекул сульфатної кислоти, 0,1 моль йонів кальцію, тощо. Кількість речовини позначають νі і записують: ν(Н2SO4) = 1 моль, ν(Са2+) = 0,1 моль. Масова частка (ωі) розчиненої речовини – це відношення маси розчиненої речовини В (mi) до загальної маси розчину (∑m):
Величина масової частки виражається у частках одиниці, процентах (%) – сотих частках, проміле (‰) – тисячних частках і мільйонних частках (млн-1). Так, масова частка KCl у розчині одержаному змішуванням 0,9 г KCl із 99,1 г Н2О: ω = 0,009 = 0,9% = 9‰ =900 млн-1. Молярна частка (NВ) – це відношення кількості розчиненої речовини В (моль) до загальної кількості молів речовини (∑νі), що складають розчин:
де νВ – кількість розчиненої речовини (моль); νі – кількість кожного компонента розчину (моль). Сума молярних часток усіх компонентів розчину дорівнює одиниці: NA+NB = 1. Молярна частка NВ виражається в частках одиниці, процентах, проміле і мільйонних частках. Об’ємна частка (φі) – це відношення об’єму розчиненої речовини В (Vi) до суми об’ємів (∑V) компонентів системи, до приготування розчину:
Ця величина виражається в частках одиниці, процентах, проміле і мільйонних частках. Об’ємною часткою характеризують склад газових сумішей. Молярна концентрація (СM або СВ) – це відношення кількості молів розчиненої речовини В νB (моль) до об’єму розчину:
де νВ – кількість молів розчиненої речовини, b – маса розчиненої речовини, г; МВ –молярна маса, г/моль. Молярна концентрація виражається в одиницях: моль/м3, моль/дм3, моль/л. Замість позначень моль/дм3, моль/л можливе позначення М. Наприклад, 1 М НNO3; 0,5 М NaОН. Термін молярність не вживають, але користуються термінами молярний, одномолярний. Моляльна концентрація (Сm або mB), моляльність – це відношення кількості молів νВ розчиненої речовини В (моль) до маси розчинника а (кг):
де а – маса розчинника, кг; b – маса розчиненої речовини, г; МВ – молярна маса розчиненої речовини, г/моль. Одномоляльний розчин – 1 моль речовини розчинений у 1 кг розчинника, моль/кг. Між молярною часткою розчиненої речовини NB і моляльністю Сm для водних розчинів існує співввідношення:
У біології, біохімії, медичній практиці за одиницю кількості речовини береться моль (моль, мкмоль, нмоль). Наприклад, рівень гемоглобіну в крові, вміст калію, натрію виражають у моль/л, вміст заліза – мкмоль/л. Для характеристики складу розчину в аналітичній практиці застосовують молярну масу еквівалента. Спочатку з’ясуємо згідно з СІ поняття молярної маси і фактора еквівалентності. Згідно з СІ поняття молярної маси речовини В (М(В)) є маса 1 моля цієї речовини. Вона дорівнює відношенню маси (m) речовини В до її кількості в молях: Фактор еквівалентності fекв – число, яке є оберненою величиною до еквівалентного числа z і показує, яка доля умовної частинки речовини В реагує з одним йоном гідрогену в певній кислотно-основній реакції або з одним електроном в певній окисно-відновній реакції. Значення фактора еквівалентності може змінюватися залежно від зміни реакції в якій бере участь певна речовина . Молярною масою еквівалента Мекв(B) називають масу 1 моля еквівалента цієї речовини, яка дорівнює добутку фактора еквівалентності на молярну масу речовини B: Мекв(B) = М(В)´fекв (г´моль-1) (3.7) Масова концентрація ρ – це відношення маси розчину (m р-ну) до загального об’єму (Vр-ну) і виражається у кг/м3, г/см3:
§3. Вода (гідроген оксид). За А.Сент-Дьєрдьї: “Вода не тільки mater (мати), але також і matrix (матриця) життя, і біологія, можливо, не досягла б тих вершин у розумінні найосновніших функцій через те, що вона концентрувала своє розуміння тільки на речовині у вигляді частинок, відділяючи їх від двох матриць – води і електромагнітного поля.” Для біологів, медиків, лікарів ветеринарної медицини особливу цінність мають рідкі розчини, де розчинником є вода. Адже біологічні рідини є дуже складні білково-, вуглеводно-, ліпідно-, сольові розчини, у яких присутня величезна кількість інших метаболітів у певних співвідношеннях. Фізико-хімічні закономірності взаємодії цих різноманітних за властивостями і розмірами частинок як між собою, так і з молекулами води є надзвичайно важливими для життєдіяльності організму. Вода забезпечує всмоктування і механічні переміщення поживних речовин, продуктів обміну в організмі. Вода, беручи участь у процесах набрякання, осмосу та ін., створює відповідну величину онкотичного тиску у крові і тканинах. Висока теплоємність, теплопровідність і теплота випаровування води зумовлює підтримання стабільної (нормальної) температури у теплокровних тварин. Будучи високополярною сполукою, вода викликає дисоціацію електролітів, бере безпосередню участь у гідролітичному розщепленні речовин, реакціях гідратації і в багатьох інших фізико-хімічних процесах. Утворення в організмі ендогенної води як кінцевого продукту обміну в результаті процесів біологічного окиснення супроводжується виділенням великої кількості енергії – близько 239,3 кДж/моль. Молекула води – електричний диполь, в якому віддаль між Оксигеном і Гідрогеном складає 0,0965 нм при 104,5º. Дипольний момент води μ = 1,86 D (6,1´10–30 Кл·М). Для води характерний водневий зв’язок, який значною мірою визначає її властивості та значення. Дипольний характер молекул води добре пояснює розчинність у ній полярних речовин, погану розчинність неполярних і властивості речовин з дифільною структурою. Так, у структурі молекули білка поряд з гідрофільними групами -SH, -COOH, -NH2, -ОН, є гідрофобні радикали СН3-(СН2)n-, С6Н5-, які краще взаємодіють між собою, ніж з молекулами води. Гідрофобні радикали, об’єднуючись, ніби “виштовхують” воду із зони свого розташування. Виникає зв’язок за типом “жирної краплі”, здатний брати участь у збереженні просторової конфігурації молекули у водному розчині.
§4. Дипольний момент. Діелектрична проникність. Полярність молекул характеризується дипольним моментом μ, що дорівнює добутку величини заряду q на віддаль між центрами зарядів l: μ = ql. (3.9) У таблиці 3.1 наведені дипольні моменти деяких речовин. Із неї видно, що дипольні моменти неполярних молекул (СО2, С6Н6) рівні нулю. Дипольний момент молекули Н2О досить високий, що обумовлює її властивості як доброго розчинника речовин, молекули яких також полярні. Таблиця 3.1. Дипольні моменти окремих речовин. Речовина μ, D C6H6 CO2 CH3COOH CH3-CH2-OH H2O 1,40 1,70 1,85
Для порівняння здатності речовин розчинятись у певних розчинниках більш зручним, ніж величина дипольного моменту є діелектрична проникність. Якщо між пластинами конденсатора помістити дипольні молекули, то вони, орієнтуючись в електричному полі, знизять його напруженість (рис. 3.1). Діелектрична проникність ε показує, у скільки разів напруженість поля Е з даною речовиною нижча, ніж у вакуумі:
де: ЕВ – напруженість у вакуумі, ЕС – напруженість поля в середовищі.
Рис. 3.1. Орієнтація диполь-них молекул в постійному електричному полі. Дипольний момент μ характеризує лише окремо взяті молекули, а діелектрична проникність – суміші, розчини різних речовин і концентрацій, тому і зручніша у практичному відношенні. Як видно із табл. 3.2, сеча, кров, біла речовина мозку мають високу діелектричну проникність, і чим вищий цей показник, тим кращим розчинником є ці речовини (табл. 3.3). Отже, біологічні рідини і тканини є добрими розчинниками полярних речовин. Таблиця 3.2. Діелектричні проникності деяких простих і складних речовин при 20ºС. Речовина ε Вакуум Гази і пари Хлороформ Холестерол Лецетин Ацетон Етанол Гліцерол Вода Сеча Кров Біла речовина мозку 1,0 ~1,0 4,05 5,2 13,0 21,5 27,5 56,2 80,4 82,8 85,0 90,0
Таблиця 3.3. Діелектричні проникності розчинників і розчинність деяких речовин при 18-20ºС. Речовина ε
|
||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 6; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.184.197 (0.019 с.) |

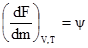 (1.44)
(1.44)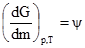 , (1.45)
, (1.45)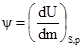 . (1.46)
. (1.46)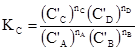 , (1.49)
, (1.49)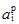 ):
):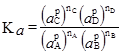 , (1.50)
, (1.50)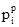 ) або рівноважні фугітивності (
) або рівноважні фугітивності ( 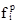 ) компонентів реакції:
) компонентів реакції: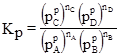 ;
; 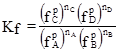 . (1.51)
. (1.51)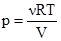 i замінити
i замінити 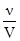 на с’, то отримаємо співвідношення між КP і КC:
на с’, то отримаємо співвідношення між КP і КC: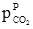 .
.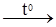 СаО+СО2↑). З іншого боку, при певній температурі і тиску речовини можуть одночасно перебувати в усіх агрегатних станах. При 0,0076ºС перебувають у рівновазі, тверда вода (лід), рідка вода і у газуватому вигляді пари при тиску 4,579 мм рт. ст. (6,1·102 Па).
СаО+СО2↑). З іншого боку, при певній температурі і тиску речовини можуть одночасно перебувати в усіх агрегатних станах. При 0,0076ºС перебувають у рівновазі, тверда вода (лід), рідка вода і у газуватому вигляді пари при тиску 4,579 мм рт. ст. (6,1·102 Па).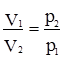 (2.1)
(2.1)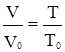 ,
,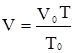 . (2.5)
. (2.5)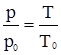 або
або 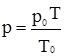 . (2.8)
. (2.8)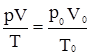 . (2.9)
. (2.9)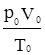 також величина стала. Її позначають R і називають універсальною газовою сталою.
також величина стала. Її позначають R і називають універсальною газовою сталою.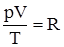 , або рV = RТ. (2.10)
, або рV = RТ. (2.10)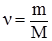 , то, рівняння Клапейрона-Менделєєва можна записати у вигляді:
, то, рівняння Клапейрона-Менделєєва можна записати у вигляді: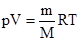 . (2.12)
. (2.12)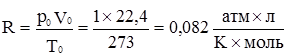 .
.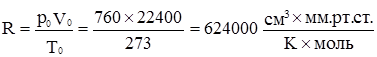 .
.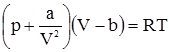 , (2.13)
, (2.13)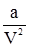 – величина міжмолекулярної взаємодії.
– величина міжмолекулярної взаємодії.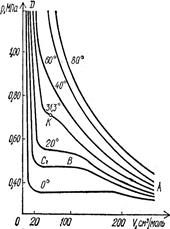
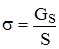 , (2.14)
, (2.14)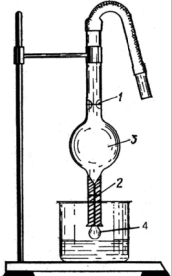
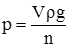 ,
,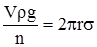 , (2.15)
, (2.15)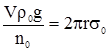 , (2.16)
, (2.16)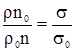 ,
,
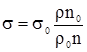 . (2.17)
. (2.17)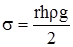 , (2.18)
, (2.18)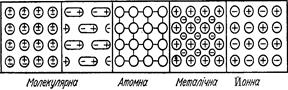
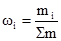 . (3.1)
. (3.1)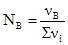 , (3.2)
, (3.2)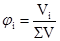 (3.3)
(3.3)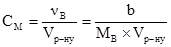 , (3.4)
, (3.4)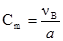 , або
, або 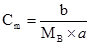 , (3.5)
, (3.5)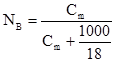 . Оскільки у розбавлених розчинах
. Оскільки у розбавлених розчинах 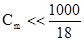 , то
, то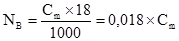 (3.6)
(3.6)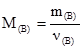 . Основна одиниця молярної маси – кг´моль-1. На практиці користуються г´моль-1.
. Основна одиниця молярної маси – кг´моль-1. На практиці користуються г´моль-1.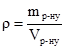 . (3.8)
. (3.8)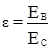 , (3.10)
, (3.10)