Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рис. 8.6. Періодичні осади в драглях.Содержание книги
Поиск на нашем сайте
Пепсин Казеїн Яєчний альбумін Альбумін сироватки крові α-глобулін крові β-глобулін крові γ-глобулін крові Міозин м’язів Гістон клітинних ядер 2,0 4,6 4,71 4,64 4,8 5,2 6,4 5,0 8,5
Вивчення ізоелектричних точок багатьох колоїдів організму тварини і людини викликає велику зацікавленість для діагностики захворювань та оцінки змін, що відбуваються в організмі, органах, тканинах, клітинах і субклітинних структурах. Мембранна рівновага Доннана. Присутність в організмі солей білків, відділених клітинною мембраною від розчинів електролітів, призводить до перерозподілу електролітів і відповідно впливає на осмотичний тиск по обидва боки мембрани. Цей перерозподіл підкоряється виведеному Доннаном рівнянню мембранної рівноваги. Якщо уявити собі клітину, яка знаходиться у розчині електроліту, наприклад NaCl, то всередині клітини знаходиться сіль білка, білкові йони якої не дифундують крізь мембрану: PtNaz ⇄ Ptz–+zNa+ (z – валентність молекули білка). При контакті клітини з розчином всередину її, внаслідок дифузії, переходить деяка кількість відсутніх там йонів Cl– (позначено через х). За йонами Cl– перейде така ж кількість йонів Na+, бо у протилежному випадку в результаті нерівномірного розподілу різнойменно заряджених йонів виникає електричне поле, яке перешкоджатиме дифузії йонів Cl–. Концентрацію йонів у клітині і у розчині до і після перерозподілу можна позначити так:
[Na+]Н = [Cl–]Н = CН [Na+]В = CВ
}
до перерозподілу;
[Na+]Н = [Cl–]Н = CН–x [Na+]В = CВ+x [Cl–]В = x
}
після перерозподілу, де В – електроліт всередині клітини; Н – електроліт ззовні клітини. У системі встановиться рівновага, при якій число йонів, яке переходить крізь мембрану в той і інший бік, буде однакове, а це можливо, якщо будуть рівні добутки їх концентрацій по обидва боки клітинної мембрани: [Na+]В[Cl–]В = [Na+]Н[Cl–]Н або (СВ+х)х = (СН–х)(СН–х). Таким чином: СВх+х2 = СВх = СВх+2СНх = х(СВ+2СН) =
Можливі три варіанти вихідного розподілу йонів по обидва боки мембрани. 1. Якщо до початку перерозподілу концентрація
тобто всередину клітини перейде приблизно половина йонів електроліту із зовнішнього середовища. Електроліт розподілиться порівну між внутрішнім і зовнішнім середовищем цієї системи. 2. Якщо до перерозподілу концентрація Na+ всередині була значно вищою, ніж зовні, тобто Сн << Св, то у рівнянні 3. Якщо СН = СВ, то рівняння
тобто у цьому випадку всередину переміститься третя частина йонів електролітів із зовні. Рівняння Доннана розглянуто для випадку, коли зовні є сіль, а всередині – тільки один із її йонів. Положення не зміниться, якщо у білка і електроліту поза клітиною немає спільного йона, наприклад у системі із РtKz і NaCl. При оцінці осмотичного тиску у тканинах слід враховувати перерозподіл електролітів. Присутність у клітинах солей білка суттєво впливає на цей перерозподіл. Отже, при зіткненні клітини з розчином електроліту в усіх випадках деяка кількість електроліту перейде в клітину, тому осмотичний тиск, що залежить від концентрації йонів електроліту плюс концентрації білка, завжди буде вищим, ніж у навколишньому розчині. Ця обставина зумовлює підтримання тургору клітини навіть в ізотонічних розчинах. Ефект Доннана (тобто нерівномірний розподіл електролітів між клітинами і омиваючою їх рідиною) чинить значний вплив на життєдіяльність клітин на величину біопотенціалів і т. п. Онкотичний тиск і його біологічне значення. Осмотичний тиск у розчинах колоїдів і полімерів, як і в істинних розчинах, пропорційний їх концентрації. Однак, у зв’язку з малою масовою концентрацією (менше 1,0%) колоїдів кількість частинок у розчині настільки мала, що осмотичний тиск дуже низький. Осмотичний тиск у розчинах білків та інших ВМС, концентрація яких досягає 10-12% і більше, достатньо високий і суттєво впливає на ряд процесів в організмі. Частина осмотичного тиску крові, обумовлена ВМС, в основному білками, називається онкотичним тиском (від грецьк. оnkos – об’єм, маса). У плазмі крові він складає лише 0,5% осмотичного тиску (0,003-0,004 МПа). Незважаючи на невелику частку онкотичного тиску в осмотичному, він має виключно велике значення для життя організму. Онкотичний тиск бере участь у розподілі води і розчинених у ній речовин між кров’ю і тканинами. Такий розподіл здійснюється капілярами. Володіючи напівпроникністю, стінка капіляра пропускає воду і розчинені у ній низькомолекулярні речовини. Стінка непроникна для білків плазми, які транспортують ці речовини. Швидкість такої фільтрації через стінку капіляра визначається різницею між онкотичним тиском білків плазми крові і гідростатичним тиском крові, який створює робота міокарда. Через артеріальний кінець капіляра розчин поживних речовин із крові потрапляє у міжклітинну рідину, а з неї – в клітини. Через венозний кінець капіляра процес має протилежний напрямок – продукти обміну речовин надходять у капіляр, венули і венозне русло. У перебігу цього процесу вирішальним є тиск крові, який із проходженням до артеріального кінця капіляра зменшується, а потім поступово зростає при переході у венозне русло. Онкотичний тиск крові на 80% пов’язаний з альбумінами і на 20% – з іншими білками плазми.
Зміна онкотичного тиску спостерігається при патологіях, особливо при захворюванні печінки, серцево-судинної системи, нирок. Зміни онкотичного тиску дуже виражені при гіпопротеїнемії, пониженому вмісті білка в сироватці крові через порушення білоксинтезуючої функції печінки і при голодуванні.
§4. Драглі. За певних умов розчини ВМС і деякі колоїдні системи здатні втрачати плинність і драгліти, утворюючи драглі. У драглях частинки дисперсної фази, сполучаючись між собою, формують сітчастий каркас, чарунки якого заповнені дисперсійним середовищем. Отже, драглі – це структуровані системи з властивостями еластичних твердих тіл. Драглеподібний стан речовини можна розглядати як проміжний між рідким і твердим станом. Цілий ряд речовин природного і штучного походження за певних умов можуть утворювати драглі. Ними є багато харчових і кормових продуктів (хліб, м’ясо, сир, кисле молоко, каші). Драглі відіграють велику роль у житті організмів, оскільки більшість їхніх тканин і клітин являє собою драглі. Драглі ВМС можна добути двома способами: методом драгління розчинів полімерів і методом набрякання сухих ВМС у відповідних рідинах. Драгління. Процес переходу золю або розчину полімеру в драглі називається драглінням (желатинуванням). Цей процес залежить від концентрації і природи речовин, температури, природи електролітів, реакції середовища. Підвищення концентрації колоїдного розчину збільшує кількість зіткнень частинок при броунівському русі, що зумовлює структуроутворення і прискорює процес драгління. Суттєве значення для желатинування має також природа речовин як гідрофобних золів, так і розчинів полімерів. Не всі гідрофобні золі можуть переходити у драглі; так, золі благородних металів: золота, платини, срібла – не здатні драгліти внаслідок особливої будови їх колоїдних частинок і низької концентрації їх золів. У розчині високомолекулярних сполук кількість і якість гідратованих та негідратованих груп в ланцюгах молекул впливає на їх здатність об’єднуватися в коміркову структуру. Мабуть, це пояснюється тим, що менш концентровані розчини гірше драгліють. Так, наприклад, мінімальна концентрація драгління для желатини рівна 0,5%, для агар-агару – 0,2%.
Значний вплив на драгління має температура. Добре сформовані драглі 6%-ного розчину желатини при нагріванні у теплій воді 45-50ºС легко розріджуються і переходять у розчин. Низькі температури сприяють драглінню, тому що при цьому прискорюється агрегація частинок і знижується розчинність речовин. Як на коагуляцію, так і на драгління впливає додавання електролітів. При цьому знижується ζ-потенціал, відбувається стискання дифузного шару і зменшення гідратної оболонки міцел, що зумовлює їх сполучення і утворення внутрішніх структур. Однак, електроліти по-різному впливають на швидкість драгління: одні із них прискорюють, інші гальмують, а деякі навіть повністю припиняють цей процес. На драгління, головним чином, впливають аніони (табл. 8.4). Аніони на драгління впливають у наступному порядку (так званий прямий ліотропний ряд Гофмейстера): SO42–>C6H5O73–>C4H4O62–>C2H4O2–>Cl–>NO3–>Br–>J–>CNS–. При одній і тій же концентрації розчинів високомолекулярних сполук, наприклад білків, драгління відбувається швидше, коли молекули білка не мають електричного заряду і менш гідратовані, тобто перебувають у ізоелектричному стані. Тому драгління найкраще відбувається при рН розчину, який відповідає ізоелектричній точці білка.
Таблиця 8.4. Вплив солей на драгління 5%-ного розчину желатини при 15ºС (рН=4,7). Електроліти Час драгління, хв Калій ацетат Натрій хлорид Калій хлорид Натрій йодид Калій йодид Натрій роданід Калій роданід відсутнє драгління відсутнє драгління
Під впливом механічних втручань драглі здатні розріджуватися, переходячи в золі, а потім у стані спокою знову драгліти. Ця властивість одержала назву тиксотропії (від. грецьк. tixis – струшування і tropo – зміна). Тиксотропні перетворення можуть бути повторені багато разів і відбуваються при сталій температурі. Явище тиксотропії можна спостерігати у бентонітних глинах, драглях гідроксиду заліза, желатини, агар-агару та ін. Набрякання. Збільшення об’єму полімеру в результаті вибіркового поглинання низькомолекулярного розчинника називається набряканням. Цей процес характеризується ступенем набрякання (8.1). На процес набрякання впливає температура, рН середовища, електроліти та ін. Зміни, що відбуваються під впливом цих факторів при набряканні, діаметрально протилежні їх впливу на швидкість драгління; так, наприклад, якщо підвищення температури негативно впливає на драгління, то набрякання в цих умовах відбувається навпаки, швидше, бо підвищення температури посилює рух частинок і сприяє розпушуванню внутрішніх структур.
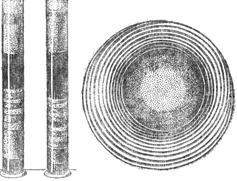
Зміна рН середовища у кислу чи лужну зони від ізоелектричної точки колоїду збільшує ступінь набрякання. Це пояснюється появою позитивних чи негативних зарядів у колоїдних частинок і, отже, підвищенням ступеня гідратації. Підвищення гідратації зумовлює розділення високомолекулярних частинок і в простір між ними починає проникати вода; підвищення величини заряду частинок збільшує електростатичні сили відштовхування між ними і також порушує цілісність структури полімеру. Вплив аніонів ряду Гофмейстера на драгління і набрякання протилежний. Механізм набрякання є складним. Існує багато різних теорій. Найбільше розповсюдження одержала осмотична теорія набрякання, за якою цей процес проходить у дві стадії. Перша стадія пов’язана з поглинанням малих кількостей розчинника, при цьому об’єм майже не змінюється. Приєднання рідини відбувається тільки на поверхні високомолекулярних сполук (інтермолекулярно). Друга стадія характеризується поглинанням основної кількості рідини, яка проникає всередину міжмолекулярних просторів (інтрамолекулярно). Цей період супроводжується максимальним зростанням об’єму в результаті осмотичного всмоктування розчинника. При цьому виникає тиск набрякання. Тиск набрякання. Тиск, що виникає при набряканні, може мати значну силу і переборювати великий опір. Велику силу тиску можна спостерігати при набряканні клина із сухого дерева, вбитого у тріщину кам’яної брили або дерева і потім змоченого водою. Але драглі володіють особливими фізико-хімічними властивостями. В них вільно відбувається дифузія електролітів та інших низькомолекулярних речовин. Враховуючи, що зв’язана вода у драглях складає від загальної її кількості тільки 25%, а 75% припадає на іммобілізований розчинник, дифузія в драглях відбувається приблизно з такою ж швидкістю, що і у воді. Зі збільшенням концентрації драглів зменшується коефіцієнт дифузії. Драглі, що містять електроліти, мають добру електропровідність. Ця властивість драглів використовується при виготовленні агар-агарових сифонів, наповнених KCl, необхідних при складанні гальванічних ланцюгів, у електрофорезі і т. п. Реакції, що відбуваються в драглях, мають ряд особливостей: відсутність швидкої і повної взаємодії між реагуючими речовинами уповільнює реакції. Крім того, при хімічних реакціях у драглях можна спостерігати періодичність відкладання осадів, які складаються із продуктів цих реакцій. Явищем періодичного відкладання осадів пояснюється виникнення багатошаровості у мінералів (агат та ін.). Мабуть, це має значення і при утворенні деяких багатошарових жовчних і ниркових каменів. Одержати періодичні осади в драглях досить просто, якщо приготувати драглі на розчині солі, яка потім при взаємодії з іншою сіллю в процесі реакції обмінного розкладу приведе до утворення осаду. Так, наприклад, якщо на драглі 3,5%-ної желатини, приготованої на розчині, що містить 0,12 г К2Cr2О7, після драгління в пробірці або в чашці Петрі нанести краплю 8,5%-ного розчину аргентум нітрату, то утворюється ряд дисків або кілець Ag2Cr2О7 (рис. 8.6). Суть цих явищ зводиться до того, що нанесений розчин солі AgNO3 дифундує в драглі і утворює осад при взаємодії з К2Cr2О7:
К2Cr2О7+2Ag NO3 → Ag2Cr2О7↓+2КNO3. У зону випадання осадів дифундує К2Cr2О7 і з нижчележачого шару, тому при подальшому русі AgNO3 попадає в зону з недостатньою концентрацією К2Cr2О7 і осад не утворюється. Ще нижче К2Cr2О7 міститься вже у достатній кількості, і там з’являється друга смуга осаду і т. д. Чим далі до периферії чашки або ближче до дна пробірки, тим чергування дисків і кілець стає рідшим через зменшення концентрації дифундуючого AgNO3.
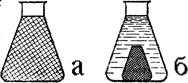
Драглі з часом змінюють свої властивості, і цей процес називається старінням драглів. При старінні на поверхні драглів з’являються крапельки рідини, які зливаються, утворюючи рідку фазу. Відбувається розділення драглів на дві фази: ущільнені драглі і розбавлений золь. Цей процес називається синерезисом (від грецького слова sinereiso – стягування, збирання). Тверда частина драглів стає менш прозорою, а рідка – містить невелику кількість дисперсної фази. При синерезисі, внаслідок збільшення числа контактів у частинок дисперсійної фази, відбувається ущільнення драглів при одночасному підвищенні еластичних і пружних властивостей. Структурна сітка драглів стягується і витискає із себе значну частину імобілізованого розчинника (рис. 8.7).
Рис. 8.7. Явище синерезису: а – драглі до синерезису, б – розділення драглів на дві фази. Швидкість синерезису різна, але звичайно зростає з підвищенням температури і концентрації. У білкових драглях синерезис залежить від рН; наприклад, для желатини він активніше проявляється в ізоелектричній точці. Біологічне значення процесів набрякання і старіння драглів. Набрякання має велике значення у процесах життєдіяльності рослинних і тваринних організмів. Проростанню зерна завжди передує попереднє набрякання. Рослинні і тваринні тканини зв’язують велику кількість води (наприклад, сполучна тканина) і містять колоїди не тільки у вигляді розчинів, а й у вигляді драглів (протоплазма клітин, кристалик ока та ін.). На набрякання і відмокання основної речовини і колагену сполучної тканини зміна рН середовища і концентрації солей чинять різний вплив. Так, якщо підвищується концентрація йонів водню в сполучній тканині, то її основна речовина набрякає незначно, колаген же при цьому набрякає дуже сильно. Ці ж фактори чинять протилежний вплив на набрякання і відмокання, з одного боку, сполучної тканини в цілому і, з другого боку, клітин. Так, при рН середовища, яке викликає набрякання клітин, вода потрапляє до них із “водного депо”- сполучної тканини, яка при цьому відмокає. Набрякання і відмокання колоїдів спостерігається також при різноманітних процесах: регенерації тканин, запаленні, при укусі комах і т. п. В усіх названих випадках набрякання залежить, головним чином, від змін у тканинах рН середовища. Біологічна роль процесів старіння драглів дуже важлива, тому що при цьому відбувається їх ущільнення, що неминуче відображається на проникності клітинних мембран і цитоплазми. Зниження проникності може порушити обмін речовин між клітиною і навколишнім середовищем. Явище синерезису спостерігається і в побуті. Так, у свіжовипеченому хлібі кількість зв’язаної води досягає 83%. Протягом п’яти діб зв’язаної води залишається 67%. Хліб почерствів, тобто втратив здатність зберігати воду. М’ясо молодих тварин соковитіше і ніжніше, ніж старих. Це пояснюється тим, що з віком тканини тварин через синерезис і дегідратацію твердішають. Прикладом позитивного синерезису може бути самочинне відокремлення рідини в процесі визрівання сиру при сироварінні.
|
|||||||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 11; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.179.27 (0.013 с.) |

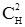 –2СНх+х2;
–2СНх+х2;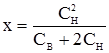 (рівняння Доннана).
(рівняння Доннана).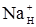 була значно вища, ніж всередині клітини, тобто якщо СН >> CВ, то у рівнянні Доннана у знаменнику можна знехтувати малою величиною доданка СВ. Тоді:
була значно вища, ніж всередині клітини, тобто якщо СН >> CВ, то у рівнянні Доннана у знаменнику можна знехтувати малою величиною доданка СВ. Тоді: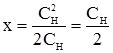 ,
,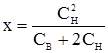 у чисельнику буде мала величина. При діленні одержимо ще меншу частку. Таким чином, і в цьому випадку всередину клітини прийде певна частина йонів електроліту (ця кількість залежить від співвідношення СН і СВ).
у чисельнику буде мала величина. При діленні одержимо ще меншу частку. Таким чином, і в цьому випадку всередину клітини прийде певна частина йонів електроліту (ця кількість залежить від співвідношення СН і СВ).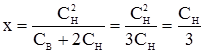 ,
,