Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Величини депресії деяких біологічних рідин.Содержание книги
Поиск на нашем сайте
Е К Вода Ацетатна кислота Етанол Пропанон Бензен Хлороформ Камфора 0,516 3,07 1,23 1,48 2,57 3,88 - 1,86 3,9 - 2,4 5,12 4,90 40,49
E води свідчить, що розчинення 1 моля речовини у 1 кг води підвищує температуру кипіння на 0,516 K. Згідно з
Кріоскопічна стала (K) води показує, що розчинення 1 моля речовини у 1 кг води знижує температуру замерзання на 1,86 К. Отже:
В обох випадках b і М – маса (г) і молярна маса розчиненої речовини (г/моль); а – маса розчинника, кг; розмірність Е і К – К·кг·моль–1. ΔТ3 для деяких біологічних рідин наведено у таблиці 3.6. Таблиця 3.6. Величини депресії деяких біологічних рідин. Рідина ΔТ3 Кров Слина Шлунковий сік Жовч Піт Молоко Сік підшлункової залози Спинно-мозкова рідина 0,56 0,09-0,24 0,46-0,54 0,54-0,61 0,13-0,50 0,55-0,59 0,60-0,67 0,55-0,60
Якщо розчинення речовин пов’язане з дисоціацією (або асоціацією) молекул цієї речовини, то у ΔТК = ЕСm i ΔТ3 = KCm слід вводити ізотонічний коефіцієнт Вант-Гоффа: ΔТК = іЕCm; (3.29) ΔТ3 = іKCm. (3.30) Розчинам електролітів властиві основні властивості розчинів неелектролітів. Однак, у розчинах електролітів відсутня та пропорційність між молярною концентрацією і осмотичним тиском, підвищенням температури кипіння, пониженням температури замерзання, яка є у розчинах неелектролітів. У розчинах електролітів осмотичний тиск і температура кипіння вищі, а темпреатура замерзання нижча, ніж слід було б очікувати, виходячи із молярних концентрацій. Причина цих відхилень полягає у дисоціації електролітів, в результаті чого у розчинах виявляється більше число кінетично активних частинок (сума молекул і йонів), ніж у еквівалентних розчинах неелектролітів. Вант-Гофф ввів поправку – коефіцієнт і. Коефіцієнт Вант-Гоффа показує, у скільки разів істинна концентрація кінетично активних частинок і, отже, осмотичний тиск, зниження температури замерзання, підвищення температури кипіння, зниження тиску пари у розчині електроліту більше, ніж у еквівалентному розчині неелектроліту:
Теоретично коефіцієнт Вант-Гоффа визначають так: наприклад, у воді (розчиннику) розчинилося N молекул речовини, із яких n продисоціювали на йони. Залишилося недисоційованих молекул N–n. Молекула дисоціює на 2, 3, 4 і більше йонів – m. Позначають кількість утворених йонів – nm. Загальне число частинок у розчині складається із числа молекул, які не дисоціювали, і числа утворених йонів: (N–n)+mn або N+n(m–1). Коефіцієнт і визначають співвідношенням двох концентрацій (3.31). Підставляють розраховані дані, наприклад, для концентрації частинок:
де α – ступінь йонізації розчиненої речовини, виражена у частках одиниці. Закон Рауля є основою для експериментальних методів визначення молярних мас розчинених речовин. Методи ґрунтуються на підвищенні температури кипіння – ебуліометрії, і на зниженні температури замерзання розчинів – кріометрії:
Для розчинів електролітів:
Властивість розчинених речовин знижувати температуру замерзання води використовується у практиці для приготування так званих антифризів. Це водні розчини деяких неорганічних і органічних речовин, які замерзають при низьких температурах і застосовуються як охолоджувальні засоби для автомобільних двигунів. Так, 55%-ий розчин етиленгліколю не замерзає при –40ºС. Зниження температури замерзання розчинів дає можливість зберігати овочі і фрукти при –1ºС, бо температура замерзання цитозолю нижча від цієї температури через вміст у ньому значних концентрацій органічних речовин.
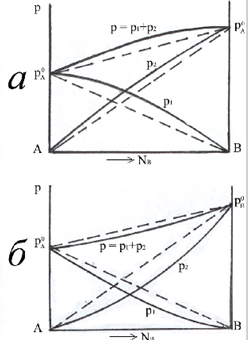
§7. Неідеальні розчини. Хімічний потенціал компонента в ідеальномі і реальному розчині. Неідеальними (реальними) називаються розчини, утворені компонентами (А і В), у яких сили взаємодії між однорідними і різнорідними молекулами (А-А, В-В і А-В) неодинакові. Реальні розчини не підкоряються законам ідеальних розчинів. Відхилення можуть бути як позитивні так і негативні. Якщо тиск пари над реальним розчином більший, ніж над ідеальним розчином такого ж складу, відхилення від закону Рауля називають позитивними, а якщо менший - негативним.
|
||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 6; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.99.134 (0.007 с.) |

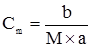 та з (3.26), випливає:
та з (3.26), випливає: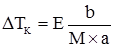 . (3.27)
. (3.27)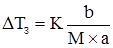 . (3.28)
. (3.28)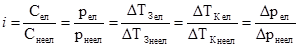 . (3.31)
. (3.31)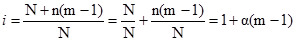 ,
,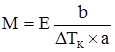 ; (3.32)
; (3.32)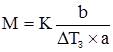 . (3.33)
. (3.33)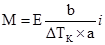 ; (3.34)
; (3.34)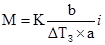 . (3.35)
. (3.35)