Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Наследственный микросфероцитозСодержание книги
Поиск на нашем сайте
ХРОНИЧЕСКИЙ ЛИМФОЛЕЙКОЗ Хронический лимфолейкоз (ХЛЛ) — лимфопролиферативное заболевание, при котором наблюдается повышенное образование морфологических зрелых лимфоцитов, являющихся субстратом опухоли. Однако эти лимфоциты функционально неполноценны, что проявляется в нарушении иммунной системы, повышенной склонности к аутоиммунным реакциям и инфекционно-септическим заболеваниям. ХЛЛ — наиболее часто встречающийся в практике врача лейкоз; он составляет 30 % от числа всех лейкозов человека. В 95 % случаев ХЛЛ имеет В-клеточное происхождение и только в 5 % случаев Т-клеточное. ХЛЛ никогда не встречается у детей, большинство больных — пожилые люди, при этом мужчины болеют в 2 раза чаще женщин. Имеется наследственно-конституциональная предрасположенность к заболеванию. Этиология.В происхождении ХЛЛ большое значение имеют наследственная предрасположенность и нарушения иммунологической реактивности. Источник опухоли — клетка-предшественница лимфопоэза. В большинстве случаев субстратом опухоли являются В-лимфоциты, однако в ряде случаев — Т-лимфоциты и 0-лимфоциты. Патогенез.Выделяют следующие патогенетические особенности ХЛЛ: 1) отсутствуют признаки опухолевой прогрессии (большая редкость 2) нет выраженного морфологического атипизма опухолевых клеток 3) нет хромосомных аномалий — цитогенетического критерия злока 4) отсутствует связь с мутагенными факторами (в частности, с иони 5) болезнь развивается в определенных этнических группах, имеет 6) выявляются расстройства иммунитета (гуморального и клеточ Классификация.В развитии заболевания выделяют три стадии. • Начальная — умеренная лимфаденопатия, умеренное увеличение • Развернутая (выраженные клинико-гематологические проявления) — • Терминальная — истощение, рефрактерность к проводимой тера Кроме указанной стадийности заболевания, выделяют следующие клинические варианты ХЛЛ: доброкачественную и прогрессирующую формы болезни. При доброкачественной форме отмечают незначительное увеличение числа лимфоцитов в крови, очаговый (не диффузный) рост лимфоид-ной ткани в костном мозге, невысокое содержание пролимфоцитов. При прогрессирующей форме количество лимфоцитов в крови резко увеличено, в костном мозге имеется диффузная лимфоидная пролиферация. В зависимости от особенностей клинической картины болезни выделяют следующие варианты ХЛЛ [Воробьев А.И., 1994]: • опухолевый (периферические лимфатические узлы резко увеличе • селезеночный — в клинической картине доминирует значительное • костномозговой — все изменения (лимфоидная гиперплазия) лока • «волосатоклеточный» ХЛЛ — при микроскопическом исследовании Подобное классифицирование позволяет более четко индивидуализировать больных, а также определять рациональную тактику лечения. Клиническая картина.В клинической картине выделяют два больших синдрома. Лимфопролиферативный, обусловленный лимфаденопатией, сплено-мегалией и лимфоидной пролиферацией костного мозга: а) общие симптомы, обусловленные интоксикацией, разрастаниями б) увеличение селезенки и печени; в) лейкемические инфильтраты в коже (лейкемиды); г) симптомы, связанные с увеличением регионарных лимфатических д) характерные изменения в костном мозге и периферической крови. Синдром осложнений: а) гнойно-воспалительных; б) аутоиммунных (аутоиммунная гемолитическая анемия). Различная выраженность синдромов на тех или иных стадиях болезни, вариант течения ХЛЛ определяют разнообразную клиническую картину. Все это приводит к тому, что на одних и тех же этапах диагностического поиска у больных ХЛЛ можно получить самую разнообразную информацию. На I этапе диагностического поиска можно не получить никакой информации в начальной стадии развития болезни. Однако больные обычно достаточно рано сообщают об увеличении поднижнечелюстных и шейных лимфатических узлов, затем подмышечных и паховых. Прогрессирование болезни приводит к их дальнейшему увеличению, что доставляет известные неудобства больному, точно так же, как и тяжесть в левом подреберье, обусловленная увеличением селезенки. Повышение температуры тела, потливость, снижение массы тела, носовые кровотечения, подкожные геморрагии — все эти симптомы появляются в развернутой клинико-гематологической стадии болезни. Повышение температуры тела с преходящей желтухой обычно свидетельствует о развитии аутоиммунного гемолитического криза. Ухудшение общего состояния (повышение температуры тела, появление кашля с выделением мокроты, болей в боку) возможно и при развитии легочных осложнений. Наконец, сведения, сообщаемые больным о ранее проводившемся лечении (прием лейкерана, хлорбутина в различных дозах), указывают не только на существо заболевания, но и косвенно на его стадию. На II этапе диагностического поиска можно получить информацию, во многом проясняющую диагностику. Прежде всего обнаруживают увеличенные лимфатические узлы и селезенку (реже увеличение печени). Такие симптомы, как бледность с легким желтушным оттенком кожи, подкожные геморрагии, похудание, прямого диагностического значения не имеют, но их наличие знаменует либо обострение течения ХЛЛ, либо переход болезни в терминальную стадию. Распространенная лимфаденопатия в сочетании со спленомегалией (часто и с другими симптомами) позволяет предположить ХЛЛ. Окончательный диагноз можно поставить только на III этапе диагностического поиска. При исследовании периферической крови обнаруживают лейкоцитоз со значительно увеличенным содержанием лимфоцитов (до 80 — 90 %), лимфоциты малого размера с узкой полоской цитоплазмы. Очень характерно появление в мазке телец (теней) Боткина — Гумпрехта (раздавленные при приготовлении мазка неполноценные лимфоциты). При высоком лимфоцитозе можно отметить появление единичных пролимфоцитов, реже — единичных лимфобластов. Распространение лимфоидной ткани в костном мозге может длительно не угнетать продукцию эритроцитов и тромбоцитов. Даже при лейкоцитозе 100109/л анемия и тромбоцитопения могут отсутствовать. Они появляются лишь в терминальной стадии. Если эти симптомы преходящи, то следует думать об обострении лейкемического процесса в рамках развернутой (клинико-гематологической) стадии. В пунктате костного мозга выявляется увеличенное содержание лимфоцитов (более 30 %). Этот признак является патогномоничным для ХЛЛ. В пунктате селезенки и лимфатического узла 95—100 % клеток составляют лимфоциты, имеются единичные пролимфоциты и лимфо-бласты. Особенности течения ХЛЛ. ■ Склонность к аутоиммунным конфликтам, вызванным появлением ■ Переход ХЛЛ в терминальную стадию чаще характеризуется раз ■ Доброкачественная форма ХЛЛ протекает с отсутствием симптомов Лечение. Комплекс лечебных мероприятий с учетом клинической картины и развития осложнений представлен в табл. 16. Таблица 16. Комплекс лечебных мероприятий при хроническом лимфолейкозе
Лечебные средства и мероприятия
Лечение аутоиммунных конфликтов (гемолитическая анемия, тромбоцитопения) Борьба с инфекционными осложнениями Стимуляция защитных сил организма Первично-сдерживающая терапия, курсовая химиотерапия, поддерживающая терапия, полихимиотерапия Гормональная терапия, спленэктомия Антибиотикотерапия Ретаболил, витамины, у-глобулин, тактивин, а-интерферон и др.
а) при отсутствии клинических симптомов, общем хорошем самочувствии (несмотря на клинически ясный диагноз) следует ограничиться мероприятиями общего характера: режим труда и быта, достаточное содержание витаминов в пище, запрещение инсоляции и перегревания, избегание контакта с гриппозными больными и пр.; б) если наблюдается увеличение лимфатических узлов и селезенки, в) курсовая химиотерапия тем же препаратом проводится при от г) по достижении клинического и гематологического эффекта пере д) полихимиотерапию проводят в виде комплекса цитостатических • При аутоиммунном конфликте (гемолитическая анемия, тромбоци- • В случае развития инфекционных осложнений назначают антибио При ХЛЛ антибиотикотерапию следует сочетать со средствами, повышающими защитные силы организма (у-глобулин, тактивин, а-интерфе-рон). Гемотрансфузии проводят при выраженных анемических состояниях, не купирующихся приемом препаратов железа, а также в терминальной стадии или при торпидно текущих инфекционных процессах. • В последние годы в терапии особой формы ХЛЛ («волосатоклеточ- Прогноз.Длительность жизни в отдельных случаях достигает 15 — 20 лет, после начала химиотерапии (при прогрессировании болезни) — обычно не превышает 4 — 6 лет. Профилактика.Методов предупреждения развития ХЛЛ не существует. Однако родственникам больных следует избегать контактов с химическими веществами, инсоляции. Больным ХЛЛ проводится вторичная профилактика, заключающаяся в предупреждении обострений болезни. МНОЖЕСТВЕННАЯ МИЕЛОМА Множественная миелома (ММ), обозначаемая ранее как мие-ломная болезнь или плазмоцитома, — опухоль, возникающая на уровне ранних предшественников В-лимфоцитов, при этом моноклональный пул потомков первично трансформированной клетки сохраняет способность к дифференцировке до конечного этапа — плазматических клеток, секрети-рующих иммуноглобулины. Следовательно, субстратом опухоли являются плазматические клетки (отсюда происходит и более раннее ее обозначение — плазмоцитома). Так как опухоль продуцирует патологический иммуноглобулин — парапротеин, то ее относят к группе парапротеинемичес-ких гемобластозов. Однако учитывая то, что опухоль происходит из ранних предшественников В-лимфоцитов, ее относят к группе лимфопроли-феративных заболеваний. ММ наиболее часто встречается у лиц на пятом-шестом десятилетии (у детей ММ неизвестна); в молодом возрасте (до 40 лет) заболевание встречается крайне редко, ею одинаково часто болеют мужчины и женщины. ММ не считается редкой патологией, ее частота составляет около 1/В всех лейкозов. Этиология.Причины заболевания, как и этиология опухолей вообще, неизвестны. Патогенез.В основе заболевания лежит пролиферация плазматических клеток организма. Плазмоцит (плазматическая клетка) происходит из коротко живущих В-лимфоцитов и обладает способностью вырабатывать неограниченное количество антител, специфических для практически любого антигена. Однако при ММ все клетки, составляющие массу опухоли, происходят из одной клетки клона, потомки которой повторяют функцию клетки-родоначальницы и секретируют в большом количестве иммуноглобулин лишь одной структуры (моноклоновый иммуноглобулин). Количество нормальных плазматических клеток уменьшается, соответственно уменьшается и содержание нормальных иммуноглобулинов, выполняющих функцию антител. В связи с этим возникает иммунодефицитное состояние, способствующее развитию инфекционных осложнений. Первоначально опухоль локализуется в костном мозге, в дальнейшем опухолевые клетки (плазмоциты) метастазируют в органы (селезенку, печеньУ Увеличенное количество плазматических клеток в костном мозге в дальнейшем вытесняет эритробластический и миелоцитарный ростки костного мозга. Классификация.Современная классификация [Андреева Н.Е., 1998] основана на двух положениях: объем опухолевой ткани (стадии течения) и активность патологического процесса (степень «агрессивности» гемо-бластоза). I стадия — НЬ более 10 г/л, нормальный уровень Са в сыворотке II стадия — показатели средние между таковыми в I и III стадиях III стадия — уровень НЬ менее 85 г/л, уровень Са сыворотки вы «Активность» патологического процесса определяется следующим образом: • «тлеющая» ММ («малоагрессивная» — без признаков прогрессиро- • медленно прогрессирующая; • быстро прогрессирующая — «агрессивная». Все эти показатели не только помогают оценить особенности патологического процесса, но и позволяют назначать более адекватную терапию. Анатомически (на основании данных рентгенологического исследования скелета и цитологического и патоморфологического анализа пунктатов и трепанатов костей) выделяют следующие формы ММ: наиболее частую — диффузно-очаговую (около 60 % больных), диффузную (24 %), множественно-очаговую (15 %), редкие формы (склерозирующая, преимущественно висцеральная — 1 %). Выделение анатомических форм оправдано с точки зрения возможностей при первой же стернальной пункции получить субстрат болезни (увеличенное количество плазматических клеток). Клиническая картина.Проявления болезни определяются наличием нескольких больших синдромов — костномозгового, белковой патологии, висцерального. Костномозговой синдром обусловлен пролиферацией в костном мозге миеломных клеток, что приводит к разрушению костного вещества. В первую очередь деструктивные процессы (остеопороз, остеолиз) развиваются в плоских костях и позвоночнике; иногда первые очаги разрушения определяются в проксимальных отделах трубчатых костей. Гиперплазия костного мозга вследствие разрастания миеломноклеточных скоплений приводит также к вытеснению миелоидных элементов. В результате перечисленных процессов развиваются: а) остеопороз, патологические переломы, гиперкальциемия; б) анемия, лейкопения, тромбоцитопения (реже) в периферической в) в костном мозге выявляется миеломноклеточная метаплазия. Синдром белковой патологии обусловлен гиперпродукцией моноклоно-вого парапротеина плазматическими клетками и уменьшением продукции нормальных иммуноглобулинов и чрезвычайно разнообразен в своих проявлениях. Синдром белковой патологии включает в себя следующие признаки: а) миелоидная нефропатия; б) параамилоидоз; в) геморрагический диатез; г) синдром повышенной вязкости; д) периферическая нейропатия; е) синдром недостаточности антител (с развитием инфекционных ос Миелоидная нефропатия — наиболее частое и серьезное проявление парапротеинемии. Она приводит к почечной недостаточности, которая занимает одно из первых мест среди причин смерти больных. В основе развивающейся почечной недостаточности лежит нефросклероз. Его причиной является реабсорбция в канальцах белка, который в большом количестве фильтруется в клубочках вследствие того, что в крови значительно увеличено количество белка (за счет парапротеина). Реабсорбируемый парапротеин инфильтрирует ткань почки, способствуя развитию склероза. Доказано также раннее вовлечение в патологический процесс базальной мембраны и мезангиума, а также капилляров клубочков с их последующим склерозированием. Клинические проявления миелоидной нефропа-тии складываются из упорной (иногда многолетней) протеинурии и постепенно развивающейся хронической почечной недостаточности. Особенностью поражения почек является отсутствие отеков и симптомов сосудистых поражений (артериальной гипертензии, ретинопатии). Параамилоидоз — тканевый парапротеиноз, встречающийся в 15 % случаев. В отличие от классического вторичного амилоидоза поражает органы, богатые коллагеном: сосуды (адвентицию), сердце, язык, суставы и сухожилия. Печень, селезенка и почки не страдают. Параамилоидоз не всегда имеет клинические проявления и часто является лишь патологоана-томической находкой. Тем не менее в ряде случаев можно обнаружить макроглоссию, прогрессирующую сердечную недостаточность, упорные боли в суставах с их деформацией. Прижизненный диагноз труден, необходима биопсия кожи, слизистых оболочек (рта, прямой кишки), лимфатических узлов и мышц. Геморрагический синдром — явление редкое; кровоточивость из сосудов слизистых оболочек и кожи обусловлена тем, что парапротеин как бы «окутывает» тромбоциты, затрудняя их адгезию и агрегацию. Синдром повышенной вязкости — нарушение микроциркуляции вследствие высокой гиперпротеинемии — проявляется геморрагической ретинопатией, расширением вен сетчатки, нарушениями периферического кровотока вплоть до акрогангрены. При охлаждении тела эти явления могут усиливаться (выпадение криоглобулинов). Периферическая нейропатия встречается в 5 % случаев и выражается в нарушениях тактильной и болевой чувствительности, парестезиях. Гистологическое исследование выявляет дегенеративные изменения нервных волокон. Синдром недостаточности антител обусловлен резким снижением уровня нормальных иммуноглобулинов вплоть до полного их исчезновения. Вторичная гипогаммаглобулинемия приводит к выраженной склонности больных к инфекционным осложнениям, в особенности со стороны мочевыводящих путей и бронхолегочного аппарата. Висцеральный синдром заключается в лейкемической инфильтрации внутренних органов (главным образом печени и селезенки). В 5—12 % случаев при жизни больных выявляют гепато-, спленомегалию. Опухолевые плазмоклеточные инфильтраты могут обнаруживаться практически во всех внутренних органах, но они редко проявляют себя клинически и обычно являются патологоанатомическими находками. Различная выраженность перечисленных синдромов и степени нарушений белкового обмена обусловливает чрезвычайную вариабельность течения болезни. Можно наблюдать больных с несомненной ММ, предъявляющих небольшое число жалоб или вообще не отмечающих никаких болезненных расстройств, и больных, нуждающихся в проведении постоянной терапии и утративших трудоспособность (глубоких инвалидов из-за патологических переломов, прежде всего компрессионных переломов позвоночника). Болезнь можно обнаружить на разных стадиях ее течения, однако у ряда больных, особенно среди рано выявленных, можно выделить две ста- дии болезни: 1) относительно доброкачественную, характеризующуюся соматической компенсацией, отсутствием или медленным прогрессирова-нием остеодеструктивного процесса, нормальными показателями крови, стабильно невысокими показателями патологического иммуноглобулина (парапротеина), сохранностью нормальных иммуноглобулинов; 2) быс-тропрогрессирующую, когда нарастают разрушения костей, появляются метастазы во внутренние органы, уровень парапротеина резко повышается, а нормальных иммуноглобулинов резко снижается вплоть до развития выраженной гипогаммаглобулинемии; появляются анемия, лейкопения, высокий плазмобластоз. Все сказанное обусловливает получение самых различных данных на всех этапах диагностического поиска. На I этапе диагностического поиска в начальной стадии болезни больные могут не предъявлять жалоб и болезнь диагностируется после соответствующего обследования в связи со случайным обнаружением проте-инурии или значительно увеличенной СОЭ (диспансеризация, обращение к врачу по иным причинам), что обычно отмечается в 20 % случаев. Больные могут отмечать, что у них в течение многих лет отмечается увеличение СОЭ (иногда довольно значительное — до 50 — 60 мм/ч). При этом подробное обследование (как правило, направленное на выявление злокачественной опухоли самой различной локализации) не выявляло причины болезни, однако стернальную пункцию или трепанобиоп-сию не проводили. В половине случаев болезнь дебютирует слабостью, повышенной утомляемостью, снижением массы тела и болями в костях. Иногда болезнь сразу же проявляет себя сильными болями в костях или переломами (ребра, гребешок подвздошной кости, компрессионный перелом позвонков). Часто больные отмечают вялотекущие пневмонии, которые нередко рецидивируют и плохо поддаются лечению антибиотиками. Отмечаются также заболевания мочевыводящих путей (циститы, пиелиты), проявляющиеся дизурическими расстройствами, упорным субфебрилитетом. В анамнезе больных могут быть также указания на проводимую ранее терапию цитостатическими препаратами, а также сеансы плазмафереза, после чего состояние улучшалось. На II этапе диагностического поиска в начальных стадиях болезни нередко не обнаруживаются никакие патологические изменения. В развернутой стадии болезни иногда выявляются нарушения, обусловленные указанными выше синдромами (костномозговым, висцеральным, белковой патологии), однако это не следует считать абсолютно обязательным. При вялотекущих пневмониях можно обнаружить участки пневмосклероза в виде укорочения перкуторного звука, стойких влажных звонких мелкопузырчатых хрипов. Как правило, отмечается болезненность при поколачи-вании плоских костей; при их деструкции (патологические переломы) обнаруживаются участки резкой болезненности, сочетающиеся с нарушением функции пораженной кости. Снижение массы тела, субфебрилитет, повышенная потливость — это неспецифические симптомы. Следует сказать, что необнаружение на II этапе диагностического поиска симптомов, обусловленных вышеперечисленными синдромами, отнюдь не отвергает предположение о ММ, но свидетельствует об отсутствии грубых изменений со стороны пораженных органов и систем. III этап диагностического поиска является решающим для постановки диагноза. При исследовании периферической крови при ММ не обнаруживается ничего специфического. У всех больных по мере прогрессирования болезни развивается анемия, патогенез которой, по-видимому, связан с вытеснением нормального кроветворения растущей опухолью. Однако прямой зависимости между степенью анемии и величиной костных поражений нет. Число лейкоцитов и лейкоцитарная формула обычно нормальны, иногда имеется нейтропения с относительным лимфоцитозом, реже умеренный нейтрофилез со сдвигом лейкоцитарной формулы влево и появлением молодых форм гранулоцитарного ряда. При прогрессировании заболевания отмечаются выраженные лейко- и нейтропения, особенно в связи с лечением цитостатическими препаратами. Часто встречается абсолютный моноцитоз. Мегакариоцитарный аппарат и тромбоцитопоэз обычно долгое время не изменены. На ранних стадиях иногда бывают гипертромбоцитоз и увеличение числа мегакариоцитов в пунктате костного мозга. Отмечается значительное увеличение СОЭ (до 60 — 80 мм/ч). Стернальная пункция и анализ миелограммы обнаруживают отчетливую миеломноклеточную пролиферацию (количество миеломных опухолевых клеток более 10 %). Если диффузного поражения костного мозга нет (имеется лишь «гнездное» поражение), миелограмма может оставаться нормальной. В этой ситуации при наличии подозрений на плазмоцитому (остеолитичес-кие очаги, моноклональная Ig-патия) необходимо проводить повторные проколы грудины в разных участках, пунктировать или трепанировать гребешок подвздошной кости, проводить пункции в местах остеолитичес-ких дефектов или костных опухолей. При биохимическом исследовании закономерно выявляется гиперпро-теинемия: общий белок достигает 10 — 12 г/л. При электрофоретическом исследовании выявляется дополнительная фракция (М-градиент) в области у-глобулиновой фракции, при этом количество у-глобулинов резко снижено. Эта дополнительная фракция является отражением большого количества парапротеина в крови. При исследовании содержания иммуноглобулинов отмечается резкое увеличение какого-либо класса иммуноглобулинов (IgA, G, Е или D, но не IgM, что свойственно макроглобулинемии Вальденстрема, другому парапротеинемическому гемобластозу, обусловленному гиперплазией короткоживущих В-лимфоцитов). При иммуноэлектрофорезе удается провести более детальное типиро-вание парапротеина при миеломной болезни: определяют класс тяжелых цепей парапротеина — A, G, Е или D, а также тип легких цепей — к (каппа) или А, (ламбда). Может быть также особый вариант ММ — так называемая миелома Бене-Джонса, парапротеин которой состоит лишь из легких цепей (микромолекулярный вариант болезни). В моче достаточно часто может определяться протеинурия, выраженная в различной степени. При миеломе Бене-Джонса в моче определяется белок Бене-Джонса, нагревание мочи приводит к выпадению белка в осадок, но дальнейшее нагревание ведет к его растворению. При рентгенологическом исследовании костей можно обнаружить изменения в плоских костях (особенно в костях черепа) в виде круглых просветлений костной ткани, представляющих участки резорбции костной ткани. Можно выявить также переломы костей, в особенности компрессионные переломы тел позвонков. Следует помнить, что не существует специфических изменений скелета, характерных для ММ. Отсутствие остеодеструкций не исключает ММ, а их наличие недостаточно для постановки диагноза (для этого нужны другие признаки, о чем будет сказано ниже). Гиперкальциемия встречается в 20 —40 % случаев, чаще в терминальных стадиях болезни, особенно при наличии хронической почечной недостаточности. При хронической почечной недостаточности отмечаются все ее лабораторные признаки (снижение плотности мочи, падение клубочковой фильтрации, увеличение уровня креатинина крови). Диагностика.Для постановки диагноза ММ необходимо иметь два критерия: 1) плазмоклеточную инфильтрацию костного мозга (плазмоцитов более 2) моноклональную Ig-патию (сывороточный М-компонент и/или Стернальная пункция у подавляющего большинства больных обнаруживает отчетливую миеломноклеточную пролиферацию — 10 % и более плазматических клеток. При множественно-очаговой форме морфологически подтвердить диагноз иногда не удается, в этом случае диагноз можно поставить лишь при наличии высокой парапротеинемии (более 30 г/л за счет патологических IgG, A, D, Е при одновременном снижении содержания нормальных иммуноглобулинов). Методом иммуноэлектрофореза, как уже упоминалось, проводится определение класса тяжелых цепей и типа легких цепей парапротеина. Парапротеин является абсолютным маркером заболевания и его выявление совершенно обязательно. Трудности в диагностике ММ возникают в ранних ее стадиях, когда отсутствует костная деструкция, нет отчетливой миеломноклеточной метаплазии костного мозга, М-градиент при электрофорезе белков сыворотки невелик и нет выраженного снижения содержания у-глобулинов. Эти стадии течения ММ неотличимы от так называемых эссенциальных (при беременности, у лиц пожилого возраста) и симптоматических (при циррозе печени, диффузных заболеваниях соединительной ткани, злокачественных опухолях, сепсисе) моноклональных гаммапатий. Тщательное исследование позволяет исключить реактивную гаммапатию; этому способствует также динамическое наблюдение за больными. Следует помнить, что на ранних стадиях болезни, когда больной попадает в поле зрения врача, правильный диагноз может быть поставлен через несколько лет после обнаружения парапротеина в сыворотке крови. Дифференциальная диагностика.ММ необходимо дифференцировать от макроглобулинемии Валъденстрема. Это заболевание представляет собой одну из опухолей лимфатической системы и рассматривается в рамках парапротеинемических гемобластозов, так как речь идет о пролиферации в системе лимфоцитов — источника продукции одного из классов иммуноглобулинов — IgM. Этим заболеванием страдают преимущественно мужчины (до 70 %) в возрасте около 60 лет. Клиническая картина чрезвычайно сходна с ММ и обусловливается лейкемической пролифера- цией лимфоидных элементов в костном мозге, печени, селезенке, лимфатических узлах, накоплением в сыворотке крови парапротеина, тяжелая цепь которого относится к классу «М». Костно-деструктивный процесс развивается редко, обычно нет болевого синдрома, напротив, гепато-, спленомегалия характерны для этой болезни. Увеличение печени, селезенки, лимфатических узлов связано с разрастанием лимфатических элементов. Картина костного мозга характеризуется увеличением лимфоцитов, однако увеличено и количество плазматических клеток. Все остальные синдромы при макроглобулинемии Вальденстрема достаточно выражены, но в отличие от ММ поражение почек встречается редко, что, вероятно, связано с отсутствием гиперпротеинемии, протеинурии. Главным же отличием является обнаружение парапротеина класса IgM. Лечение.Современная терапия ММ включает цитостатические средства (химиопрепараты, лучевое лечение), кортикостероидные и анаболические гормоны, восстановительные методы, а также комплекс мер, устраняющих или предупреждающих метаболические нарушения и проявления вторичного иммунодефицита. Если заболевание диагностируется рано (I, частично II стадия болезни), то при отсутствии клинической симптоматики, нормальных показателях крови (СОЭ не принимается в расчет) и функции почек противоопухолевую терапию начинать не следует; показана выжидательная тактика с ежемесячным контролем крови, мочи и уровней секреции монокло-нального парапротеина. У части таких больных имеется «тлеющая» ММ, которая в течение нескольких лет не прогрессирует и не нуждается в терапии. Однако при появлении симптомов нарастания опухолевой массы (снижение гемоглобина и эритроцитов, повышение уровня парапротеина в крови или моче, появлении сильных болей в костях) следует начинать лечение. При проведении цитостатической химиотерапии следует придерживаться определенных принципов: • подбор цитостатического препарата осуществляется с учетом стадии • оценка эффективности лечения должна проводиться по определен
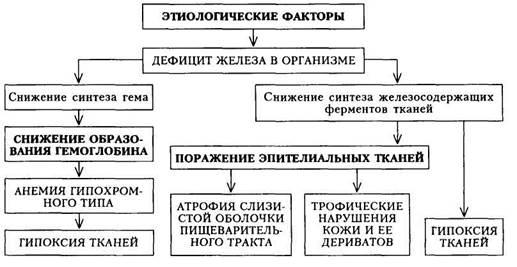
1) снижение концентрации парапротеина в сыворотке крови более 2) снижение экскреции белка Бене-Джонса более чем на 50 %; 3) появление рентгенологических признаков заживления костных 4) уменьшение площади пораженных опухолью костей; • непрерывное лечение с соблюдением доз и интервалов в течение 2 Используют комбинацию цитостатического препарата — мелфалана (алкерана) с преднизолоном. Существуют различные подходы к назначению этих препаратов. У больных с III стадией болезни при отсутствии явных признаков «агрессивности» (медленно прогрессирующая ММ) проводят пролонгированную терапию с поддерживающим лечением ударными прерывистыми курсами. Мелфалан сочетается с преднизолоном, одновременно назначают анаболические стероиды (неробол, ретаболил). Через 4 нед назначают поддерживающую терапию меньшими дозами используемых препаратов. Еще один вариант «пролонгированной терапии» — применение вин-кристина в сочетании с мелфаланом и преднизолоном, возможно также использование циклофосфана и преднизолона. Другая методика — «ударная прерывистая терапия» — рекомендуется больным с медленно прогрессирующей ММ I и II стадий. Применяют более короткие курсы лечения теми же препаратами — мелфаланом (или циклофосфаном) в сочетании с преднизолоном. При быстропрогрессирующей ММ с симптомами, указывающими на плохой прогноз, и резистентностью к ранее проводимой терапии, проводят полихимиотерапию. В течение 3 — 4 нед назначают комбинацию винкрис-тина, циклофосфана, мелфалана и преднизолона. У молодых больных с резистентностью к терапии и соматической сохранностью применяют так называемую интенсивную терапию. «Интенсивная терапия» включает использование высоких доз мелфалана в сочетании с трансплантацией костного мозга и тотальным облучением тела. В лечении ММ применяют также сс-интерферон (сс-ИФН), который не имеет самостоятельного значения в терапии ММ, но его назначение рационально вместе с химиотерапией, а также в перерывах между курсами; а-ИФН подавляет пролиферацию клона опухолевых клеток. Лечение считается эффективным только у тех больных, которые имеют стабильные или улучшающиеся показатели красной крови, сывороточного альбумина, у которых не нарастают размеры остеодеструктивных очагов. Эти критерии существенно важны, так как ориентация на уровень снижения парапротеина не всегда верна — прямая зависимость между опухолевой массой и уровнем секреции парапротеина может быть весьма различной. Эффект лечения оценивается через 3 мес от его начала. При отсутствии признаков улучшения больные относятся к прогностически весьма неблагоприятным — так называемым нереагирующим. Локальная лучевая терапия показана во всех случаях угрозы патологических переломов (позвоночник, крестцово-подвздошная область, бедренные, берцовые кости), даже при отсутствии болевого синдрома. Локальное облучение используется при наличии ограниченных опухолевых узлов в костях и мягких тканях, радикулярных болях, связанных со сдав-лением корешков спинного мозга опухолью. Сочетать лучевое лечение и химиотерапию не рекомендуется. При инфекционных осложнениях рекомендуется применять антибиотики, не обладающие нефротоксичностью. При выраженной протеинемии и парапротеинемии следует использовать плазмаферез. При поражении костной ткани (переломы и пр.) необходимо назначать комплекс средств, улучшающих костную репарацию (миокальцик внутримышечно, оксиде-вит и пероральные препараты кальция). При переломах костей проводят иммобилизацию, вытяжение на щите (особенно при компрессионных переломах позвоночника). Прогноз.Современная комбинированная терапия увеличивает продолжительность жизни больных. Удается восстановить активность больных и поддерживать их удовлетворительное состояние. Гибель больных наступает вследствие хронической почечной недостаточности или инфекционных осложнений. АНЕМИИ Анемия— состояние, характеризующееся уменьшением гемоглобина в единице объема крови за счет снижения его общего количества в организме. В большинстве случаев анемия сопровождается и снижением концентрации эритроцитов в единице объема крови, за исключением отдельных видов анемии (железодефицитная анемия, талассемия). От истинной анемии следует отличать гидремию — разжижение крови за счет тканевой жидкости. В основе развития анемии лежат различные патологические процессы, в связи с чем все анемии следует разделять с патофизиологической точки зрения на следующие группы (классификация анемий, предложенная в 1985 г. А.И. Воробьевым, представлена в несколько сокращенном и упрощенном виде): 1) острые постгеморрагические; 2) железодефицитные; 3) связанные с нарушением синтеза или утилизации порфиринов (си- 4) связанные с нарушением синтеза РНК и ДНК (мегалобластные); 5) гемолитические; 6) связанные с нарушением пролиферации клеток костного мозга. Каждый из указанных патогенетических вариантов анемических состояний имеет различную этиологию (например, железодефицитная анемия может наблюдаться при мено-, метроррагиях, кровотечениях из пищеварительного тракта, при беременности, нарушении всасывания железа и др.). Однако в ряде случаев самый тщательный диагностический поиск не может выявить лежащее в основе анемии заболевание; тогда следует говорить об идиопатической форме анемии. Поэтому при обследовании больного с предполагаемой анемией необходимо: 1) определить патогенетический вариант анемии; 2) выявить заболевание, лежащее в основе имеющейся у больного анемии. Проявления анемий чрезвычайно разнообразны и определяются: 1) патогенетическим вариантом анемии; 2) этиологией; 3) изменениями в организме, обусловленными реакцией организма на гипоксию тканей, вызванную нарушением дыхательной функции крови (доставка кислорода тканям) — циркуляторно-гипоксическим синдромом. Этот синдром проявляется слабостью, повышенной утомляемостью, одышкой при физической нагрузке, сердцебиениями, «анемическим» шумом в крупных сосудах, увеличением объема циркулирующей крови, ускорением кровотока. Цир-куляторно-гипоксический синдром наблюдается в большей или меньшей степени при всех видах анемических состояний; выраженность его зависит от степени гипоксии тканей, что в свою очередь определяется кислородной емкостью крови (иначе говоря, выраженностью анемического состояния). ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ Сущность железодефицитной анемии (ЖДА) состоит в нехватке железа в организме (истощение запасов железа в органах-депо), вследствие чего нарушается синтез гемоглобина, отчего каждый эритроцит со- держит меньшее, чем в норме, количество гемоглобина. ЖДА встречаются чаще всех остальных форм анемий, что объясняется множеством обстоятельств, ведущих к дефициту железа в организме. Этиология.Выделяют основные причины дефицита железа: • Кровотечения: а) маточные (дисфункция яичников, фибромиома • Повышенный расход железа: а) беременность, лактация; б) период • Нарушение всасывания железа: а) резекция желудка; б) энтерит, • Нарушение транспорта железа. • Врожденный дефицит железа (этот механизм возможен при ЖДА у Из перечисленных причин следует, что ЖДА чаще развивается у женщин в результате обильных маточных кровотечений, повторных беременностей, а также у подростков. Патогенез.ЖДА возникает прежде всего в результате нарушения синтеза гемоглобина, так как железо входит в состав гема. Недостаточное образование гемоглобина служит причиной гипоксии тканей и развития циркуляторно-гипоксического синдрома. Дефицит железа способствует также нарушению синтеза тканевых ферментов, что приводит к изменению тканевого метаболизма. При этом прежде всего поражаются быстро обновляющиеся эпителиальные ткани — слизистая оболочка пищеварительного тракта, кожа и ее дериваты. Патогенез ЖДА представлен на схеме 25. Клиническая картина.Проявление болезни, как это вытекает из схемы патогенеза, складывается из следующих синдромов: 1) циркуляторно-гипоксического (при достаточной выраженности 2) поражения эпителиальных тканей (гастроэнтерологические рас 3) гематологического (анемия гипохромного типа и признаки дефици Кроме этих синдромов, клиническая картина определяется также заболеванием, на основе которого развилась ЖДА (например, язвенная болезнь желудка или двенадцатиперстной кишки с повторными кровотечениями, мено- и метроррагии, какая-либо хроническая инфекция и пр.). Имеет значение стадия течения: 1) скрытого дефицита железа, проявляющегося снижением уровня 2) тканевый сидеропенический синдром (проявляется гастроэнтеро 3) анемия (снижение уровня гемоглобина).
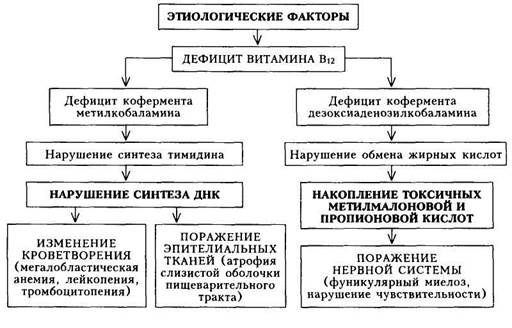
Схема 25. Патогенез железодефицитной анемии На I этапе диагностического поиска при достаточно выраженной анемии можно выявить жалобы на слабость, шум в ушах, сердцебиение, одышку при физической нагрузке, ноющие боли в области сердца (проявления циркуляторно-гипоксического синдрома). Очень своеобразны проявления гастроэнтерологических расстройств в виде извращения вкуса, обоняния, снижения и извращения аппетита (желание есть мел, сухие макароны, зубной порошок), отмечаются затруднение при глотании, неопределенные болевые ощущения в эпигастрии. Нередко больные отмечают субфебрильную температуру тела. При умеренно выраженной анемии и дефиците железа все указанные жалобы могут быть выражены незначительно или отсутствовать. В анамнезе таких больных — сведения о случайном обнаружении снижения уровня гемоглобина (например, во время профилактического осмотра). Больные могут предъявлять разнообразные жалобы, а также сообщать те или иные сведения о фоновом заболевании (или состоянии), обусловившем появление дефицита железа и последующей анемии. На II этапе диагностического поиска следует активно искать симптомы поражения эпителиальной ткани и трофических расстройств кожи и ее дериватов (волосы, ногти). Так, можно обнаружить сглаженность сосочков языка, сухость и шелушение кожных покровов, ломкость ногтей, сухость и выпадение волос. Циркуляторно-гипоксический синдром проявляется тахикардией, систолическим шумом над верхушкой сердца, на крупных сосудах (при этом тоны сердца не изменены); на яремных венах может прослушиваться шум «волчка». Кожные покровы и слизистые оболочки обычно бледные; размеры селезенки, как правило, нормальные. Умеренное ее увеличение встречается обычно у тех больных, которым проводили многочисленные гемотрансфузии. На III этапе диагностического поиска проводят исследования, результаты которых подтверждают не только наличие и выраженность анемии, но также ее патогенетический вариант (обусловленность дефицитом железа). При исследовании периферической крови выявляют сниженный уровень гемоглобина, микроцитоз (увеличение количества эритроцитов малого диаметра) и гипохромию эритроцитов, снижение цветового показателя, среднего содержания гемоглобина в эритроците (весовое и процентное). Содержание ретикулоцитов в норме или повышено. Изменяются показатели обмена железа: снижается содержание свободного железа в сыворотке крови и насыщение трансферрина железом; повышается ОЖСС (общая железосвязывающая способность сыворотки — общий трансферрин). Это связано с тем, что в организме снижено содержание железа. Для изучения резервов железа в организме применяется десфераловая проба. В норме взрослый человек теряет 0,6—1,3 мг железа с мочой после введения 500 мг десферала; при ЖДА содержание железа в моче после введения десферала значительно ниже (0,2 — 0,4 мг), что указывает на снижение запасов железа в организме. Десферал — продукт метаболизма актиноми-цетов, способный связывать железо. Известное представление о снижении запасов железа в организме можно получить, изучая всасывание радиоактивного железа. При ЖДА всасывание радиоактивного железа повышается. В костном мозге при ЖДА отмечается уменьшение количества сиде-робластов — эритрокариоцитов, содержащих железо (как известно, в норме 20 — 40 % эритрокариоцитов костного мозга содержат единичные гранулы железа). В ряде случаев гранулы выявить не удается. При исследовании пищеварительного тракта достаточно часто выявляют снижение желудочной секреции (базальной и стимулированной), а также атрофические изменения слизистой оболочки пищевода и желудка. При выраженном гипоксически-циркуляторном синдроме могут наблюдаться признаки поражения миокарда (миокардиодистрофия вследствие анемии) в виде умеренного расширения сердца (определяется при рентгенологическом исследовании) и изменений конечной части ЭКГ (снижение амплитуды или негативизации зубцов Т, преимущественно в грудных отведениях). Диагностика. При постановке диагноза ЖДА выделяют два этапа: 1) доказательство дефицита железа в организме (как причины анемии); 2) выявление причин железодефицитного состояния. Критериями дефицита железа и анемии являются: гемоглобин ниже 120 г/л у мужчин и ниже 116 г/л у женщин, снижение цветового показателя (ниже 0,86), среднего содержания гемоглобина в эритроцитах (24 пг), средней концентрации гемоглобина в эритроцитах (ниже 30 %), повышение количества микроцитов (эритроцитов диаметром менее 6 мкм) более 20 %, снижение сывороточного железа — менее 11,6 мкмоль/л; повышение свободного трансферрина — более 35,8 мкмоль/л и общего трансферрина (ОЖСС) — более 71,6 мкмоль/л; снижение насыщения трансферрина железом (менее 25 %); повышение всасывания радиоактивности железа; положительная десфераловая проба (уменьшение содержания железа в моче после введения десферала). Чтобы установить причину железодефицитного состояния, прежде всего необходимо найти источник кровотечения. Для этого наряду с тщательным клиническим исследованием необходимо проведение эндоскопических (эзофагогастродуоденоскопия, ректоромано- и колоноскопия, бронхоскопия) и других методов исследования. Женщин обязательно должен осмотреть гинеколог. Обнаружить скрытые (оккультные) кровотечения очень трудно. Если не удалось выявить источник кровотечения, то применяют пробу с введением больному его собственных эритроцитов, предварительно меченных 51Сг, а в последующем определяют радиоактивность кала. Высокая радиоактивность свидетельствует об источнике кровотечения в пищеварительном тракте. При хронических инфекциях важное значение имеет определение уровня свободного трансферрина сыворотки (латентная железосвязываю-щая способность сыворотки), который в отличие от постгеморрагических анемий остается нормальным. Дифференциальная диагностика.ЖДА следует отличать от сидеро-ахрестической анемии и талассемии (один из видов наследственной гемолитической анемии). При сидероахрестической анемии вследствие генетического или приобретенного нарушения обмена порфиринов железо не поступает в эритроидные клетки. В результате этого развивается анемия с резким снижением цветового показателя при повышенном содержании железа сыворотки. В костном мозге — раздражение красного ростка, повышенное содержание эритроидных клеток с включением железа. Терапия препаратами железа при сидероахрестической анемии безуспешна. При талассемии (более подробно см. «Гемолитические анемии») отмечается умеренное снижение гемоглобина при значительном снижении цветового показателя, уровень сывороточного железа повышен. Характерно наличие мишеневидных эритроцитов. Одновременно выявляются все признаки гемолитического синдрома. Формулировка развернутого клиническогодиагноза ЖДАучитывает следующие компоненты: 1) определение характера анемии (в данном случае железодефицитная); 2) указание этиологии заболевания; 3) определение стадии процесса (ремиссия — рецидив; рецидив может характеризоваться скрытым дефицитом железа). Лечение.Воздействуют на этиологические факторы (удаление источника кровотечения, борьба с инфекцией, противоопухолевая терапия, профилактика врожденного дефицита железа) и проводят патогенетическую терапию (ликвидация дефицита железа, при резких расстройствах гемодинамики — борьба с ними). Диета больных ЖДА должна содержать продукты, богатые железом, однако следует учитывать не только содержание железа в том или ином продукте, но и степень всасывания из него железа. Наибольшее количество железа содержится в мясных продуктах (говядина, телятина). Содержащееся в них так называемое гемовое железо всасывается на 25 — 30 %. Всасывание железа из рыбы ниже (до 10 %), из растительных продуктов — всего 3 — 5 %. Таким образом, ликвидация дефицита железа осуществляется приемом лекарственных препаратов железа внутрь (или парентерально). Необходимо, чтобы суточная доза двухвалентного железа (всасывается только двухвалентное железо) составляет 100 — 300 мг. В связи с этим при выборе препарата железа и определении его суточной дозы необходимо ориентироваться не только на общее содержание в нем железа, но и на количество двухвалентного железа. Естественно, что предпочтительнее назначать препараты с высоким содержанием двухвалентного железа в связи с удобством приема для больных (1—2 раза в сутки). Входящие в состав многих лекарственных форм аскорбиновая и янтарная кислоты, фруктоза, цистеин усиливают всасывание железа. Для лучшей всасываемости препараты железа следует принимать до еды. Основное положение терапии железом - длительное лечение и в достаточных дозах. Только при этом можно получить стойкий результат. Достаточно давно применяется препарат ферроплекс — драже, содержащее двухвалентное железо и аскорбиновую кислоту; применять следует 15-20 драже в сутки. В настоящее время появились препараты железа, содержащие двухвалентное железо в существенно большем количестве, что позволяет обойтись одно-двукратным приемом препарата. Феррогра-думет, сорбифор дурулес принимают по 1—2 таблетки в день, тардифе-рон — по 2 таблетки в день, конферон — по 1 —2 капсулы (3 раза в день), актиферрин — по 1 капсуле 2 — 3 раза в день или в виде сиропа (1 чайная ложка на 12 кг массы тела); сироп нельзя назначать больным сахарным диабетом, так как в сиропе содержится много сахара. Представляет интерес препарат, в котором железо находится в микродиализных капсулах — фенюльс, что обеспечивает постоянство скорости высвобождения железа в течение суток (обеспечивается постоянство плазменной концентрации препарата). Для парентерального лечения используют феррум-лек, ферби-тол, эктофер. Феррум-лек для внутримышечного введения выпускается в ампулах по 2 мл, содержащих 100 мг железа (это соединение окиси трехвалентного железа с полиизомальтозой), а для внутривенного введения — по 5 мл, в которых также содержится 100 мг железа (но это коллоидный раствор, в котором железо связано с натрий-сахаратным комплексом). При назначении препаратов железа в достаточной дозе на 7 —10-й день после начала терапии наблюдается увеличение количества ретикуло-цитов в периферической крови (ретикулоцитарный криз). Прирост уровня гемоглобина начинается через 3 — 4 нед после начала лечения, однако в ряде случаев это может произойти на 6 —8-й неделе. Лечение следует проводить не менее 3 мес. По достижении ремиссии у больных с продолжающимися кровотечениями (например, при меноррагиях) следует рекомендовать поддерживающую терапию тем же препаратом (ежемесячно по 7 — 10 дней). У ряда больных приходится применять парентеральные препараты железа; показаниями являются: • тошнота, рвота (непереносимость препаратов железа при приеме • нарушение всасывания при патологии кишечника (энтериты, резек • нежелательность назначения внутрь препаратов железа больным с • необходимость более быстрого насыщения организма железом (осо При аллергических реакциях на парентеральное введение препаратов железа и непереносимости пероральнои терапии следует проводить трансфузии эритроцитной массы. Переливание крови быстро увеличивает содержание гемоглобина, но утилизация при этом значительно ограничена. Кроме того, имеется опасность заражения больных инфекционным мононуклеозом, сывороточным гепатитом и др. В связи с этим гемотрансфузии проводят лишь по жизненным показаниям (при подготов- ке к оперативному вмешательству, выраженных гемодинамических нарушениях, связанных с анемией). В последнем случае следует стремиться не к нормализации уровня гемоглобина путем гемотрансфузий, а к улучшению общего состояния больного. Прогноз.Ликвидация причины потери крови, а также систематическая ферротерапия приводят к полному выздоровлению. У лиц с обильными маточными кровопотерями необходимо систематически контролировать уровень гемоглобина (таких больных ставят на диспансерный учет). Профилактика.Лица, подверженные опасности дефицита железа (недоношенные дети, дети от многоплодной беременности, девушки в период полового созревания при быстром росте, женщины с обильными менструациями, беременные) должны употреблять пищу с достаточным содержанием железа (прежде всего говядину). У них следует периодически исследовать кровь для выявления скрытого дефицита железа и анемии. СИДЕРОАХРЕСТИЧЕСКАЯ АНЕМИЯ Сидероахрестическая анемия (САА) — железонасыщенная или сидеробластная анемия, при которой эритроциты содержат мало железа (гипохромны) вследствие неиспользования его костным мозгом для синтеза гемоглобина. Этиология и патогенез.В основе развития сидероахрестических анемий лежит нарушение синтеза гема. Железо, белок, необходимые для синтеза гемоглобина, имеются, однако отсутствует достаточное количество протопорфирина. Вследствие этого не осуществляется синтез гема — основного компонента молекулы гемоглобина. Гем — соединение порфири-новых колец (протопорфирина) с атомом железа. Гем, соединяясь с глобином, образует молекулу гемоглобина. При САА уменьшается образование порфиринов и возникает избыток железа. Уменьшение образования порфиринов обусловлено врожденным или приобретенным дефицитом ряда ферментов. Накопление железа в организме приводит к отложению его во внутренних органах. Выделяют две основные наследственные формы САА: пиридоксинза-висимую (имеется дефицит пиридоксаль-фосфата, поэтому назначение пи-ридоксина — витамина Be — дает эффект) и пиридоксинрезистентную (этачформа встречается крайне редко). Приобретенные формы чаще наблюдаются в пожилом возрасте, заболевание не носит семейного характера. Непосредственный ферментный дефект не всегда ясен. САА чаще возникает при лечении туберкулостатичес-кими препаратами вследствие истощения запасов пиридоксаль-фосфата, при свинцовой интоксикации. Могут быть также идиопатические формы САА. Клиническая картина.При наследственных формах заболевание начинается уже в раннем детстве. На I этапе диагностического поиска выявляются жалобы, обусловленные гипоксически-циркуляторным синдромом. В анамнезе — указания на бледность, слабость, увеличение печени и селезенки. Дети быстро устают, плохо учатся, у них плохая память; у взрослых — слабость, снижение толерантности к физической нагрузке, возникающие после длительного лечения основного заболевания (туберкулеза), профессиональных вредностей (контакт со свинцом). Можно обна- 15 - 540 ружить сведения о выявлении низких показателей гемоглобина и неуспешном лечении препаратами железа. На II этапе диагностического поиска в периоды обострения возможно выявление бледности кожных покровов и видимых слизистых оболочек, у части больных — увеличение печени и селезенки в умеренных пределах. В связи с этим у таких больных предполагают хроническое заболевание печени (чаще всего хронический гепатит). Отложение железа во внутренних органах может привести к ряду своеобразных симптомов. Так, отложение железа в поджелудочной железе ведет к сахарному диабету, в печени — к циррозу печени, в сердце — к сердечной недостаточности, в половых железах — к евнухоидизму. Для постановки диагноза основным является III этап диагностического поиска. Лабораторные исследования выявляют снижение гемоглобина в сочетании с низким цветовым показателем, ретикулоцитопе-нию. В сыворотке крови определяют высокое содержание железа, а в пунктате костного мозга — сидеробласты (клетки костного мозга с включениями железа в виде гранул). Дефицит ферментов, участвующих в обмене порфиринов, уточняют путем определения продуктов порфиринов в моче. Повышенное содержание железа в организме доказывается также с помощью десфераловой пробы (после введения десферала с мочой выделяется увеличенное количество железа). При биопсии печени, селезенки можно обнаружить признаки гемосидероза. ОЖСС у таких больных снижена. Лечение.Назначение препаратов железа неэффективно, но еще больше увеличивает содержание железа в крови и способствует гемосидерозу органов. Точно так же не показаны и гемотрансфузии. Применяется пири-доксин (витамин В6) в дозах 50 — 200 мг/сут внутрь или по 100 мг внутримышечно 2 раза в неделю в течение 2 мес. Наиболее эффективен кофер-мент пиридоксаль-фосфат, так как иногда бывает блокирована возможность перехода пиридоксина в пиридоксаль-фосфат. При наследственных формах лечение витамином Вб надо повторять периодически. В случае ре-зистентности к терапии пиридоксином применяют анаболические и андро-генные гормоны. Для уменьшения гемосидероза органов и снижения уровня сывороточного железа назначают десферал (внутривенно по 500 — 1000 мг) с перерывами, ориентируясь на уровень железа и присутствие сидероблас-тов в костном мозге. В12-ДЕФИЦИТНАЯ АНЕМИЯ Сущность Biz-дефицитной анемии (В12ДА) состоит в нарушении образования дезоксирибонуклеиновой кислоты (ДНК) в связи с нехваткой в организме витамина Bi2 (цианокобаламина), что приводит к нарушению кроветворения, появлению в костном мозге мегалобластов, внутри-костномозговому разрушению эритрокариоцитов, снижению количества эритроцитов и гемоглобина, лейкопении, нейтропении и тромбоцитопении, а также к изменению ряда органов и систем (пищеварительный тракт, ЦНС). Этиология.В12ДА встречается значительно реже, чем ЖДА, и может быть вызвана следующими причинами: 1) нарушением секреции гастромукопротеина («внутренний фактор») 2) повышением расхода витамина Bi2 (инвазия широкого лентеца, ак 3) нарушением всасывания витамина Bi2 (органические заболевания 4) нарушением транспорта витамина Вп (дефицит транскобаламина); 5) образованием антител к «внутреннему фактору» или комплексу Сходную с В12ДА гиперхромную анемию вызывает дефицит фолиевой кислоты, который возникает при: 1) повышенном расходе (беременность); 2) вскармливании детей козьим молоком; 3) нарушении всасывания (органические заболевания кишечника, алкоголизм); 4) приеме некоторых лекарственных препаратов (противосудорожные, противотуберкулезные препараты, фенобарбитал, контрацептивы и др.). Патогенез.Витамин В(2 состоит из двух коферментов — метилкоба-ламина и дезоксиаденозилкобаламина. Дефицит первого кофермента обусловливает нарушение синтеза ДНК, вследствие чего деление и созревание клеток красного ряда нарушаются, они избыточно растут, не утрачивая ядра. Большие клетки, содержащие ядра, называются мегалобласта-ми, они не созревают до мегалоцитов (гигантские эритроциты без ядер), легко гемолизируются, еще находясь в костном мозге. Дефицит витамина В(2 вызывает нарушение роста клеток лейкоцитарного и тромбоцитарного рядов, но это не так заметно сказывается на морфологии и количестве клеток, как нарушения эритропоэза. При недостатке второго кофермента нарушается обмен жирных кислот, вследствие чего в организме происходит накопление токсичных продуктов пропионовой и метилмалоновой кислот: развивается поражение заднебоко-вых канатиков спинного мозга — фуникулярный миелоз (схема 26). Клиническая картина.Проявления В^ДА, как это вытекает из схемы патогенеза, складываются из следующих синдромов: 1) циркуляторно-ги-поксического (при достаточной выраженности анемии и кислородного голодания тканей); 2) гастроэнтерологического; 3) неврологического; 4) гематологического (анемия гиперхромного типа). Кроме этих синдромов, клиническая картина будет определяться также заболеванием, на основе которого развилась В^ДА. На I этапе диагностического поиска при достаточно выраженной анемии могут наблюдаться симптомы, обусловленные циркуляторно-ги-поксическим синдромом (слабость, повышенная утомляемость, одышка при физической нагрузке, болевые ощущения в области сердца, сердцебиения). В случае нерезкого кислородного голодания тканей эти жалобы могут отсутствовать. Снижение аппетита, отвращение к мясу, боли в кончике языка и жжение, чувство тяжести в эпигастрии после еды, чередование поносов и запоров обусловлены поражением пищеварительного тракта и, в частности, выраженной секреторной недостаточностью желудка. При поражении ЦНС больные жалуются на головную боль, неустойчивую походку, зябкость, чувство онемения в конечностях, ощущение «ползания
Схема 26. Патогенез В12-дефицитной анемии мурашек». Выраженность этих жалоб не всегда соответствует степени анемии, в период ремиссии заболевания жалобы могут отсутствовать. Весьма существенно, если все перечисленные жалобы предъявляет немолодой человек, в этих случаях вероятность В12ДА повышается. В семейном анамнезе у больных с предполагаемой В12ДА могут быть больные с данным заболеванием. Злоупотребление алкоголем может быть одной из причин развития анемии. Данные анамнеза могут помочь в предположении патогенетического варианта анемии. Развитие анемии после пребывания больного возле больших водоемов и употребления в пищу сырой или недостаточно обработанной рыбы заставляет предположить в качестве возможной причины дифилло-ботриоз. Если заболевание возникло у пожилого человека, страдающего хроническим гастритом, и развивается медленно, то можно думать о В12ДА. В случае, если симптомы со стороны пищеварительного тракта сочетаются со снижением массы тела и быстро прогрессируют, следует предположить в качестве причины заболевания злокачественное новообразование. Наконец, сведения об успешном лечении больного витамином Bf2 позволяют с большой уверенностью рассматривать имеющуюся симптоматику как проявление В^ДА. На II этапе диагностического поиска симптомы могут быть обусловлены поражением пищеварительного тракта и ЦНС. Кроме того, ряд неспецифических признаков повышает вероятность предположения о наличии у больного В12ДА. Так, бледность кожных покровов в сочетании с небольшой иктеричностью склер и одутловатостью лица наблюдается при В12ДА. Масса тела таких больных, как правило, нормальная или повышенная. Однако снижение массы тела может указывать на злокачествен- ную опухоль как возможную причину ВпДА. Аналогичное значение имеет обнаружение увеличенного плотного лимфатического узла (метастаз опухоли?). Циркуляторно-гипоксический синдром проявляется так же, как и при ЖДА (расширение границ сердца влево, тахикардия, систолический шум, шум «волчка» на яремных венах). Несомненное диагностическое значение имеет обнаружение при исследовании пищеварительного тракта признаков глоссита: сглаженные сосочки вплоть до полной их атрофии («полированный» язык). Печень несколько увеличена, может прощупываться селезенка. Однако все эти симптомы не являются обязательными для В12ДА. Отмечаются нарушения глубокой чувствительности, нижний спастический парапарез (картина псевдотабеса). Следует заметить, что изменения нервной системы наблюдаются далеко не во всех случаях, так что их отсутствие не исключает диагноза В12ДА. Таким образом, данные II этапа в сочетании с анамнестическими данными и жалобами больного, хотя и выявляют ряд основных симптомов В12ДА, но дают основание лишь заподозрить эту форму болезни. Окончательный диагноз ставят после проведения серии лабораторных исследований. На III этапе диагностического поиска при исследовании периферической крови выявляют следующие признаки: снижение количества эритроцитов (менее 31012/л), повышение цветового показателя (более 1,1), среднего содержания гемоглобина в эритроците (более 34 пг) и среднего объема эритроцита (более 120 мкм3). Эритроцитометрическая кривая сдвинута вправо — увеличено количество макроцитов, появляются мега-лоциты — эритроциты диаметром более 12 мкм. Форма эритроцитов изменена — пойкилоцитоз. Встречаются единичные мегалобласты. Дополнительный признак — появление нейтрофилов с гиперсегмен-тированными ядрами. Если в картине периферической крови не обнаруживают характерных признаков, то производят стерналъную пункцию. Последняя позволяет выявить в костном мозге мегалобластический тип кроветворения. Важным является определение содержания сывороточного железа: при ВпДА оно может быть в норме или повышено в связи с усиленным гемолизом эритроцитов. В этих случаях увеличено содержание непрямого билирубина. При исследовании желудочного сока часто выявляется гиста-миноустойчивая ахилия (характерный признак анемии Аддисона — Бирме-ра), эндоскопически — атрофия слизистой оболочки желудка. Другие инструментальные методы исследования помогают обнаружить признаки миокардиодистрофии (развивается на фоне выраженной анемии), а также уточнить этиологию заболевания. Диагностика. В диагностике В12ДА выделяют два этапа: 1) доказательство дефицита витамина Вп как причины анемии; 2) выявление причин дефицита витамина Bi2. Критериями ВпДА являются: 1) снижение содержания эритроцитов (менее 3,0-1012/л); 2) повышение цветового показателя (более 1,1); 3) повышение содержания гемоглобина в эритроцитах (более 34 пг); 4) увеличение среднего объема эритроцита (более 120 мкм3); 5) сдвиг эритроцитомет-рической кривой вправо (увеличение количества макроцитов, появление ме-галоцитов — эритроцитов диаметром более 12 мкм); 6) появление в мазках пунктата костного мозга элементов мегалобластного кроветворения; 7) по- вышение содержания сывороточного железа (более 30,4 мкмоль/л); 8) снижение радиоактивности мочи после приема витамина Bi2, меченного радиоактивным кобальтом. Для выявления причины анемии следует проводить рентгенологическое и эндоскопическое исследование пищеварительного тракта (опухоль желудка, дивертикулез тонкой кишки), гельминтологическое исследование (инвазия широким лентецом), функциональное исследование печени с биопсией (хронический гепатит, цирроз), исследование нейтрального жира в кишечнике (спру). В12ДА следует дифференцировать от фолиеводефицитной анемии. При дефиците фолиевой кислоты наблюдается макроцитарная гиперхром-ная анемия, а в костном мозге могут обнаруживаться мегалобласты. Следует отметить, что дефицит фолиевой кислоты встречается значительно реже. В отличие от В12ДА при фолиеводефицитной анемии содержание фолиевой кислоты в сыворотке, а также в эритроцитах снижено. Кроме того, при окраске препарата костного мозга ализарином красным окрашиваются только мегалобласты, связанные с дефицитом В^, и не окрашиваются мегалобласты, связанные с дефицитом фолиевой кислоты. Течение. Заболевание может резко обостриться. В таких случаях развивается коматозное состояние: потеря сознания, снижение температуры тела и АД, одышка, рвота, арефлексия, непроизвольное мочеиспускание. Между развитием коматозного состояния и падением уровня гемоглобина нет четких коррелятивных отношений (у больных с резко сниженным содержанием гемоглобина не наблюдается комы). Главную роль в патогенезе комы играют быстрый темп и степень снижения гемоглобина, резкая ишемия и гипоксия ЦНС. Формулировка развернутого клинического диагнозаучитывает: 1) этиологию В12ДА (отдельно следует выделять такую форму анемии, как болезнь Аддисона — Бирмера); 2) стадию процесса (рецидив — ремиссия); 3) выраженность отдельных синдромов (обычно при наличии неврологических расстройств, обусловленных фуникулярным миелозом). Лечение.Комплекс лечебных мероприятий при В12ДА следует проводить с учетом этиологии, выраженности анемии и наличия неврологических нарушений. При лечении следует ориентироваться на следующие положения: • Непременным условием лечения В12ДА при глистной инвазии явля • При органических заболеваниях кишечника и поносах следует при • Нормализация кишечной флоры достигается приемом ферментных • Сбалансированное питание с достаточным содержанием витаминов • Патогенетическая терапия осуществляется с помощью парентерального введения витамина Bi2 (ликвидация его дефицита), а также нормализации измененных показателей центральной гемодинамики и нейтрализации антител к гастромукопротеину («внутреннему фактору») или комплексу гастромукопротеин + витамин В^ (корти-костероидная терапия). Цианкобаламин (витамин Вп) вводят ежедневно внутримышечно в дозе 200 — 500 мкг 1 раз в день в течение 4 — 6 нед до наступления гематологической ремиссии. Критериями гематологической реакции являются резкое увеличение количества ретикулоцитов в периферической крови — ретикулоцитарный криз, трансформации мегалобластического кроветворения в нормобласти-ческое. Появление ретикулоцитарного криза на 5 —б-й день лечения является ранним критерием эффективности его. В процессе лечения цианкобаламином количество эритроцитов нарастает быстрее, чем содержание гемоглобина, в связи с этим цветовой показатель обычно снижается. После нормализации костномозгового кроветворения и состава крови (обычно через 1,5 — 2 мес) витамин вводят 1 раз в неделю в течение 2 — 3 мес, затем в течение полугода 2 раза в месяц в тех же дозах, что и в начале курса). В дальнейшем больных ставят на диспансерный учет; профилактически им вводят витамин Bi2 1 — 2 раза в год короткими курсами по 5 — 6 инъекций или ежемесячно по 200 — 500 мкг (пожизненно). При симптомах фуникулярного миелоза витамин Вп вводят в значительных дозах — 500 — 1000 мкг ежедневно в течение 10 дней, а затем 1—3 раза в неделю до исчезновения неврологической симптоматики. Гемотрансфузии проводят лишь при значительном снижении гемоглобина и проявлении симптомов коматозного состояния. Рекомендуется вводить эритроцитную массу по 250 — 300 мл (5 — 6 трансфузий). Преднизолон (20 — 30 мг/сут) рекомендуется при аутоиммунной природе заболевания. Прогноз.В настоящее время применение витамина Bt2 сделало прогноз В12ДА благоприятным. При адекватной терапии больные живут длительное время. Профилактика.Мер первичной профилактики не существует. У лиц, имеющих перечисленные ранее этиологические факторы, следует периодически исследовать кровь для своевременного выявления анемии. ГЕМОЛИТИЧЕСКИЕ АНЕМИИ Гемолитические анемии (ГА) составляют обширную группу заболеваний, значительно различающихся по этиологии, патогенезу, клинической картине и лечению. Основным патологическим процессом, объединяющим эти заболевания в одну группу, является повышенный гемолиз. Гемолиз может происходить внутриклеточно (в селезенке как обычный физиологический), так и непосредственно в сосудах (внутрисосудистый или внеклеточный). В норме продолжительность жизни эритроцита составляет 100—120 дней, а при гемолитических анемиях она сокращается до 12—14 дней. Повышенный гемолиз, происходящий в клетках мононуклеарно-фаго-цитарной системы (главным образом в селезенке) проявляется следующими симптомами: ■ в крови увеличивается содержание свободного (непрямого) билиру ■ избыточное количество непрямого билирубина перерабатывается ге- ■ в кишечнике, куда поступает желчь, образуются в увеличенном ко ■ в моче увеличивается содержание уробилина; ■ общее количество эритроцитов уменьшается, увеличивается ретику- Проявления повышенного гемолиза, происходящего в сосудах: ■ в крови увеличивается количество свободного гемоглобина; ■ свободный гемоглобин выделяется с мочой в неизмененном виде ■ гемосидерин может откладываться во внутренних органах (гемоси- Классификация.Все ГА делятся на две большие группы — наследственные и приобретенные. Наследственные ГА обусловлены генетическими дефектами эритроцитов, которые становятся функционально неполноценными и легко разрушаются. Приобретенные ГА являются следствием воздействия на нормальные эритроциты различных факторов, приводящих их к разрушению (образование антител, гемолитических ядов, механические воздействия и пр.). Наследственные ГА: 1) связанные с нарушением мембраны эритроцитов (гемолитическая микросфероцитарная анемия или болезнь Минков-ского — Шоффара, овалоцитоз, стоматоцитоз); 2) связанные с нарушением активности ферментов в эритроцитах 3) связанные с нарушением структуры или синтеза цепей глобина (та- Приобретенные ГА: 1) связанные с воздействием антител (изоиммун-ные, аутоиммунные); 2) связанные с изменением структуры мембраны эритроцитов вслед 3) связанные с механическим повреждением мембраны эритроцита 4) обусловленные химическими повреждениями эритроцитов (гемо 5) обусловленные недостатком витамина Е; 6) связанные с воздействием паразитов (малярия). Частота тех или иных ГА весьма различна. Так, наследственный микросфероцитоз в Европе встречается с частотой 0,03 %, а в Японии и Африке значительно реже; частота анемии, обусловленная дефицитом Г-6-ФД, высока в странах Средиземноморского бассейна, на Ближнем Востоке и на Кавказе; ночная пароксизмальная гемоглобинурия представляет собой редкое заболевание. Далее рассматривается диагностический поиск при трех видах ГА, встречающихся наиболее часто: наследственном микросфе-роцитозе, талассемии и аутоиммунной ГА. В основе гемолитической микросфероцитарной анемии (наследственный микросфероцитоз) лежит дефект оболочки эритроцита, наследуемый аутосомно по доминантному типу. Эритроциты сферические и не могут менять форму при продвижении по узким капиллярам, особенно в синусах селезенки. При продвижении в узких частях сосудистого русла часть оболочки эритроцита теряется и происходит гемолиз. Мембрана эритроцита пропускает внутрь повышенное количество ионов натрия, которые, накапливаясь в эритроците, способствуют повышенной трате АТФ и глюкозы для своего последующего выведения из клетки. Это также ведет к укорочению продолжительности жизни эритроцита. Клиническая картина.Проявления болезни определяются гемолитическим синдромом и наличием часто сопутствующих врожденных аномалий скелета и внутренних органов. Болезнь течет волнообразно: «спокойные» периоды прерываются гемолитическими кризами, во время которых гемолиз резко интенсифицируется и все симптомы болезни усиливаются. На I этапе диагностического поиска можно получить информацию о жалобах больного на периодически возникающую легкую желтушность кожных покровов, преходящую слабость. При тяжелом течении заболевания наблюдаются гемолитические кризы, возникающие обычно спонтанно либо под влиянием переутомления, травмы, переохлаждения; отмечаются озноб, повышение температуры тела, боли в мышцах, области печени и селезенки. Резко усиливается желтуха, моча и кал темнеют. Если симптомы криза выражены не столь резко, но желтуха выражена вполне отчетливо, то таких больных часто госпитализируют в инфекционные больницы с подозрением на вирусный гепатит (диагноз не подтверждается). Постоянная желтушность у таких больных вне кризов может явиться основанием для предположения о хроническом гепатите. На II этапе диагностического поиска выявляется лимонно-желтое окрашивание кожи, усиливающееся до более интенсивной желтухи в период гемолитического криза. У части больных можно отметить врожденные аномалии (башенный череп, заячья губа, пороки сердца). При выраженной анемии выявляют циркуляторно-гипоксический синдром (анемический систолический шум, тахикардия, снижение АД, шум «волчка» на яремных венах и пр.). Гемолиз происходит в селезенке, поэтому со временем выявляется ее увеличение. В целом данные II этапа скорее исключают ряд заболеваний печени, могущих быть причиной желтухи, а не подтверждают наследственный микросфероцитоз. Решающим является III этап диагностического поиска, во время которого выявляют синдром гемолиза и его особенности у больных наследственным микросфероцитозом. Общий анализ крови помогает установить снижение содержания гемоглобина, эритроцитов. Основной морфологический признак болезни — наличие в крови большого количества мелких круглых эритроцитов (микро-сфероцитов). Диаметр их уменьшен, осмотическая резистентность значительно понижена (начало гемолиза при концентрации хлорида натрия 0,6 — 0,8 %, а при 0,4 % происходит полный гемолиз; в норме гемолиз начинается при концентрации 0,42 — 0,46 %, а полный гемолиз — при 0,30 — 0,32 %). Повышен аутогемолиз: при инкубации эритроцитов в течение 48 ч при температуре 37 °С гемолизируется не менее 30 %, тогда как в норме — лишь 3 —4 %. Положительны пробы с АТФ и глюкозой: их добавление к эритроцитам уменьшает аутогемолиз. Продолжительность жизни эритроцита, определяемая с помощью эритроцитов, меченных 51Сг, при наследственном микросфероцитозе укорочена. В крови определяются и другие признаки гемолиза: ретикулоцитоз, увеличение непрямого бирубина. В кале повышено содержание стеркоби-лина, а в моче — уробилина. При длительном течении болезни холецисто-графия, а также эхография могут выявить в желчном пузыре и протоках конкременты. Диагностика.Распознавание болезни основывается, как и при других видах анемии, преимущественно на данных III этапа диагностического поиска: желтуха гемолитического типа и микросфероцитоз. Сниженная осмотическая резистентность эритроцитов в сочетании с повышением аутоге-молиза и ингибиции его путем добавления к крови АТФ или глюкозы окончательно подтверждают диагноз. Отсутствие органных изменений не влияет значительно на диагноз (увеличение селезенки, обнаружение холе-литиаза, врожденные нарушения строения тела и пр.), но их обнаружение подтверждает достоверность диагноза. Формулировку развернутого клинического диагнозаосуществляют в следующей последовательности: 1) наименование ГА; 2) фаза обострения (гемолитический криз) или ремиссии; 3) состояние внутренних органов (спленомегалия, желчнокаменная болезнь, возможные аномалии скелета, других органов). Лечение.Единственным эффективным методом является спленэкто-мия, после чего патологический гемолиз прекращается, хотя эритроциты и имеют дефектную оболочку. Спленэктомия показана при тяжелом течении болезни и частых гемолитических кризах. При резкой анемии допустимо переливание эритроцитной массы. Препараты железа, витамин Bi2, а также кортикостероидные препараты применять не следует вследствие их неэффективности (механизмы анемии не связаны с дефицитом железа и витамина В12), а механизм гемолиза не связан с наличием противоэритроцитарных антител).
|
||||
|
Последнее изменение этой страницы: 2024-06-27; просмотров: 6; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.105.152 (0.029 с.) |


 Основные направления терапии
Основные направления терапии Борьба с прогрессированием опухолевого процесса
Борьба с прогрессированием опухолевого процесса
 Борьба с прогрессированием опухолевого процесса заключается в следующем:
Борьба с прогрессированием опухолевого процесса заключается в следующем: