Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучение кинетики разложения карбонатов металловСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Цель работы Исследовать влияние различных факторов (температуры, размера зерна) на скорость разложения карбонатов металлов. Рассчитать энергию активации. Определить область прохождения гетерогенного процесса.
Вопросы коллоквиума 1. Стадии гетерогенных процессов. 2. Области осуществления гетерогенных процессов. 3. Топохимические реакции, особенности их протекания. 4. Уравнение Ерофеева. 5. Законы Фика. 6. Энергия активации. Методы ее определения. 7. Теории катализа. 8. Основы кинетики каталитических процессов. Приборы и реактивы 1. Печь трубчатая. 2. Реометр. 3. Керамические лодочки. 4. Карбонат кальция.
Методика выполнения работы и ее обоснование
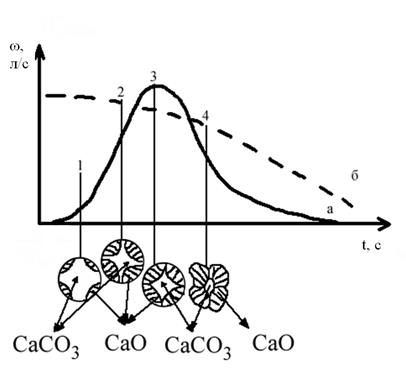
Процесс разложения карбоната кальция CaCO3(т) = CaO(т) + CO2(г) является гетерогенным, и протекает в несколько последовательных этапов: 1. Кристаллохимическое превращение CaCO3 в CaO; 2. Десорбция СО2 с реакционной поверхности; 3. Диффузия CO2 в ядро газового потока. По механизму протекания этих элементарных стадий их можно объединить в две группы: диффузионную и адсорбционно-химическую или кинетическую. Схематично процесс разложения карбоната можно представить следующим образом: в дефектных местах кусочков карбоната (дефектными местами могут быть вершины кристаллов, ребро кристалла, обломки и т.п.) при благоприятных условиях начинают распадаться ионы CO32– на ионы O2– и молекулы CO2. Ионы O2– совместно с ионами Ca2+ формируют решетку оксида кальция, которая растворена в недрах старой фазы. При перенасыщении оксид кальция выделяется в самостоятельную фазу, молекула CO2 остается адсорбированной на границе раздала фаз. Такое образование новой фазы происходит только в отдельных местах, называемых зародышами новой фазы. В дальнейшем, процесс развивается путём достройки таких зародышей новыми базисными плоскостями кристаллической решетки CaO(рис. 1). Так как процесс протекает только на границе раздела фаз, а граница раздела фаз вначале мала, то и скорость процесса мала. По мере достройки зародышей новыми образованиями оксида кальция поверхность раздела фаз на каждом зародыше увеличивается и, следовательно, увеличивается и скорость процесса. Фронт реакции на каждом зародыше увеличивается и затем сливается в единый фронт реакций. В это время скорость процесса достигает максимума. Однако, ввиду того, что кусочки карбоната имеют конечные размеры, начиняя с некоторого момента времени, величина поверхности начинает убывать вплоть до нуля. Так как поверхность раздела фаз карбоната и оксида по отношению к реакции диссоциации является своеобразным катализатором, (реакция ускоряется при образовании продукта), то этот процесс называется автокаталитическим. Ускорение реакции диссоциации при образовании границы раздела фаз вызвано двумя причинами: 1. Ионы CO32– на этой границе находятся в несимметричном силовом поле и условия для их распада и образования решетки CaO здесь наиболее благоприятны; 2. Достройка трехмерных зародышей CaO двухмерными энергетически более выгодна по сравнению с образованием новых трехмерных зародышей. Разложение карбоната происходит с уменьшением объема образующегося продукта. Это вызывает разрыхление и дополнительно усиливает катализ. Время развития процесса, в течение которого видимой скорости не обнаруживается, называют инкубационным периодом. Продолжительность инкубационного периода зависит от трудностей перестройки кристаллической решетки старой фазы в новую. Чем больше различие геометрической формы и параметров этих решеток, тем больше времени необходимо для их перестройки. В условиях, когда по всей поверхности легко образуются зародыши, кинетика процесса определяется скоростью перемещения межфазной реакционной зоны. При этом теряет свое значение период инкубации и самоускорения (см. Рис.1, кривая б). То же самое имеет место в диффузионной области, когда процесс лимитируется диффузиейСО2из зоны реакции.
Рис.1 Схема процесса разложения карбоната кальция Как уже было отмечено, разложение карбоната кальция включает в себя адсорбционно-химические стадии и диффузионные, протекающие последовательно. Наблюдаемая скорость процесса будет определяться скоростью самого медленного этапа: ω набл. = ω медл. этапа (стадии). (7.1) При низких температурах, когда энергия реагирующих молекул мала, самым замедленным этапом является кристаллохимическое превращение, осуществляемое со значительной энергией активации:
где
При высоких температурах, когда энергия реагирующих молекул значи-тельная, самым медленным является этап диффузии CO2 из зоны реакции:
Это изменение соотношения скоростей вытекает из разной степени влияния температуры на скорость кристаллохимического превращения и скорость процесса диффузии. В связи с тем, что объём реактора небольшой, можно считать, что воздух быстро заменяется СО2иразложение идет в атмосфере СО2. При этом
Для описания кинетики реакции разложения карбоната кальция можно использовать уравнения Б.В.Ерофеева (6.1) и (6.2). Рассчитав при помощи уравнения (6.2) константы скорости, точнее ln k 1 и ln k 2 для двух температур (T 1 и T 2), можно определить энергию активации по уравнению Аррениуса (1.13).
Порядок выполнения работы
1. По заданию преподавателя отбирают навеску карбоната кальция определенной крупности, засыпают ее в керамическую лодочку. Разогревают печьдо заданной температуры. 2. Лодочку толкателем помещают в реактор из кварца, закрывают реактор резиновой пробкой со вставленной в нее стеклянной трубкой и таким образом соединяют реактор с реометром. Отмечают, на какую глубину нужно поместить реактор в печь, чтобы лодочка находилась в средней зоне печи и соединительная пробка была достаточно удалена от нагревателя. При достижении заданной температуры в печи реактор вводят в печь до отметки и включают секундомер. 3. Скорость разложения карбоната кальция определяют по скорости выделения двуокиси углерода. Для этого через каждые 20 с записывают время и показания уровня жидкости в реометре (∆ h, мм вод. ст.). По окончании опыта реактор открывают и частично вытаскивают из печи. Берут в одну руку "толкатель", в другую керамическую плитку, подставленную под самый конец реактора, и извлекают толкателем лодочку из реактора на эту плитку. 4. Результаты опытов заносят в таблицу и строят график 5. Рассчитывают ln (–ln (1 – α)), строят график зависимости ln (–ln (1 – α)) = f (t), находят константы в уравнении Б.В.Ерофеева. 6. Проводят опыт при другой температуре (согласно п. 1 – 3). Рассчитывают энергию активации. 7. Для оценки влияния размера зерна CaCO3 на скорость его разложения проводят аналогичные опыты с образцами другой крупности (по заданию преподавателя).
Рекомендуемый вид таблицы
Температура опыта = Фракция CaCO3 – Навеска CaCO3 =
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 594; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |

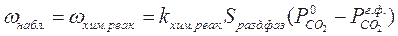 . (7.2)
. (7.2)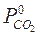 – парциальное давление СО2 на поверхности CaCO3,
– парциальное давление СО2 на поверхности CaCO3,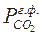 – парциальное давление СО2 в газовой фазе.
– парциальное давление СО2 в газовой фазе.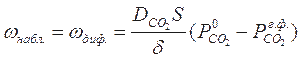 . (7.3)
. (7.3)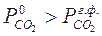 ;
; 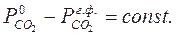
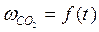 , (
, (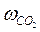 – скорость выделения CO2). На графикевыбирают во всем диапазоне 6 – 8 точек и рассчитывают степень превращения карбоната (α) за различные промежутки времени как отношение
– скорость выделения CO2). На графикевыбирают во всем диапазоне 6 – 8 точек и рассчитывают степень превращения карбоната (α) за различные промежутки времени как отношение 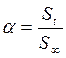 (S t – площадь под кривой
(S t – площадь под кривой 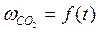 , ограниченная координатой t). Строят график зависимости
, ограниченная координатой t). Строят график зависимости 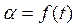 .
.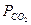 ,
Па
,
Па
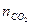 моль
моль