
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика выполнения работы и ее обоснованиеСодержание книги
Поиск на нашем сайте Выражение для скорости гомогенной химической реакции имеет вид
где с i – молярная концентрация реагента, νi – стехиометрические коэффициенты в уравнении реакции с учетом правила знаков, t – время. Для односторонних реакций вида ν1А + ν2В → продукты справедливо равенство
характеризующее зависимость скорости реакции от концентрации реагирующих веществ. В этом уравнении k – константа скорости реакции; m и р – коэффициенты, называемые порядками реакции по веществам А и В соответственно. Суммарный показатель степени n = m + р называется общим порядком реакции. При n =1 имеем дело с реакцией первого порядка, при n =2 – второго и так далее. Для реакции i – го порядка с учетом (1.1) и (1.2) можно записать
где Интегрирование в переделах
Откуда
Для случая, когда n =1
Обозначим через
Для случая, когда n =1
Проведя определение половинного времени реакции
Зависимость константы скорости реакции от температуры выражается уравнением Аррениуса
где Е – энергия активации,
Указанная зависимость объясняется тем, что для осуществления элементарного акта взаимодействия при соударении молекул последние должны обладать некоторой избыточной энергией по сравнению со средней энергией реагирующих молекул. Эта энергия расходуется на частичный или полный разрыв "старых" связей, так как любая химическая реакция сводится к разрушению одних и возникновению других связей. Поскольку число частиц с избытком энергии увеличивается с ростом температуры по закону Больцмана, то и скорость реакции возрастает при увеличении температуры по экспоненциальному закону. После логарифмирования отношения двух форм уравнения (1.11) при
Зная константы скорости
Порядок выполнения работы В данной работе необходимо определить порядок реакции взаимодействия персульфата аммония с йодистым калием (NH4)2S2O8 + 2KI = (NH4)2SO4 + I2 + K2SO4. Выполняют три серии опытов, в каждой из которых проводят реакцию с двумя различными начальными концентрациями по заданию преподавателя (см. схему составления растворов). 1. Первую серию опытов проводят при комнатной температуре. В сухую пробирку наливают раствор (NH4)2S2O8, затем добавляют несколько капель крахмала. В присутствии свободного йода крахмал приобретает синее окрашивание. Затем в пробирку вливают раствор тиосульфата натрия (Na2S2O3), который должен связать по реакции 2Na2S2O3 + I2 = Na2S4O6 + 2NaI ровно половину выделяющегося свободного йода. Поэтому, когда количество выделившегося йода превысит количество тиосульфата, раствор начинает изменять цвет. Последним вводят раствор иодида калия KI и засекают время. Промежуток времени от момента ввода KI в реакционную смесь до момента изменения цвета раствора и есть половинное время реакции:
2. Вторую серию опытов проводят аналогично первой, но в термостате с повышенной температурой. Для этого в две пробирки заливают заданные количества реагентов (кроме КI) и в две пробирки – раствор иодида калия. Пробирки выдерживают в термостате в течение 10 минут. Затем их содержимое сливают попарно, записывают время начала реакции и две пробирки с растворами вновь помещают в термостат, фиксируют момент изменения цвета раствора. 3. Третью серию опытов проводят с теми же концентрациями растворов при комнатной температуре, но в присутствии катализатора. Количество катализатора берут по заданию преподавателя. Катализатор прибавляют перед раствором KI. Половинное время реакции находят так же, как и в двух предыдущих сериях опытов. 4. Опытные данные заносят в таблицу. Для каждой серии опытов рассчитывают порядок реакции по уравнению (1.10). 5. Зная порядок реакции и половинное время реакции, рассчитываютконстантыскорости реакции для двух температур (1.8). По величинам констант скорости реакции при различныхтемпературах по уравнению (1.13) определяют величину энергии активации. Описывают влияние катализатора.
Рекомендуемый вид таблицы
Серия опытов | Начальная концентра-ция | Время начала реакции, мин. | Время посинения, мин. | Половинное время
|
k |
n | |||
| мин. | с | |||||||||
| 1.(Т 1=) | с 0,1 = |
| ||||||||
| с 0,2 = | ||||||||||
| 2.(Т 2=) | с 0,1 = |
| ||||||||
| с 0,2 = | ||||||||||
| 3.с катали-затором | с 0,1 = |
| ||||||||
| с 0,2 = | ||||||||||
Схема составления растворов (*)
| Исходная концентрация с 0, моль/л | Объемы растворов, см3 | |||
| (NH4)2S2O8 | Na2S2O3 | H2O | KI | |
| 0,0225 | 3,0 | 3,0 | 8,0 | 6,0 |
| 0,0300 | 4,0 | 4,0 | 4,0 | 8,0 |
| 0,0375 | 5,0 | 5,0 | – | 10,0 |
(*) Внимание: в каждую пробирку с реакционной смесью обязательно добавляют 2 капли крахмала.
Работа № 2
|
| Поделиться: |

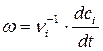 , (1.1)
, (1.1)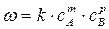 , (1.2)
, (1.2)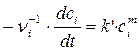 или
или 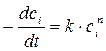 , (1.3)
, (1.3)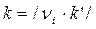 .
.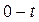 и
и 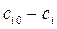 , дает (кроме n =1)
, дает (кроме n =1)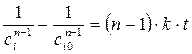 . (1.4)
. (1.4)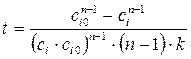 . (1.5)
. (1.5)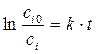 , (1.6)
, (1.6)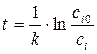 . (1.7)
. (1.7)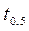 время половинного превращения, т.е. тот интервал времени, за который текущая концентрация
время половинного превращения, т.е. тот интервал времени, за который текущая концентрация 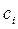 становится равной половине начальной
становится равной половине начальной 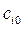 (кроме n =1):
(кроме n =1): 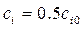 . Тогда
. Тогда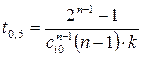 . (1.8)
. (1.8)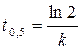 . (1.9)
. (1.9)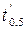 и
и 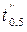 в двух опытах при T = const, но различных начальных концентрациях
в двух опытах при T = const, но различных начальных концентрациях 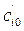 и
и 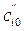 , можно рассчитать порядок реакции:
, можно рассчитать порядок реакции: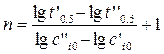 . (1.10)
. (1.10)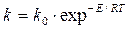 , (1.11)
, (1.11)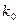 – постоянный коэффициент, или предэкспоненциальный множитель.
– постоянный коэффициент, или предэкспоненциальный множитель.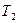 и
и 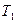 получим
получим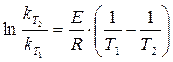 . (1.12)
. (1.12) 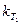 и
и 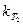 при
при 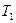 и
и 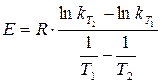 . (1.13)
. (1.13)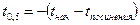 .
.



