
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика выполнения работы и ее обоснованиеСодержание книги
Поиск на нашем сайте
Для определения порядка реакции необходимо иметь экспериментальные данные об изменении концентрации реагирующих веществ во времени при T = сonst. Если мы имеем дело с реакцией первого порядка, то кинетическое уравнению имеет вид:
и в координатах
Для реакции второго порядка кинетическое уравнение или
Мы имеем прямую в координатах
В случае реакции третьего порядка кинетическое уравнение
Мы имеем прямую в координатах
Каждое кинетическое уравнение дает прямую линию только в соответствующих координатах. Если, например, опытные точки расположились на прямой линии в координатах В данной работе необходимо графическим методом определить порядок реакции взаимодействия персульфата аммония с йодистым калием (NH4)2S2O8 + 2KI = (NH4)2SO4 + I2 + K2SO4. (2.7) При комнатной температуре определяют время, за которое концентрация (NH4)2S2O8 достигает с t = 0,85 c 0; 0,75 c 0; 0,65 c 0; 0,5 c 0; 0,25 c 0. По этим данным определяют кинетические константы ( 2Na2S2O3 + I2 = Na2S4O6 + 2NaI в соединение свяжется 0,25 моль йода от всего количества, которое образуется по реакции (2.7), и в присутствии крахмала раствор посинеет при с t = 0,75 c 0. При добавлении 1,5 моль Na2S2O3 на каждый моль (NH4)2S2O8 концентрация за время от начала реакции до посинения раствора изменится от начальной до с t = 0,25 c 0. Таким образом, добавляя к реагентам Na2S2O3 в различной пропорции, фиксируют время, при котором концентрация (NH4)2S2O8 достигает заданной величины. Графическая обработка экспериментальных данных позволит определить порядок реакции и константу скорости реакции.
Порядок выполнения работы
1. В сухую пробирку наливают последовательно (см. схему составления растворов) раствор (NH4)2S2O8, затем добавляют несколько капель крахмала (индикатор), Na2S2O3 и KI. Раствор йодистого калия приливают последним и встряхивают пробирку. Момент после приливания йодистого калия в реакционную смесь и быстрого встряхивания, считают за начало реакции. Промежуток времени от начала вливания йодистого калия в реакционную смесь до момента посинения раствора и есть время изменения концентрации (NH4)2S2O8 от начальной с 0 до заданной величины с t. 2. Время от добавления KI до момента посинения раствора в пробирке и соответствующие концентрации с t заносят в таблицу.
Рекомендуемый вид таблицы
начальная концентрация c 0 =
3. Определяют порядок реакции и константу скорости 4. Для с t = 0,5 c 0 параллельно проводят еще одно определение времени реакции, поместив пробирку в термостат при повышенной температуре (по заданию преподавателя). Величину 5. Рассчитывают энергию активации по уравнению (1.13) (см. работу №1).
Схема составления растворов (*)
(*) Внимание: в каждую пробирку с реакционной смесью обязательно добавляют 2 капли крахмала.
Работа № 3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 108; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.111.44 (0.005 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

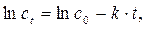 (2.1)
(2.1)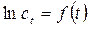 должна наблюдается прямолинейная зависимость, для которой
должна наблюдается прямолинейная зависимость, для которой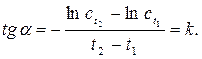 (2.2)
(2.2)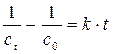
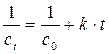 . (2.3)
. (2.3)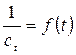 , для которой
, для которой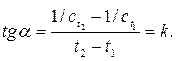 (2.4)
(2.4)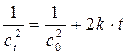 . (2.5)
. (2.5)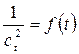 , для которой
, для которой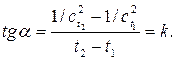 (2.6)
(2.6) 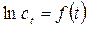 , а другие графические зависимости – кривые, то это указывает на то, что рассматриваемая реакция – реакция первого порядка. По угловому коэффициенту наклона этой прямой по отношению к оси t можно определить константу скорости реакции.
, а другие графические зависимости – кривые, то это указывает на то, что рассматриваемая реакция – реакция первого порядка. По угловому коэффициенту наклона этой прямой по отношению к оси t можно определить константу скорости реакции.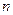 и
и 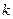 ) графическим методом. Действительно, если взять 0,5 моль Na2S2O3 на каждый моль (NH4)2S2O8, то по реакции
) графическим методом. Действительно, если взять 0,5 моль Na2S2O3 на каждый моль (NH4)2S2O8, то по реакции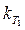 графическим методом.
графическим методом.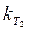 рассчитывают по половинному времени реакции
рассчитывают по половинному времени реакции 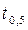 .
.


