
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изучение кинетики реакции омыленияСодержание книги
Поиск на нашем сайте
Уксусноэтилового эфира щелочью Цель работы
Определить частный порядок реакции омыления уксусноэтилового эфира по гидроксид-иону и ее энергию активации.
Вопросы коллоквиума 1. Понятие скорости химической реакции. Средняя и истинная скорость реакции, константа скорости. Зависимость скорости химической реакции от концентрации раствора. 2. Классификация химических реакций по молекулярности и порядку. 3. Дифференциальные и интегральные кинетические уравнения формально простых гомогенных реакций. 4. Способы определения порядка реакций. 5. Зависимость скорости реакций от температуры. Температурный коэффициент Вант-Гоффа. 6. Уравнение Аррениуса. Энергия активации: понятие и методы определения. 7. Основные принципы катализа. 8. Теория активированного комплекса. Применение основных положений теории для описания кинетики элементарных реакций.
Приборы и реактивы 1. Учебно – лабораторный комплекс «Химия» в комплектации: – центральный контроллер; – модуль «Электрохимия» в комплекте со стеклянным и хлоридсеребряным электродами; – модуль «Термостат» в комплекте со стаканчиком (на 100 см3), мешалкой и датчиком температуры. 2. Раствор гидроксида натрия или калия 0,01 М, уксусноэтиловый эфир. 3. Дистиллированная вода. 4. Лабораторная посуда.
Методика выполнения работы и ее обоснование Реакция омыления уксусноэтилового эфира протекает по уравнению CH3COOC2H5 + NaOH → CH3COONa + C2H5OH. Данная реакция практически необратима, протекает с заметной скоростью и является реакцией второго порядка. В общем случае выражение для скорости этой реакции можно записать
где сщ – концентрация щелочи к моменту времени t, сэф – концентрация эфира. Для определения частного порядка реакции по гидроксид-иону и ее константы скорости применяется метод избыточных концентраций (концентрация эфира берется в избытке). При избытке эфира его концентрация практически не будет изменяться и ее можно объединить с константой скорости реакции
где k1 = kcэф.. Порядок реакции снижается и интегральная форма кинетического уравнения приобретает следующий вид:
где сщ 0 – исходная концентрация щелочи. Изучение кинетики этой реакции можно проводить различными методами. В данной работе для определения концентрации щелочи используется метод потенциометрии, а именно, pH-метрия со стеклянным электродом. Стеклянный электрод – это электрод, селективный по отношению к ионам водорода, находящимся в растворе. Его потенциал зависит от активности ионов водорода следующим образом:
где Так как ионное произведение воды
Учитывая уравнение связи активности иона с его концентрацией, получим
где Таким образом, для определения концентрации гидроксид-ионов некоторого раствора можно составить цепь, состоящую из стеклянного электрода, погруженного в исследуемый раствор, и электрода сравнения, потенциал которого сохраняется постоянным в ходе эксперимента. В современной практике в качестве электрода сравнения обычно используется насыщенный хлоридсеребряный электрод (ХСЭ). Тогда, мы можем записать выражение для электродвижущей силы (ЭДС) всей цепи
Следовательно, потенциал такого элемента будет линеен относительно концентрации гидроксид-ионов при постоянном коэффициенте активности гидроксид-ионов. Согласно правилу ионной силы последнее условие будет соблюдаться при постоянной ионной силе раствора. При проведении реакции омыления эфира в водном растворе при невысоких концентрациях компонентов общее количество ионов в растворе и их зарядность будет сохраняться (практически в растворе будет происходить замена гидроксид-ионов на ацетат-ионы), поэтому ионная сила раствора также будет оставаться постоянной. Можно выразить
где Et – измеряемая разность потенциалов в момент времени t от начала опыта, E0 – разность потенциалов в начальный момент времени. Следовательно, измеряемая разность потенциалов должна изменяться линейно с течением времени. Построив график в соответствующих координатах, по тангенсу угла наклона можно определить k 1:
а константу скорости реакции – по уравнению Прямолинейность полученного графика будет указывать на первый порядок реакции по гидроксид-иону. При значениях pH раствора менее 9 будет наблюдаться отклонение графика от линейности. Это связано с гидролизом образующегося ацетата натрия. Поэтому для определения константы скорости реакции следует использовать только прямолинейный участок графика. В ходе выполнения работы проводят 2 – 3 опыта при разных температурах в интервале от комнатной температуры до 35°С (столь невысокое значение верхней границы температуры связано с ограниченным интервалом линейности характеристики стеклянного электрода при повышенных температурах). Первый опыт проводят при комнатной температуре, последующие опыты – при повышенной. В связи с тем, что при графическом определении константы скорости реакции, начальную концентрацию щелочи знать не обязательно, нет нужды определять точную концентрацию применяемого раствора щелочи. Это очень удобно, так как растворы щелочи плохо хранятся. Все же примерную концентрацию щелочи знать необходимо, для того, чтобы быть уверенными в достаточном избытке эфира, и чтобы можно было оценить значение pH раствора, что необходимо в связи с ограниченным интервалом линейности характеристики применяемого стеклянного электрода (значение pH не должно превышать 12). Так как стеклянный электрод приходит к равновесию довольно долго, то термостатировать ячейку с раствором щелочи следует прямо с установленными электродами. Во время термостатирования потенциал электрода приходит к стабильным значениям и последующее постепенное изменение концентрации щелочи в ходе реакции не приводит к значимым погрешностям, которые связанны с неравновесными условиями его измерения.
Порядок выполнения работы 1. Термостат наполняют дистиллированной водой (примерно 100 см3) и устанавливают в него стаканчик со 50 см3 предварительно приготовленного раствора щелочи (0.01 М). Термостат закрывают крышкой и устанавливают стеклянный и хлоридсеребряный электроды и термодатчик. 2. Производят подключение электродов и термодатчика. 3. Устанавливают термостат на поддержание требуемой температуры (в первом опыте в этом нет необходимости). Обеспечивают перемешивание раствора в ячейке и, когда температура ячейки установится на требуемом уровне, переходят к выполнению следующего пункта. 4. Отбирают пипеткой предварительно рассчитанный объем уксусногоэтилового эфира (эфир должен быть взят, по крайней мере, в десятикратном избытке) и вливают его в ячейку. С этого момента начинают отсчет времени опыта. 5. Прекращают перемешивание раствора в ячейке и проводят измерение ЭДС составленного гальванического элемента (E) в течение 10 мин с интервалом в одну минуту. 6. Строят график в координатах E – t и, определив тангенс его угла наклона, рассчитывают константу скорости реакции. 7. Проводят опыт при другой температуре (согласно пп. 1– 6). 8. По значениям констант скоростей реакции при разных температурах рассчитывают ее энергию активации и сравнивают полученное значение со справочными данными.
Рекомендуемый вид таблицы
Температура опыта T = °С
Работа № 5
|
|||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 408; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.46.29 (0.009 с.) |

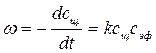 , (4.1)
, (4.1)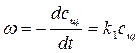 , (4.2)
, (4.2)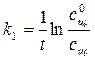 , (4.3)
, (4.3)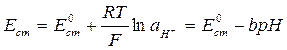 , (4.4)
, (4.4)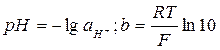 .
.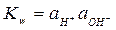 – величина постоянная при некоторой температуре, то активность ионов водорода будет связана с активностью гидроксид-ионов и выражение для потенциала электрода будет
– величина постоянная при некоторой температуре, то активность ионов водорода будет связана с активностью гидроксид-ионов и выражение для потенциала электрода будет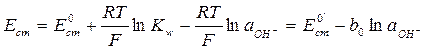 . (4.5)
. (4.5)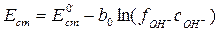 , (4.6)
, (4.6)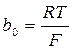 и
и 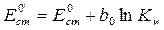 .
.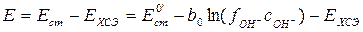 . (4.7)
. (4.7)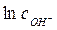 из выражения (4.7) и подставить в выражение (4.3), тогда, сократив величины, остающиеся постоянными в ходе опыта, и выразив измеряемую разность потенциалов, получим простое выражение
из выражения (4.7) и подставить в выражение (4.3), тогда, сократив величины, остающиеся постоянными в ходе опыта, и выразив измеряемую разность потенциалов, получим простое выражение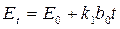 . (4.8)
. (4.8)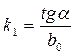 ,
,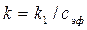 .
.


