
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика выполнения работы и ее обоснованиеСодержание книги
Поиск на нашем сайте
Исследование реакции с участием твердых фаз способствует разработке теоретических основ кинетики и служит средством познания реакционной способности твердых веществ. Отличительной особенностью гетерогенных реакций является то, что химическое взаимодействие протекает на поверхности раздела исходных и вновь образующихся фаз. Гетерогенные реакции проходят через ряд последовательных стадий: 1. Диффузию частиц реагирующих веществ к поверхности раздела фаз, где происходит химическое взаимодействие; 2. Собственно химическую реакцию; 3. Диффузию образующихся продуктов из зоны реакции; 4. Кристаллизацию полученных твердых продуктов. В зависимости от скорости протекания той или иной стадии суммарная скорость реакции может определяться химическими, диффузионными, или кристаллизационными процессами. Реакции типа А(т) = В(т) + С(г), у которых химическое взаимодействие не осложнено диффузионными процессами, называются топохимическими. Для топохимических реакций характерно нарастание скорости реакции в начальный момент процесса и достижение ею предельного значения с последующим спадом до нуля. Одним из основных признаков топохимических реакций служит S-образный вид кинетической кривой. Топохимической реакцией является реакция разложения перманганата калия: 2KMnO4(т) = K2MnO4(т) + MnO2(т) + O2(г). Реакция начинается не на всей поверхности исходного твердого вещества, а на отдельных точках, линиях и участках тела, так называемых потенциальных центрах реакции, откуда реакция постепенно распространяется вглубь кристалла. Центрами реакции являются места на поверхности кристалла KMnO4, где связи с ближайшими частицами ослаблены. К таким активным местам относятся вершины углов, ребра и некоторые точки на гранях кристалла. Особенно реакционноспособными оказываются участки с различного рода поверхностными дефектами. В начальные моменты реакции поверхность раздела между исходной и вновь образующейся фазами, которую можно назвать поверхностью реакции, ничтожно мала, поэтому мала и скорость процесса. По мере развития процесса поверхность реакции отдельных центров (зон), а, следовательно, и суммарная поверхность, растут. В результате этого растет и скорость химического взаимодействия. Скорость процесса будет иметь максимальное значение при наибольшей величине поверхности реакции, которая достигается, когда поверхности отдельных зон приходят в соприкосновение. После того, как поверхности отдельных зон перекроются, скорость реакции уменьшится вследствие сокращения суммарной поверхности реакции.
Для изучения скорости данной реакции предложен метод, основанный на измерении давления кислорода, выделившегося при разложении перманганата калия. Б.В.Ерофеевым было предложено уравнение, описывающее кинетику топохимических реакций:
где α – степень превращения, k – константа скорости реакции, t – время, r – показатель степени, определяемый опытным путем. Практическое использование уравнения (6.1) возможно после его двойного логарифмирования, приводящего к равенству вида ln (–ln (1 – α)) = ln k + r ln t. (6.2) Уравнение (6.2) является уравнением прямой. Величины k и r находят графически, откладывая на оси ординат ln (–ln (1 – α), а на оси абсцисс – ln t. По величине тангенса угла наклона полученной прямой к оси t определяют r. А из величины отрезка, отсекаемого на оси ординат, находят значение константы скорости k. Зная константы скорости, точнее ln k 1 и ln k 2 для двух температур (T 1 и T 2) и при постоянном r, можно рассчитать энергию активации по уравнению Аррениуса (1.13).
Порядок выполнения работы
1. По заданию преподавателя отбирают навеску перманганата калия, засыпают ее в керамическую лодочку. Разогревают печьдо заданной температуры. 2. Лодочку с помощью толкателя помещают в реактор из кварца, закрывают реактор резиновой пробкой со вставленной в нее стеклянной трубкой и таким образом соединяют реактор с реометром. Отмечают, на какую глубину нужно поместить реактор в печь, чтобы лодочка находилась в средней зоне печи и соединительная пробка была достаточно удалена от нагревателя. При достижении заданной температуры в печи реактор вводят в печь до отметки и включают секундомер. 3. Скорость разложения перманганата калия определяют по скорости выделения кислорода. Для этого через каждые 20 с записывают время и показания уровня жидкости в реометре (∆ h, мм вод. ст.). По окончании опыта реактор открывают и частично вытаскивают из печи. Берут в одну руку "толкатель", в другую керамическую плитку, подставленную под самый конец реактора, и извлекают толкателем лодочку из реактора на эту плитку.
4. Проводят опыт при другой температуре (согласно п. 1 – 3). Результаты опытов заносят в таблицу. 5. По результатам опытов строят графики 6. Рассчитывают ln (–ln (1 – α)), строят графики зависимости ln (–ln (1 – α)) = f (t), находят константы в уравнении Б.В.Ерофеева. 7. Рассчитывают энергию активации, делают вывод об области протекания гетерогенного процесса.
Рекомендуемый вид таблицы
Температура опыта = Навеска KMnO4 =
Работа № 7
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 84; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.248.106 (0.007 с.) |

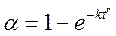 , (6.1)
, (6.1)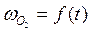 , (
, (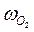 – скорость выделения O2) для каждой температуры. На графикахвыбирают во всем диапазоне 6 – 8 точек и рассчитывают степень превращения карбоната (α) за различные промежутки времени как отношение
– скорость выделения O2) для каждой температуры. На графикахвыбирают во всем диапазоне 6 – 8 точек и рассчитывают степень превращения карбоната (α) за различные промежутки времени как отношение 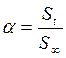 (S t – площадь под кривой
(S t – площадь под кривой 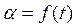 .
.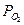 ,
Па
,
Па
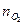 моль
моль



