
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая кинетика и катализСодержание книги
Поиск на нашем сайте
ФИЗИЧЕСКАЯ ХИМИЯ Химическая кинетика и катализ
Методические указания к лабораторным работам
Издательство Пермского государственного технического университета 2009
Составители: О.И. Бахирева, М.М.Соколова, Н.Б. Ходяшев, С.Б. Холостов, О.В. Нагорный
УДК 541.1
Рецензент д-р хим. наук Г.В. Леонтьева (Пермский государственный технический университет)
Физическая химия. Химическая кинетика и катализ: метод. указания к лаб. работам / сост. О.И. Бахирева [ и др. ]. – Пермь: Изд-во Перм. гос. техн. ун-та, 2009. – 33 с.
Содержит программу, контрольные вопросы и указания к выполнению лабораторных работ по разделу «Химическая кинетика и катализ». Выполнено в рамках ФЦП «Научные и научно-педагогические кадры инновационной России на 2009 – 2013 г.г.», госконтракт № 02.740.11.0254.
УДК 541.1
ГОУ ВПО «Пермский государственный технический университет», 2009
Содержание Общие методические указания………………………………………………………...4 Программа раздела «Химическая кинетика и катализ»………………………….5 Учебно-методические материалы……………………………………………….....6 Лабораторные работы……………………………………………………………....7 Работа № 1 Определение порядка реакции по времени полупревращения……………………………………………………..7 Работа № 2 Определение порядка реакции графическим методом…………….11 Работа № 3 Изучение кинетики реакции разложения мочевины в водных растворах………………………………………………...14 Работа № 4 Изучение кинетики омыления уксусноэтилового эфира щелочью ……………………………………………………………..17 Работа № 5 Изучение кинетики растворения малорастворимых химических соединений ………..…………………………………………………21 Работа № 6 Изучение кинетики реакции разложения перманганата калия (термический способ получения оксида марганца (IV))……..……25 Работа № 7 Изучение кинетики разложения карбонатов металлов……………28 Приложение ………………………………………………………………………33
Общие методические указания
Физическая химия относится к числу фундаментальных дисциплин и является теоретической основой для повседневной практической деятельности современного химика. Изучение физической химии обеспечивает развитие и углубление знаний по химическим законам природы и является составной частью подготовки специалистов по фундаментальным наукам. Содержание курса обеспечивает формирование у студентов навыков анализа, управления и интенсификации хода химико-технологических процессов, обоснование выбора аппаратуры проведения технологических процессов. Полученные при изучении курса сведения необходимы для успешной специализации выпускников ПГТУ как в области конкретных технологий, создания и аппаратурного оформления новых технологических процессов, так и для выполнения научно-исследовательских работ. Предметом изучения и основными задачами физической химии являются предсказание временного хода химического процесса и конечного результата (состояния равновесия) в различных условиях на основании данных о строении и свойствах частиц веществ, составляющих изучаемую систему. Программа изучения дисциплины обеспечивает приобретение знаний, умений и навыков в соответствии с ГОСами высшего профессионального образования. Основные виды учебных занятий по курсу физической химии слагаются из следующих элементов: посещение лекций и изучение лекционного материала; выполнение индивидуальных расчетных заданий; выполнение лабораторного практикума; индивидуальные консультации; сдача зачета по лабораторному практикуму; сдача экзамена по всему курсу. Химическая кинетика и катализ – это раздел физической химии, в котором изучают химические процессы, механизмы и закономерности их протекания во времени. Кинетические исследования состоят в решении таких задач, как определение порядка и константы скорости реакции, числа и характера промежуточных продуктов, энергии активации реакции, выяснения влияния катализатора и т.д. Химическая кинетика позволяет предсказывать скорость химических процессов. Для этого нужно знать механизм процесса, то есть протекание сложных реакций по стадиям. Создание математической теории химического процесса является в настоящее время необходимым условием для проектирования химических реакторов, более эффективных технологий получения химических веществ и др.
Программа раздела «Химическая кинетика и катализ»
Формальная кинетика. Скорость химической реакции. Понятия и определения. Основной постулат химической кинетики. Константа скорости реакции. Молекулярностъ и порядок реакции. Кинетические уравнения необратимых реакций нулевого, первого, второго и третьего порядков. Период полуреакции. Способы определения порядка реакции. Кинетические уравнения обратимых, параллельных и последовательных реакций. Метод стационарных концентраций. Зависимость скорости реакции от температуры. Уравнение Аррениуса. Энергия активации. Теории химической кинетики. Теория активных соударений. Выражение для константы скорости реакции. Применение теории активных соударений к мономолекулярным реакциям. Схема Линдемана. Теория переходного состояния. Теория активированного комплекса, расчет скорости реакции. Энтальпия и энтропия активации. Список основной литературы 1. Стромберг А.Г., Семченко Д.П. Физическая химия. М.: Высш. шк., 2006. – 527 с. 2. Жуховицкий А.А., Шварцман Л.А. Физическая химия. М.: Металлургия, 2001. – 687 с. 3. Вольхин В.В. Общая химия. В 3-х кн. Кн. 1. Основной курс. Пермь: Перм. гос. техн. ун-т, 2006. – 464 с. 4. Краснов К.С., Воробьев Н.К., Годнев И.Н. и др. Физическая химия. В 2-х кн. Кн. 2. Электрохимия. Химическая кинетика и катализ. М.: Высш. шк., 2001. – 319 с. 5. Киселева Е.В., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. Подольск: Промиздат, 2008. – 456 с. 6. Еремин В.В., Каргов С.И., Успенская И.А. и др. Задачи по физической химии. М.: Экзамен, 2003. – 320 с. 7. Практикум по физической химии. Под ред. Горбачева С.В., М.: Высш. шк., 1995. – 496 с. 8. Краткий справочник физико-химических величин. Под ред. Равделя А.А., Пономаревой А.М. СПб.: Изд-во Иван Федоров, 2003. – 238 с.
Лабораторные работы
Работа № 1 Цель работы Определить порядок реакции по времени полупревращения, рассчитать константы скорости при различных температурах и энергию активации.
Вопросы коллоквиума 1. Понятие скорости химической реакции. Средняя и истинная скорость реакции, константа скорости. Зависимость скорости химической реакции от концентрации раствора. 2. Классификация химических реакций по молекулярности и порядку. 3. Дифференциальные и интегральные кинетические уравнения формально простых гомогенных реакций. 4. Кинетические уравнения параллельных, последовательных, обратимых реакций. 5. Кинетические константы. Способы определения. 6. Способы определения порядка реакций. 7. Зависимость скорости реакций от температуры. Температурный коэффициент Вант-Гоффа. 8. Уравнение Аррениуса. Энергия активации: понятие и методы определения. 9. Основные принципы катализа.
Приборы и реактивы 1. Термостат 2. Водные растворы (NH4)2S2O8, Na2S2O3 и KI с концентрацией 0,15М. 3. Крахмал. 4. Дистиллированная вода. 5. Бюретки на 50 см3. 6. Пробирки.
Порядок выполнения работы В данной работе необходимо определить порядок реакции взаимодействия персульфата аммония с йодистым калием (NH4)2S2O8 + 2KI = (NH4)2SO4 + I2 + K2SO4. Выполняют три серии опытов, в каждой из которых проводят реакцию с двумя различными начальными концентрациями по заданию преподавателя (см. схему составления растворов).
1. Первую серию опытов проводят при комнатной температуре. В сухую пробирку наливают раствор (NH4)2S2O8, затем добавляют несколько капель крахмала. В присутствии свободного йода крахмал приобретает синее окрашивание. Затем в пробирку вливают раствор тиосульфата натрия (Na2S2O3), который должен связать по реакции 2Na2S2O3 + I2 = Na2S4O6 + 2NaI ровно половину выделяющегося свободного йода. Поэтому, когда количество выделившегося йода превысит количество тиосульфата, раствор начинает изменять цвет. Последним вводят раствор иодида калия KI и засекают время. Промежуток времени от момента ввода KI в реакционную смесь до момента изменения цвета раствора и есть половинное время реакции:
2. Вторую серию опытов проводят аналогично первой, но в термостате с повышенной температурой. Для этого в две пробирки заливают заданные количества реагентов (кроме КI) и в две пробирки – раствор иодида калия. Пробирки выдерживают в термостате в течение 10 минут. Затем их содержимое сливают попарно, записывают время начала реакции и две пробирки с растворами вновь помещают в термостат, фиксируют момент изменения цвета раствора. 3. Третью серию опытов проводят с теми же концентрациями растворов при комнатной температуре, но в присутствии катализатора. Количество катализатора берут по заданию преподавателя. Катализатор прибавляют перед раствором KI. Половинное время реакции находят так же, как и в двух предыдущих сериях опытов. 4. Опытные данные заносят в таблицу. Для каждой серии опытов рассчитывают порядок реакции по уравнению (1.10). 5. Зная порядок реакции и половинное время реакции, рассчитываютконстантыскорости реакции для двух температур (1.8). По величинам констант скорости реакции при различныхтемпературах по уравнению (1.13) определяют величину энергии активации. Описывают влияние катализатора.
Рекомендуемый вид таблицы
Серия опытов | Начальная концентра-ция | Время начала реакции, мин. | Время посинения, мин. | Половинное время
|
k |
n | ||||||||
| мин. | с | ||||||||||||||
| 1.(Т 1=) | с 0,1 = |
| |||||||||||||
| с 0,2 = | |||||||||||||||
| 2.(Т 2=) | с 0,1 = |
| |||||||||||||
| с 0,2 = | |||||||||||||||
| 3.с катали-затором | с 0,1 = |
| |||||||||||||
| с 0,2 = | |||||||||||||||
Схема составления растворов (*)
| Исходная концентрация с 0, моль/л | Объемы растворов, см3 | |||
| (NH4)2S2O8 | Na2S2O3 | H2O | KI | |
| 0,0225 | 3,0 | 3,0 | 8,0 | 6,0 |
| 0,0300 | 4,0 | 4,0 | 4,0 | 8,0 |
| 0,0375 | 5,0 | 5,0 | – | 10,0 |
(*) Внимание: в каждую пробирку с реакционной смесью обязательно добавляют 2 капли крахмала.
|
|
Работа № 2
Цель работы
Определить порядок реакции графическим методом, константы скорости реакции при различных температурах, рассчитать энергию активации.
Вопросы коллоквиума
1. Понятие скорости химической реакции. Средняя и истинная скорость реакции, константа скорости. Зависимость скорости химической реакции от концентрации раствора.
2. Классификация химических реакций по молекулярности и порядку.
3. Дифференциальные и интегральные кинетические уравнения формально простых гомогенных реакций.
4. Способы определения порядка реакций.
5. Зависимость скорости реакций от температуры. Температурный коэффициент Вант-Гоффа.
6. Уравнение Аррениуса. Энергия активации: понятие и методы определения.
7. Основные принципы катализа.
8. Основные закономерности протекания фотохимических реакций.
9. Кинетика цепных реакций.
Приборы и реактивы
1. Термостат
2. Водные растворы (NH4)2S2O8, Na2S2O3 и KI с концентрацией 0,15М.
3. Крахмал.
4. Дистиллированная вода.
5. Бюретки на 50 см3.
6. Пробирки.
Порядок выполнения работы
1. В сухую пробирку наливают последовательно (см. схему составления растворов) раствор (NH4)2S2O8, затем добавляют несколько капель крахмала (индикатор), Na2S2O3 и KI. Раствор йодистого калия приливают последним и встряхивают пробирку. Момент после приливания йодистого калия в реакционную смесь и быстрого встряхивания, считают за начало реакции. Промежуток времени от начала вливания йодистого калия в реакционную смесь до момента посинения раствора и есть время изменения концентрации (NH4)2S2O8 от начальной с 0 до заданной величины с t.
2. Время от добавления KI до момента посинения раствора в пробирке и соответствующие концентрации с t заносят в таблицу.
Рекомендуемый вид таблицы
начальная концентрация c 0 =
| Номер пробирки | Концентрация с t, моль/л | Время t, мин |
| 1 | с t = 0,85∙ c 0 = | |
| 2 | с t = 0,75∙ c 0 = | |
| 3 | с t = 0,65∙ c 0 = | |
| 4 | с t = 0,5∙ c 0 = | |
| 5 | с t = 0,25∙ c 0 = |
3. Определяют порядок реакции и константу скорости 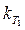 графическим методом.
графическим методом.
4. Для с t = 0,5 c 0 параллельно проводят еще одно определение времени реакции, поместив пробирку в термостат при повышенной температуре (по заданию преподавателя). Величину 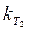 рассчитывают по половинному времени реакции
рассчитывают по половинному времени реакции 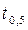 .
.
5. Рассчитывают энергию активации по уравнению (1.13) (см. работу №1).
Схема составления растворов (*)
| Номер пробирки | Концентрация с t, моль/л | Объемы растворов, см3 | |||
| (NH4)2S2O8 | Na2S2O3 | H2O | KI | ||
| 1 | с t = 0,85 c 0 | 5,0 | 1,5 | 3,5 | 10,0 |
| 2 | с t = 0,75 c 0 | 5,0 | 2,5 | 2,5 | 10,0 |
| 3 | с t = 0,65 c 0 | 5,0 | 3,5 | 1,5 | 10,0 |
| 4 | с t = 0,5 c 0 | 5,0 | 5,0 | – | 10,0 |
| 5 | с t = 0,25 c 0 | 4,0 | 6,0 | – | 8,0 |
(*) Внимание: в каждую пробирку с реакционной смесью обязательно добавляют 2 капли крахмала.
Работа № 3
В водных растворах
Цель работы
Определить величину константы скорости и энергию активации реакции разложения мочевины в водном растворе.
Вопросы коллоквиума
|
|
1. Понятие скорости химической реакции. Средняя и истинная скорость реакции, константа скорости. Зависимость скорости химической реакции от концентрации раствора.
2. Классификация химических реакций по молекулярности и порядку.
3. Дифференциальные и интегральные кинетические уравнения формально простых гомогенных реакций.
4. Способы определения порядка реакций.
5. Зависимость скорости реакций от температуры. Температурный коэффициент Вант-Гоффа.
6. Уравнение Аррениуса. Энергия активации: понятие и методы определения.
7. Основные принципы катализа.
8. Теория активных соударений. Основные положения.
9. Применение теории активных соударений для описания кинетики элементарных реакций.
Приборы и реактивы
1. Учебно – лабораторный комплекс «Химия» в комплектации:
– центральный контроллер;
– модуль «Электрохимия» в комплекте с электродами для измерения электропроводности;
– модуль «Термостат» в комплекте со стаканчиком (на 150 см3), мешалкой и датчиком температуры.
2. Мочевина.
3. Дистиллированная вода.
Порядок выполнения работы
1. Стакан в термостате наполняют дистиллированной водой (около 100 см3). Термостат закрывают крышкой, устанавливают электроды для измерения электропроводности и термодатчик. Электроды устанавливают так, чтобы они были ниже уровня воды на 0,5 – 1 см. Подключают электроды и термодатчик.
2. Устанавливают термостат на поддержание требуемой температуры (50, 60 или 70°С). Обеспечивают перемешивание воды в стакане и, когда температура в нем установится на требуемом уровне, переходят к выполнению следующего пункта.
3. Растворяют навеску (1г) мочевины. Через 1 минуту после начала растворения мочевины выключают перемешивание и начинают измерение электропроводности.
4. Проводят измерение электропроводности (L) в течение 30 минут с интервалом в 3 минуты.
5. Чтобы довести реакцию практически до конца и определить значение L ∞, температуру в термостате поднимают до 95°С и выдерживают раствор в течение 1 часа. Затем охлаждают до первоначальной температуры и определяют электропроводность L ∞.
6. Проводят опыт при другой температуре (согласно п. 1 – 5).
7. Результаты заносят в таблицу. Строят графики в координатах ln(L ∞ - Lt) – t,из которых находят L 0.
8. Вычисляют константы скорости реакции и энергию активации.
Рекомендуемый вид таблицы
Температура опыта T = °С
L ∞ = мСм
L 0 = мСм
| Время t, мин | Электропроводность Lt, мСм |
Работа № 4
Цель работы
Определить частный порядок реакции омыления уксусноэтилового эфира по гидроксид-иону и ее энергию активации.
Вопросы коллоквиума
1. Понятие скорости химической реакции. Средняя и истинная скорость реакции, константа скорости. Зависимость скорости химической реакции от концентрации раствора.
2. Классификация химических реакций по молекулярности и порядку.
3. Дифференциальные и интегральные кинетические уравнения формально простых гомогенных реакций.
4. Способы определения порядка реакций.
5. Зависимость скорости реакций от температуры. Температурный коэффициент Вант-Гоффа.
6. Уравнение Аррениуса. Энергия активации: понятие и методы определения.
7. Основные принципы катализа.
8. Теория активированного комплекса. Применение основных положений теории для описания кинетики элементарных реакций.
Приборы и реактивы
1. Учебно – лабораторный комплекс «Химия» в комплектации:
– центральный контроллер;
– модуль «Электрохимия» в комплекте со стеклянным и хлоридсеребряным электродами;
– модуль «Термостат» в комплекте со стаканчиком (на 100 см3), мешалкой и датчиком температуры.
2. Раствор гидроксида натрия или калия 0,01 М, уксусноэтиловый эфир.
3. Дистиллированная вода.
4. Лабораторная посуда.
Методика выполнения работы и ее обоснование
Реакция омыления уксусноэтилового эфира протекает по уравнению
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH.
Данная реакция практически необратима, протекает с заметной скоростью и является реакцией второго порядка. В общем случае выражение для скорости этой реакции можно записать
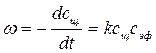 , (4.1)
, (4.1)
где сщ – концентрация щелочи к моменту времени t,
сэф – концентрация эфира.
Для определения частного порядка реакции по гидроксид-иону и ее константы скорости применяется метод избыточных концентраций (концентрация эфира берется в избытке). При избытке эфира его концентрация практически не будет изменяться и ее можно объединить с константой скорости реакции
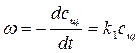 , (4.2)
, (4.2)
где k1 = kcэф.. Порядок реакции снижается и интегральная форма кинетического уравнения приобретает следующий вид:
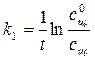 , (4.3)
, (4.3)
где сщ 0 – исходная концентрация щелочи.
Изучение кинетики этой реакции можно проводить различными методами. В данной работе для определения концентрации щелочи используется метод потенциометрии, а именно, pH-метрия со стеклянным электродом. Стеклянный электрод – это электрод, селективный по отношению к ионам водорода, находящимся в растворе. Его потенциал зависит от активности ионов водорода следующим образом:
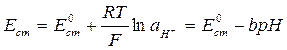 , (4.4)
, (4.4)
где 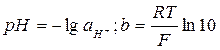 .
.
Так как ионное произведение воды 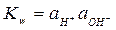 – величина постоянная при некоторой температуре, то активность ионов водорода будет связана с активностью гидроксид-ионов и выражение для потенциала электрода будет
– величина постоянная при некоторой температуре, то активность ионов водорода будет связана с активностью гидроксид-ионов и выражение для потенциала электрода будет
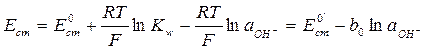 . (4.5)
. (4.5)
Учитывая уравнение связи активности иона с его концентрацией, получим
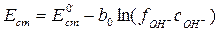 , (4.6)
, (4.6)
где 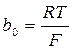 и
и 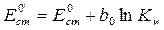 .
.
Таким образом, для определения концентрации гидроксид-ионов некоторого раствора можно составить цепь, состоящую из стеклянного электрода, погруженного в исследуемый раствор, и электрода сравнения, потенциал которого сохраняется постоянным в ходе эксперимента. В современной практике в качестве электрода сравнения обычно используется насыщенный хлоридсеребряный электрод (ХСЭ). Тогда, мы можем записать выражение для электродвижущей силы (ЭДС) всей цепи
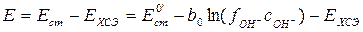 . (4.7)
. (4.7)
Следовательно, потенциал такого элемента будет линеен относительно концентрации гидроксид-ионов при постоянном коэффициенте активности гидроксид-ионов. Согласно правилу ионной силы последнее условие будет соблюдаться при постоянной ионной силе раствора. При проведении реакции омыления эфира в водном растворе при невысоких концентрациях компонентов общее количество ионов в растворе и их зарядность будет сохраняться (практически в растворе будет происходить замена гидроксид-ионов на ацетат-ионы), поэтому ионная сила раствора также будет оставаться постоянной.
Можно выразить 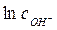 из выражения (4.7) и подставить в выражение (4.3), тогда, сократив величины, остающиеся постоянными в ходе опыта, и выразив измеряемую разность потенциалов, получим простое выражение
из выражения (4.7) и подставить в выражение (4.3), тогда, сократив величины, остающиеся постоянными в ходе опыта, и выразив измеряемую разность потенциалов, получим простое выражение
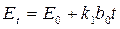 . (4.8)
. (4.8)
где Et – измеряемая разность потенциалов в момент времени t от начала опыта, E0 – разность потенциалов в начальный момент времени. Следовательно, измеряемая разность потенциалов должна изменяться линейно с течением времени. Построив график в соответствующих координатах, по тангенсу угла наклона можно определить k 1:
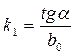 ,
,
а константу скорости реакции – по уравнению 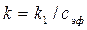 .
.
Прямолинейность полученного графика будет указывать на первый порядок реакции по гидроксид-иону. При значениях pH раствора менее 9 будет наблюдаться отклонение графика от линейности. Это связано с гидролизом образующегося ацетата натрия. Поэтому для определения константы скорости реакции следует использовать только прямолинейный участок графика.
В ходе выполнения работы проводят 2 – 3 опыта при разных температурах в интервале от комнатной температуры до 35°С (столь невысокое значение верхней границы температуры связано с ограниченным интервалом линейности характеристики стеклянного электрода при повышенных температурах). Первый опыт проводят при комнатной температуре, последующие опыты – при повышенной.
В связи с тем, что при графическом определении константы скорости реакции, начальную концентрацию щелочи знать не обязательно, нет нужды определять точную концентрацию применяемого раствора щелочи. Это очень удобно, так как растворы щелочи плохо хранятся. Все же примерную концентрацию щелочи знать необходимо, для того, чтобы быть уверенными в достаточном избытке эфира, и чтобы можно было оценить значение pH раствора, что необходимо в связи с ограниченным интервалом линейности характеристики применяемого стеклянного электрода (значение pH не должно превышать 12).
Так как стеклянный электрод приходит к равновесию довольно долго, то термостатировать ячейку с раствором щелочи следует прямо с установленными электродами. Во время термостатирования потенциал электрода приходит к стабильным значениям и последующее постепенное изменение концентрации щелочи в ходе реакции не приводит к значимым погрешностям, которые связанны с неравновесными условиями его измерения.
Порядок выполнения работы
1. Термостат наполняют дистиллированной водой (примерно 100 см3) и устанавливают в него стаканчик со 50 см3 предварительно приготовленного раствора щелочи (0.01 М). Термостат закрывают крышкой и устанавливают стеклянный и хлоридсеребряный электроды и термодатчик.
2. Производят подключение электродов и термодатчика.
3. Устанавливают термостат на поддержание требуемой температуры (в первом опыте в этом нет необходимости). Обеспечивают перемешивание раствора в ячейке и, когда температура ячейки установится на требуемом уровне, переходят к выполнению следующего пункта.
4. Отбирают пипеткой предварительно рассчитанный объем уксусногоэтилового эфира (эфир должен быть взят, по крайней мере, в десятикратном избытке) и вливают его в ячейку. С этого момента начинают отсчет времени опыта.
5. Прекращают перемешивание раствора в ячейке и проводят измерение ЭДС составленного гальванического элемента (E) в течение 10 мин с интервалом в одну минуту.
6. Строят график в координатах E – t и, определив тангенс его угла наклона, рассчитывают константу скорости реакции.
7. Проводят опыт при другой температуре (согласно пп. 1– 6).
8. По значениям констант скоростей реакции при разных температурах рассчитывают ее энергию активации и сравнивают полученное значение со справочными данными.
Рекомендуемый вид таблицы
Температура опыта T = °С
| Время t, мин | Электродвижущая сила Е, В |
Работа № 5
Химических соединений
Цель работы
Изучить закономерности скорости растворения твёрдого тела в жидкости, определить константу скорости и область прохождения гетерогенного процесса.
Вопросы коллоквиума
1. Основные стадии протекания гетерогенных процессов.
2. Кинетическая, диффузионная и переходная области осуществления гетерогенных процессов.
3. Диффузия. Скорость и коэффициент диффузии. Законы Фика.
4. Гетерогенные процессы при стационарной конвективной диффузии.
5. Растворение твердого тела в жидкости.
Приборы и реактивы
1. Учебно – лабораторный комплекс «Химия» в комплектации:
– центральный контроллер;
– модуль «Электрохимия» в комплекте с двумя стаканами (100 см3), двумя электродами в одной обойме для кондуктометрических измерений.
2. Труднорастворимые неорганические соли.
3. Дистиллированная вода.
Порядок выполнения работы
1. Подключают модуль «Электрохимия» к центральному контроллеру с помощью соединительного кабеля. Подключают центральный контроллер к сети (напряжение 220 В, частота 50 Гц). Электроды электрохимической ячейки подключают к разъёмам I вх и I вых без учёта полярности. По заданию преподавателя настраивают скорость вращения мешалки.
2. В стакан ёмкостью 100 см3 наливают дистиллированную воду и измеряют её электропроводность в миллисименсах (мСм).
3. Вносят в стакан 1 г твёрдого вещества по заданию преподавателя, включают секундомер.
4. Первые 5 мин делают измерения электропроводности раствора каждые 30 с, затем через каждые 5 мин в течение 35 – 40 мин. Последующие измерения можно проводить через 10 – 20 мин. Измерения продолжают до тех пор, пока электропроводность не достигнет постоянной величины.
5. Измеряют электропроводность насыщенного раствора данного вещества L нас.
6. Строят графики L = ƒ(t), что эквивалентно c = ƒ(t) и 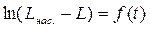 , что эквивалентно
, что эквивалентно 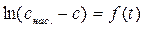 . Используя экспериментальные точки, более удовлетворительно лежащие на прямой графика, рассчитывают константу растворения k по уравнению (5.16).
. Используя экспериментальные точки, более удовлетворительно лежащие на прямой графика, рассчитывают константу растворения k по уравнению (5.16).
7. Изменяют скорость перемешивания и вновь повторяют опыт.
8. По результатам двух опытов формулируют заключение о влиянии скорости перемешивания на скорость растворения и об области протекания гетерогенного процесса.
Рекомендуемый вид таблицы
Растворяемое вещество –
L нас. = мСм
Скорость перемешивания =
| Время t, мин | Электропроводность L, мСм | L нас. – L, мСм | ln(L нас. – L) | k, мин–1 |
Работа № 6
Изучение кинетики реакции
Цель работы
Ознакомиться с методом исследования кинетики реакции разложения перманганата калия. Оценить влияние температуры на скорость реакции. Рассчитать энергию активации. Определить область прохождения гетерогенного процесса.
Вопросы коллоквиума
1. Стадии гетерогенных процессов.
2. Области осуществления гетерогенных процессов.
3. Топохимические реакции, особенности их протекания.
4. Уравнение Ерофеева.
5. Законы Фика.
6. Основные кинетические константы. Способы определения.
7. Катализ.
Приборы и реактивы
1. Печь трубчатая.
2. Реометр.
3. Керамические лодочки.
4. Перманганат калия.
Порядок выполнения работы
1. По заданию преподавателя отбирают навеску перманганата калия, засыпают ее в керамическую лодочку. Разогревают печьдо заданной температуры.
2. Лодочку с помощью толкателя помещают в реактор из кварца, закрывают реактор резиновой пробкой со вставленной в нее стеклянной трубкой и таким образом соединяют реактор с реометром. Отмечают, на какую глубину нужно поместить реактор в печь, чтобы лодочка находилась в средней зоне печи и соединительная пробка была достаточно удалена от нагревателя. При достижении заданной температуры в печи реактор вводят в печь до отметки и включают секундомер.
3. Скорость разложения перманганата калия определяют по скорости выделения кислорода. Для этого через каждые 20 с записывают время и показания уровня жидкости в реометре (∆ h, мм вод. ст.). По окончании опыта реактор открывают и частично вытаскивают из печи. Берут в одну руку "толкатель", в другую керамическую плитку, подставленную под самый конец реактора, и извлекают толкателем лодочку из реактора на эту плитку.
4. Проводят опыт при другой температуре (согласно п. 1 – 3). Результаты опытов заносят в таблицу.
5. По результатам опытов строят графики 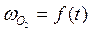 , (
, (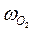 – скорость выделения O2) для каждой температуры. На графикахвыбирают во всем диапазоне 6 – 8 точек и рассчитывают степень превращения карбоната (α) за различные промежутки времени как отношение
– скорость выделения O2) для каждой температуры. На графикахвыбирают во всем диапазоне 6 – 8 точек и рассчитывают степень превращения карбоната (α) за различные промежутки времени как отношение 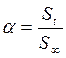 (S t – площадь под кривой
(S t – площадь под кривой 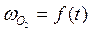 , ограниченная координатой t). Строят графики зависимости
, ограниченная координатой t). Строят графики зависимости 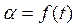 .
.
6. Рассчитывают ln (–ln (1 – α)), строят графики зависимости ln (–ln (1 – α)) = f (t), находят константы в уравнении Б.В.Ерофеева.
7. Рассчитывают энергию активации, делают вывод об области протекания гетерогенного процесса.
Рекомендуемый вид таблицы
Температура опыта =
Навеска KMnO4 =
| Время t, c | ∆ h, мм | 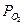 ,
Па ,
Па
| 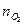 моль
моль
| ω, л∙с–1 | α | ln (–ln (1 – α)) | ln t | r | ln k |
Работа № 7
Цель работы
Исследовать влияние различных факторов (температуры, размера зерна) на скорость разложения карбонатов металлов. Рассчитать энергию активации. Определить область прохождения гетерогенного процесса.
Вопросы коллоквиума
1. Стадии гетерогенных процессов.
2. Области осуществления гетерогенных процессов.
3. Топохимические реакции, особенности их протекания.
4. Уравнение Ерофеева.
5. Законы Фика.
6. Энергия активации. Методы ее определения.
7. Теории катализа.
8. Основы кинетики каталитических процессов.
Приборы и реактивы
1. Печь трубчатая.
2. Реометр.
3. Керамические лодочки.
4. Карбонат кальция.
Методика выполнения работы и ее обоснование
Процесс разложения карбоната кальция
CaCO3(т) = CaO(т) + CO2(г)
является гетерогенным, и протекает в несколько последовательных этапов:
1. Кристаллохимическое превращение CaCO3 в CaO;
2. Десорбция СО2 с реакционной поверхности;
3. Диффузия CO2 в ядро газового потока.
По механизму протекания этих элементарных стадий их можно объединить в две группы: диффузионную и адсорбционно-химическую или кинетическую. Схематично процесс разложения карбоната можно представить следующим образом: в дефект
|
| Поделиться: |

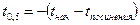 .
.
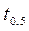 ,
,


