
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Процессы изменения состояния идеальных газовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
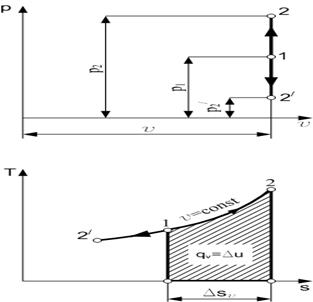
Исследования термодинамических процессов, происходящих под влиянием тех или иных причин, проводятся по двум направлениям: 1) устанавливают закономерность изменения состояния газа; 2) выявляют особенности превращения энергии. При изучении изменения состояния газа: 1 - выводят уравнение процесса и устанавливают соотношения между параметрами состояния газа; 2 - определяют количество теплоты, подводимой к газу, изменение его внутренней энергии и внешнюю работу, совершаемую газом. Часто встречаются такие процессы изменения состояния газов, которые протекают в условиях, ограничивающих характер изменения их состояния, например процессы, происходящие: 1) при постоянном объеме рабочего тела (изохорный); 2) при постоянном давлении рабочего тела (изобарный); 3) при постоянной температуре рабочего тела (изотермический); 4) при отсутствии теплообмена между рабочим телом и внешней средой (адиабатный). Изохорный процесс Примером изохорного процесса может быть нагревание или охлаждение газа в закрытом сосуде. Уравнение процесса будет иметь вид v = const. Если точка 1 характеризует начальное состояние газа, то при нагревании конечное состояние газа, в соответствии с законом Шарля, будет характеризоваться точкой 2, расположенной выше точки 1, а при охлаждении - точкой 2', расположенной ниже точки 1 (рис. 1.2).
Рис. 1.2. Изохорный процесс изменения состояния газа в p-v- и T-s-диаграммах
Если v = const, то dv = 0, и тогда Аv определяется так: Это значит, что в изохорных процессах теплота, сообщаемая газу, идет только на увеличение его внутренней энергии, а отвод теплоты возможен только за счет уменьшения внутренней энергии, то есть При наличии М, кг, или V, м3, газа Изменение энтропии в изохорном процессе определяют по равенству В T-s-диаграмме это уравнение изображается логарифмической кривой, направленной выпуклостью к оси абсцисс (рис. 1.2.). В процессе 1-2 энтропия возрастает, следовательно, теплота сообщается газу и он нагревается, а в процессе 1-2' картина противоположная. Площадь под кривой процесса графически изображает количество теплоты qv.
Изобарный процесс Уравнение изобарного процесса в p-v-координатах р = const, а его график в p-v-диаграмме - это горизонтальная прямая линия (рис. 1.3). Если точка 1 характеризует начальное состояние газа, процесс изобарного расширения будет представлен линией 1-2, а изобарного сжатия - линией 1-2'. В соответствии с законом Гей-Люссака для процесса 1-2 можно написать
Изменение внутренней энергии идеального газа в изобарных процессах определяют по формуле (1.13), а внешнюю работу газа - по общей формуле для работы расширения газа или Если допустить, что в изобарном процессе 1 кг газа нагревается на 1 градус, то Ар = R. Отсюда видно, что газовая постоянная R представляет собой работу, производимую в изобарном процессе 1 кг газа при его нагревании на 1 градус. Теплота, сообщаемая газу в изобарном процессе, может быть выражена через теплоемкость c v уравнением При наличии М, кг, или V, м3, газа
Рис. 1.3. Изобарный процесс изменения состояния газа в p-v- и T-s-диаграммах
Изменение энтропии для процесса р = const определяется по равенству В T-s-диаграмме это уравнение изображается логарифмической кривой, направленной выпуклостью к оси абсцисс (рис. 1.3). В процессе 1-2 энтропия возрастает, т. е. теплота сообщается газу. Количество подведенной теплоты графически изображается площадью под кривой процесса. Из сопоставления уравнений (1.10) и (1.13) следует, что для одинакового интервала изменения температур (от Т1 до Т2) ∆sp > ∆sv, так как ср > сv. Это означает, что в T-s-диаграмме изохора всегда круче изобары (рис. 1.4). В соответствии с уравнением первого закона термодинамики
Сокращая на AT обе части равенства, получим уравнение Майера ср – сv = R. (1.20)
Рис. 1.4. Изохорный и изобарный процессы в T-s-диаграмме.
Если уравнение первого закона термодинамики для процесса р = const написать в виде то получим и Формула (1.23) показывает, что теплота, сообщаемая идеальному газу в изобарном процессе, увеличивает его энтальпию. В дифференциальной форме уравнение для идеального газа принимает вид Это уравнение можно получить также исходя из математического определения энтальпии i. Действительно, поскольку i = U + pv то, заменяя pv = RT, получим или Уравнение (1.24) показывает, что di представляет собой элементарное количество теплоты, сообщаемой телу при нагревании в изобарном процессе, поэтому величину i назвали энтальпией (от греческого слова enthalpo - нагревание). В теплотехнических расчетах всегда необходимо знать изменение энтальпии, поэтому начало ее отсчета не имеет значения. Вообще же его принимают при 0 К или 0 °С. Изотермический процесс Уравнение этого процесса для идеального газа выражает закон Бойля-Мариотта (pv = const). График изотермического процесса в pv-диаграмме, как показывает его уравнение, будет изображаться равнобокой гиперболой, называемой изотермой. В T-s-диаграмме изотерма является прямой, параллельной оси абсцисс (рис. 1.5). Процесс расширения 1-2 в T-s-диаграмме изображается прямой, идущей вправо, поскольку расширение газа при постоянной его температуре возможно лишь при подводе теплоты к газу.
Рис. 1.5. Изотермический процесс изменения состояния газа T-s-диаграммах.
Работа процесса А т может быть определена из общего выражения для работы газа при его расширении Заменяя по уравнению состояния газа р = RT/v, находим Количество теплоты q т в T-s-диаграмме изображается площадью прямоугольника с высотой Т и основанием ∆sт, т. е. q т = T∆sт, где изменение энтропии ∆sт можно найти из уравнений (1.28) и (1.29) при подстановке Т1 = Т2, что дает: Тогда Так как изменение внутренней энергии ∆ U в изотермическом процессе идеального газа равно нулю, то Ат = q т. Адиабатный процесс Адиабатными, как уже отмечалось, называются процессы изменения состояния, происходящие без подвода и отвода теплоты от газа, т. е. когда dq = 0. При этом и q = 0. Однако не всякий процесс, для которого q = 0, будет адиабатичен. Есть процессы, на одной стадии которых теплота подводится, а на другой в том же количестве отводится.
Рис. 1.6. Адиабатный процесс изменения состояния газа в p-v- и T-s-диаграммах. Таким образом, необходимым и достаточным условием адиабатного процесса является аналитическое выражение dq = 0, означающее, что в процессе совершенно отсутствует теплообмен. При dq = 0 и Tds = 0, т. е. ds = 0, а это значит, что для обратимых адиабатных процессов s = const. Обратимый адиабатный процесс является в то же время изоэнтропным и в T-s-диаграмме обратимая адиабата будет графически изображаться прямой линией, параллельной оси Т. Площадь под кривой процесса будет отсутствовать, т. е. q = 0 (рис. 1.6).
Политропный процесс Политропными называют процессы, в которых теплоемкость имеет любое, но постоянное на протяжении всего процесса значение. Следовательно, в любом политропном процессе распределение теплоты между значениями, характеризующими изменение внутренней энергии и работу газа, остается неизменным, т. е. отношение dU / dq = cvdT / cdT = cv / c = const, где с - постоянная для данного процесса теплоемкость газа. Уравнение для политропного процесса изменения состояния газа получают из уравнения первого закона термодинамики: Уравнение политропного или обобщающего процесса изменения состояния газа Величина n = (с - ср)/(с - с v) называется показателем политропы. В том, что политропный процесс действительно является обобщающим, нетрудно убедиться, представив все рассмотренные ранее процессы как частные случаи процесса pvn = const. Например, для изобарного процесса уравнение политропы преобразуется в уравнение р = const при n = 0; для изотермы идеального газа n = 1 (pv = const при Т = const); для адиабатного процесса n = k (pvk = const) и, наконец, для изохорного процесса n = ± ∞.
3. Контрольные вопросы по первой теме 1. Что изучают в дисциплине «Теплотехника и энергетические машины»? 2. Что изучают в технической термодинамике? 3. Что такое термодинамическая система? 4. Перечислить основные термодинамические параметры. 5. Взаимосвязь плотности и удельного объема. 6. Назвать единицы измерения температуры. 7. Формула, показывающая взаимосвязь температуры в градусах Цельсия и градусах Кельвина. 8. Из чего состоит энергия рабочего тела, как ее вычисляют? 9. Назвать нормальные физические условия. 10. Написать уравнение Менделеева-Клапейрона для произвольной массы m. 11. Понятие об удельной теплоемкости, единицы ее измерения. 12. Как вычислить количество теплоты, подведенной к телу при изменении его температуры?
13. Понятие об идеальном газе и причинах его использования. 14. Что такое парциальное давление газа в смеси? 15. Математическое выражение закона Дальтона. 16. Какие процессы называют равновесными? 17. Какие процессы называют обратимыми? 18. Перечислить основные термодинамические процессы изменения состояния газа. 19. Что такое изохорный процесс изменения состояния газа, как выглядят графики для него в p-v- и T-s-диаграммах? 20. Что такое изобарный процесс изменения состояния газа, как выглядят графики для него в p-v- и T-s-диаграммах? 21. Что такое изотермический процесс изменения состояния газа, как выглядят графики для него в p-v- и T-s-диаграммах? 22. Что такое адиабатный процесс изменения состояния газа, как выглядят графики для него в p-v- и T-s-диаграммах? 23. Что такое политропный процесс изменения состояния газа, какая формула его описывает? 24. Что такое энтальпия? 25. Написать уравнение Майера. Что оно показывает? 26. Физический смысл универсальной газовой постоянной R.
|
||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 555; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.126.241 (0.01 с.) |


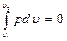 (1.9)
(1.9)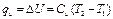 (1.10)
(1.10)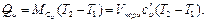 (1.11)
(1.11) 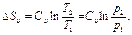 (1.12)
(1.12)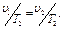 (1.13)
(1.13)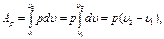 (1.14)
(1.14)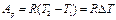 (1.15)
(1.15)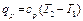 или
или 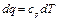 (1.16)
(1.16)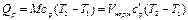 (1.17)
(1.17)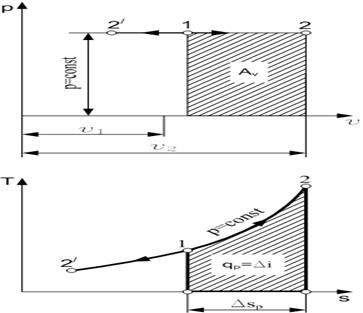
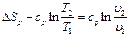 (1.18)
(1.18)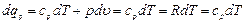 (1.19)
(1.19)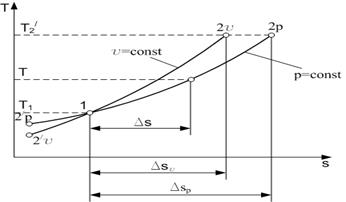
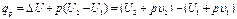 (1.21)
(1.21)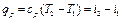 (1.22)
(1.22)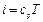 (1.23)
(1.23)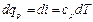 (1.24)
(1.24)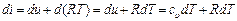 (1.25)
(1.25)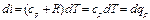 (1.26)
(1.26)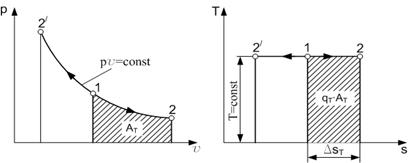
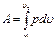
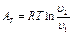 (1.27)
(1.27)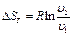 (1.28)
(1.28)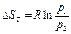 (1.29)
(1.29)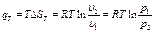 (1.30)
(1.30)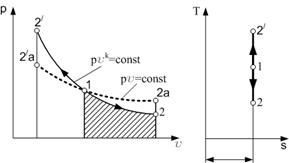
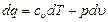 . (1.31)
. (1.31)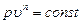 . (1.32)
. (1.32)


