Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Как функции состояния рабочего телаСодержание книги
Поиск на нашем сайте
Энергия движения молекул и внутримолекулярных колебаний идеального газа, т. е. внутренняя энергия этого газа (поскольку он характеризуется отсутствием межмолекулярного взаимодействия), определяется только степенью нагретости этого газа, т. е. его температурой. Следовательно, можно написать
или
где М - масса газа, кг. Внутренняя энергия реального газа определяется не только интенсивностью движения молекул и внутримолекулярных колебаний, но и силовым взаимодействием между молекулами, которое зависит от расстояния между ними и, следовательно, от удельного объема газа. В связи с этим его внутренняя энергия определяется не одним, а двумя параметрами, а именно или Поскольку внутренняя энергия идеального газа зависит лишь от его температуры, а внутренняя энергия реального газа - от температуры и удельного объема (или давления), т. е. от основных параметров состояния, значения которых не зависят от того, каким путем газ пришел в данное состояние, можно сделать вывод, что и внутренняя энергия газа не зависит от этого пути, т. е. что внутренняя энергия газа также является параметром его состояния. Внутреннюю энергию рабочего тела измеряют в Джоулях (Дж). Приведенные выше уравнения справедливы для газа, работающего в неподвижной системе и в том случае, если он сам по себе не перемещается, т. е. не представляет собой газовый поток или же не выталкивается из сосуда через отверстие под действием давящего на газ неизменного по величине груза.
Величину епер можно определить на основе следующих соображений. В сечении F на газ с обеих сторон действует сила давления Р, равная pF. При перемещении 1 кг газа через рассматриваемое сечение этот газ совершает работу, равную произведению силы давления Р на путь перемещения, т. е. на величину v / F. Вследствие этого Можно записать Полная энергия 1 кг газа, выталкиваемого из цилиндрического сосуда грузом Р, будет складываться из его внутренней энергии и потенциальной энергии груза, равной РН или pFH = pv (см. рис. 2.1). Поэтому в данном случае полная энергия выражается так: i = u + pv. (2.8) Величину i называют энтальпией рабочего тела. Поскольку эта величина является функцией основных термодинамических параметров состояния (T, v, р), она сама является таким же параметром и, следовательно, не зависит для каждого состояния рабочего тела от того, каким путем оно пришло в это состояние. Еще одной важной характеристикой термодинамических процессов является энтропия s. Изменение энтропии газа в процессе ∆ s и сама энтропия s не зависят от характера процесса изменения состояния газа, а определяются только начальным и конечным состояниями рабочего тела, т. е. энтропия s является функцией состояния и в соответствии с указанными уравнениями может быть выражена как функция любой пары из трех основных параметров состояния газа: Непосредственно измерить энтропию невозможно. Ее изменение можно определить только расчетным путем. При рассмотрении подавляющего числа термодинамических процессов приходится иметь дело не с абсолютной величиной энтропии, а со значением, полученным в результате ее изменения. Для измерения энтропии служит единица Дж/(кг·К).
Первый закон термодинамики
В технической термодинамике рассматривают частный случай общего закона сохранения и превращения энергии, устанавливающий эквивалентность между теплотой и механической работой. По этому закону теплота может превращаться в механическую работу или, наоборот, работа в теплоту в строго эквивалентных количествах. Это означает, что из данного количества теплоты в случае ее полного превращения в работу получается строго определенное и всегда одно и то же количество работы, точно так же, как и из данного количества работы при ее полном превращении в теплоту получается строго определенное и всегда одно и то же количество теплоты.
Поскольку в системе СИ теплота и работа выражаются в одних и тех же единицах, приведенное выше положение можно записать так: где Q - теплота; L – работа, полученная в результате использования теплоты. Первый закон термодинамики устанавливает взаимозависимость между количеством сообщенного рабочему телу или отведенного от него теплоты, величиной изменения его внутренней энергии и совершенной рабочим телом работы изменения объема. Из первого закона термодинамики следует, что полная энергия термодинамической системы в конце любого термодинамического процесса равна алгебраической сумме энергий ее в начале процесса и количества энергий, подведенных к системе и отведенных от нее в ходе процесса. Применительно к рассматриваемым в технической термодинамике процессам энергия к рабочему телу подводится или отводится от него лишь в форме теплоты или механической работы. Поэтому где Q - суммарное количество теплоты, подведенной к термодинамической системе; ∆ U - изменение внутренней энергии термодинамической системы; L - суммарная работа изменения объема термодинамической системы. Для 1 кг рабочего тела уравнение (2.11) принимает вид
или в дифференциальной форме
Выражения (2.11), (2.11'), (2.11") представляют собой общее уравнение первого закона термодинамики и означают, что в общем случае вся подводимая к термодинамической системе теплота расходуется на изменение ее внутренней энергии и на работу изменения объема системы. В развернутом виде уравнения (2.11), (2.11') и (2.11") записывают следующим образом: Эти уравнения справедливы и для потока, однако в этом случае их можно выразить и несколько иначе. Для потока уравнение первого закона термодинамики может быть выражено и через энтальпию следующим образом: Рассмотренные выше уравнения первого закона термодинамики справедливы как для идеальных газов и процессов, так и для реальных газов, протекание которых сопровождается потерями на трение и другими потерями. При неподвижном газе (т. е. газе, у которого центр тяжести оказывается неподвижным) полное количество тепла q, участвующего в процессе, складывается из подведенной из внешней среды теплоты q под и теплоты трения q тр, т. е.
а под полной работой l понимают сумму отданной работы 1от и работы трения q тр, т. е.
причем l тр = q тр. Поэтому для рассматриваемого случая уравнение первого закона термодинамики следует записать так: в дифференциальной форме: В зависимости от характера процесса и его направления каждый из членов, входящих в состав уравнения (2.11"), может быть положительным, отрицательным или равным нулю. Второй закон термодинамики Первым законом термодинамики, как это следует из предыдущего, устанавливаются: а) эквивалентность взаимных превращений теплоты и работы и, следовательно, количественные отношения между теплотой и работой при этих превращениях; б) постоянство энергии изолированной термодинамической системы; в) взаимная связь между теплотой, внутренней энергией системы и работой изменения объема, совершаемой ею или совершаемой над ней окружающей средой. Этих закономерностей недостаточно для того, чтобы на их основе можно было решить целый ряд практически важных вопросов, таких как установление факторов, определяющих условия возникновения термодинамических процессов, направление и границы их развития и условия превращения тепловой энергии в механическую. Наблюдения за явлениями природы показывают, что: а) возникновение и развитие самопроизвольно протекающих в ней естественных процессов, работа которых может быть использована для нужд человека, возможно лишь при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой; б) процессы эти всегда характеризуются односторонним их протеканием от более высокого потенциала к более низкому (от более высокой температуры к более низкой или от более высокого давления к более низкому); в) при протекании указанных выше процессов термодинамическая система стремится к тому, чтобы прийти в равновесие с окружающей средой, характеризуемое равенством давления и температуры системы и окружающей среды. Второй закон термодинамики представляет собой обобщение изложенных выше положений и заключается в том, что: 1) самопроизвольное протекание естественных процессов возникает и развивается при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой; 2) самопроизвольно происходящие в природе естественные процессы, работа которых может быть использована человеком, всегда протекают лишь в одном направлении от более высокого потенциала к более низкому; 3) ход самопроизвольно протекающих процессов происходит в направлении, приводящем к установлению равновесия термодинамической системы с окружающей средой, и по достижении этого равновесия процессы прекращаются; 4) процесс может протекать в направлении, обратном самопроизвольному процессу, если энергия для этого получается из внешней среды.
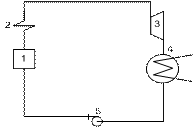
Формулировки второго закона термодинамики, данные разными учеными, приняли форму постулатов, полученных в результате развития положений, высказанных французским ученым Сади Карно. В частности, постулат немецкого ученого Клаузиуса состоит в том, что теплота не может переходить от холодного тела к теплому без компенсации. Сущность постулата английского ученого Томсона заключается в том, что невозможно осуществить цикл теплового двигателя без переноса некоторого количества теплоты от источника теплоты с более высокой температурой к источнику с более низкой температурой. Эту формулировку надо понимать так, что, для того чтобы работала периодически действующая машина, необходимо, чтобы были минимум два источника теплоты различной температуры; при этом в работу может быть превращена лишь часть теплоты, забираемой из высокотемпературного источника, в то время как другая часть теплоты должна быть передана низкотемпературному источнику. Высокотемпературный источник иногда называют теплоотдатчиком или верхним источником теплоты, а низкотемпературный - теплоприемником, нижним источником теплоты или холодильником. Наглядно суть второго закона термодинамики удобно представить себе, рассматривая работу простейшей паротурбинной установки. Такая установка (рис. 2.2) состоит из следующих элементов: парового котла 1, пароперегревателя 2 (устройства, в котором полученный в котле насыщенный пар перегревается и температура его повышается до необходимой величины), паровой турбины 3, конденсатора 4 (устройства, в котором пар, проходя между трубками малого диаметра и омывая их, охлаждается протекающей по этим трубкам водой, забираемой из внешнего водоема, и конденсируется, т. е. превращается в воду), а также питательного насоса 5. Накачиваемый в паровой котел конденсат в результате сообщения ему теплоты, выделяющейся при сжигании под котлом топлива, превращается в пар, который перегревается в пароперегревателе и по паропроводу поступает в паровую конденсационную турбину.
Рис. 2.2. Схема простейшей паротурбинной установки.
В ней часть теплоты пара в результате расширения превращается в механическую работу. Отработавший пар по выходе из турбины поступает в конденсатор, где от него охлаждающей водой отводится значительное количество теплоты, и он конденсируется. Далее конденсат поступает в питательный насос и им накачивается в паровой котел, после чего все описанные выше процессы повторяются вновь в той же последовательности.
Из рассмотрения этой схемы следует, что конденсационная паровая турбина может непрерывно работать при условии превращения пара в жидкость (конденсации); это связано с тем, что часть теплоты рабочего тела должна быть безвозвратно поглощена в конденсаторе. Аналогично этому во всякой другой теплосиловой установке можно всегда установить наличие двух разнотемпературных источников теплоты.
6. Контрольные вопросы по второй теме
1. Как можно изобразить графически равновесный термодинамический процесс? 2. В каких единицах измеряют энергию и работу? 3. Какие условия необходимы для обратимых процессов? 4. Обратимыми или необратимыми являются действительные процессы изменения состояния газов? 5. Как вычислить аналитически и графически получить величину работы, совершаемой газом при его расширении? 6. Что такое внутренняя энергия идеального газа, от чего она зависит и можно как ее определить? 7. Что такое внутренняя энергия реального газа, от чего она зависит и можно как ее определить? 8. Что такое энтальпия? Как ее можно вычислить? 9. Что такое энтропия? Как ее можно определить? 10. В каких единицах измеряют энтропию? 11. Первый закон термодинамики. 12. Взаимосвязь между теплотой и работой. В каких единицах их измеряют? 13. Второй закон термодинамики. 14. Показать суть второго закона термодинамики на примере, рассматривая работу простейшей паротурбинной установки.
|
|||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 188; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.176.80 (0.014 с.) |

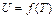 (2.3)
(2.3)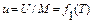 , (2.4)
, (2.4) 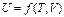 (2.5)
(2.5)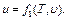 (2.5')
(2.5')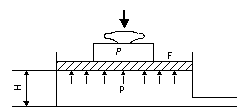 Полная энергия е 1 кг газа, движущегося в потоке через канал, в данном сечении F при скорости движения w будет складываться из внутренней энергии газа, его внешней кинетической ек и внешней потенциальной еп энергии и, наконец, из энергии перемещения епер, затрачиваемой извне на работу проталкивания газа через данное сечение. Следовательно:
Полная энергия е 1 кг газа, движущегося в потоке через канал, в данном сечении F при скорости движения w будет складываться из внутренней энергии газа, его внешней кинетической ек и внешней потенциальной еп энергии и, наконец, из энергии перемещения епер, затрачиваемой извне на работу проталкивания газа через данное сечение. Следовательно: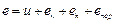 (2.6)
(2.6)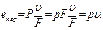
 . (2.7)
. (2.7)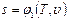 ;
; 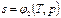 ;
; 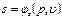 . (2.9)
. (2.9)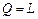 (2.10)
(2.10)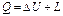 (2.11)
(2.11)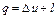 (2.11')
(2.11')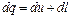 (2.11")
(2.11")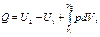 (2.12)
(2.12)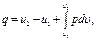 (2.12')
(2.12')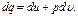 (2.12")
(2.12") (2.13)
(2.13)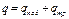 (2.14)
(2.14)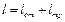 (2.14')
(2.14')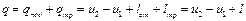 (2.15)
(2.15)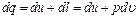 (2.15')
(2.15')