
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Давление, удельный объем, температураСодержание книги
Поиск на нашем сайте
Процесс преобразования теплоты в работу осуществляется в тепловых двигателях с помощью рабочего тела. Обычно в качестве рабочего тела используются газы и пары, так как они обладают большим коэффициентом теплового расширения и могут при нагревании совершать гораздо большую работу, чем жидкости и твердые тела. При теоретическом изучении газообразных тел (газов) обычно используют так называемый идеальный газ, между молекулами которого отсутствуют силы взаимодействия, а сами молекулы принимаются за материальные точки, которые имеют массу, но не имеют объема. В природе нет идеальных газов. Беспорядочно движущиеся молекулы газа, находящегося в замкнутом сосуде, ударяются о стенки этого сосуда. Совокупность таких ударов воспринимается стенками сосуда как некоторое непрерывно действующее на них усилие. Величину такого среднего результирующего усилия, приходящегося на единицу поверхности сосуда и действующего по нормали к ней, называют давлением газа. Давление измеряют в ньютонах на квадратный метр (н/м2).
Различают абсолютное и избыточное давление. Абсолютным называют действительное давление рабочего тела внутри сосуда. Под избыточным давлением понимают разность между абсолютным давлением в сосуде и давлением окружающей среды. Прибор для замера этой разности давлений называют манометром, а избыточное давление называют поэтому манометрическим. Когда давление в сосуде превышает давление окружающей среды где ра - абсолютное давление в сосуде; рм - манометрическое давление; рб - давление окружающей среды (барометрическое давление). Если абсолютное давление меньше давления окружающей среды, то разность между ними называют разрежением или вакуумом. Для измерения его служит вакуумметр - прибор, показывающий разность давления окружающей среды и абсолютного давления газа в сосуде. В этом случае где рн - разрежение. Для измерения небольших давлений пользуются жидкостными приборами, заполненными водой, ртутью или другой жидкостью. Под удельным объемом рабочего тела понимают объем, занимаемый массой в 1 кг этого тела. Удельный объем обозначают буквой v и измеряют в кубических метрах на килограмм (м3/кг).
Под плотностью рабочего тела понимают величину, обратную удельному объему, т. е. массу вещества в 1 м3 рабочего тела. Поэтому можно записать:
Температура является мерой степени нагретости тела. Знак разности температур двух неодинаково нагретых тел определяет направление передачи теплоты. Температуру измеряют либо по абсолютной шкале в градусах Кельвина (обозначается через Т, К), либо по Международной стоградусной шкале в градусах Цельсия (обозначается через t, °C). Соотношение между величинами Т и t определяет формула Т = t + 273,15. Состояние газа, определяемое параметрами р = 101325 н/м2 = 760 мм рт. ст. и t = 0 °C, называют нормальными условиями. В соответствии с законом Авогадро при нормальных условиях (Т = 273,16 К и p =101325 Па) объем киломоля любого газа составляет 22,4·10-3 м3/моль. Тогда Для равновесного состояния идеального газа связь между основными параметрами для единицы массы имеет вид: где R – универсальная газовая постоянная, Дж/(кг·К). Для произвольной массы m уравнение Менделеева-Клапейрона:
Энергия рабочего тела В общем случае полная энергия рабочего тела складывается из его внутренней и внешней энергии. Основной составляющей внутренней энергии U тела является тепловая энергия UT, представляющая собой совокупность кинетической энергии хаотически, поступательно и вращательно движущихся молекул, непрерывно изменяющих свою скорость по величине и направлению, энергии внутримолекулярных колебаний и потенциальной энергии сил взаимодействия молекул. Внешняя механическая энергия Емех рабочего тела состоит из кинетической энергии Ек его поступательного движения и потенциальной энергии Еп, представляющей собой энергию взаимодействия гравитационного поля с рабочим телом. Поэтому энергию Е рабочего тела его можно выразить так:
2.4. Теплоемкость газов В термодинамическом процессе изменения состояния газа в общем случае к газу либо подводится тепло, либо оно от него отводится. Поэтому для анализа термодинамических процессов необходимо владеть методом, позволяющим устанавливать в разных случаях количества подводимого или отводимого тепла. Это можно сделать, пользуясь понятием о теплоемкости газов. Под удельной теплоемкостью рабочего тела - газа (а в общем случае и всякого другого вещества) понимают то количество тепла, которое нужно сообщить единице количества газа в данном процессе изменения его состояния, чтобы повысить его температуру на 1 градус. Так как о количестве вещества судят по его массе, по его объему при нормальных условиях или по количеству киломолей, то в технической термодинамике различают три вида теплоемкостей - массовую, объемную и мольную. В первом случае речь идет о количестве тепла, необходимом для повышения температуры 1 кг газа на 1 градус; во втором случае - для повышения температуры 1 м3 газа на 1 градус и в третьем случае - для повышения температуры 1 кмоль газа на 1 градус. Единицей измерения массовой теплоемкости служит Дж/(кг·град), объемной теплоемкости - Дж/(м3·град) и мольной теплоемкости - Дж/(кмоль·град). Поэтому количество тепла, подведенного к телу при изменении его температуры на ∆t = t2 – t1, можно определить следующим образом: для М кг рабочего тела для 1 кг рабочего тела
Часто вместо термина «удельная теплоемкость» говорят «теплоемкость». Идеальные газы В тепловых двигателях в качестве рабочего тела применяют реально существующие газы, но для упрощения в технической термодинамике широко применяют понятие об идеальном газе. Под идеальным газом понимают совокупность материальных вполне упругих молекул, обладающих пренебрежимо малыми объемами, находящихся в состоянии хаотического движения и лишенных сил взаимодействия (т. е. сил взаимного притяжения и отталкивания). Отличие реального газа от идеального заключается в том, что в реальном газе в той или иной мере проявляются силы молекулярного взаимодействия, и в том, что фактически молекулы его занимают хотя и очень малые, но, тем не менее, вполне конкретные конечные по величине объемы. Чем дальше молекулы газа находятся друг от друга и чем меньше их линейные размеры по сравнению с расстояниями, отделяющими их друг от друга, тем меньше становятся силы взаимодействия между ними и тем меньше реальный газ будет отличаться от идеального газа. Ко многим применяемым в технике газам (кислороду, водороду, азоту, воздуху, окиси и двуокиси углерода, газообразным продуктам сгорания топлива) в определенном диапазоне температур и давлений можно без существенных погрешностей применять законы, справедливые для идеальных газов. Однако за пределами этого диапазона к этим газам указанные законы не применимы.
Смеси идеальных газов В теплотехнике обычно приходится встречаться не с отдельными газами, а с их смесями. Такие смеси часто образуются при горении топлива. При рассмотрении смесей газов исходят из того, что смесь идеальных газов, не вступающих в химическое взаимодействие друг с другом, также является идеальным газом и подчиняется таким же законам. При этом каждый газ, входящий в состав газовой смеси, ведет себя так, как будто он один при данной температуре занимает весь объем смеси. Давление, которое при этом оказывает каждый компонент смеси на стенки сосуда, называется парциальным, а давление газовой смеси складывается из парциальных давлений газов, образующих газовую смесь. Это положение составляет содержание закона Дальтона, установленного им для смесей газов опытным путем в 1807 году. Математически этот закон записывается следующим образом:
где Рсм - давление смеси газов; Pi - парциальное давление i-гo компонента, входящего в состав смеси; n - число компонентов, образующих смесь. Состав газовой смеси может быть задан в массовых, объемных или мольных долях. В первом случае, если обозначить массу смеси Мсм, а массу какого-то i -го компонента – Mi, и определить массовую долю этого i-гo компонента, обозначаемую через mi, т. е. mi = Mi / M см; очевидно, что
|
|||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 286; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.158.84 (0.007 с.) |

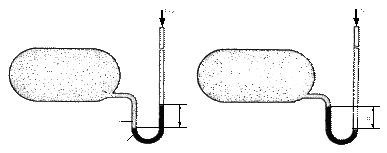 Давление газа можно измерить также высотой столба жидкости, соприкасающейся с этим газом. Если в сосуде находится газ и этот сосуд с помощью U-образной трубки соединить с окружающей атмосферой, то жидкость, залитая в трубку, при абсолютном давлении газа, превышающем окружающее атмосферное (барометрическое) давление, займет такое положение, что уровень ее в правом колене трубки будет выше, чем в левом, на высоту h (рис. 1.1, а).
Давление газа можно измерить также высотой столба жидкости, соприкасающейся с этим газом. Если в сосуде находится газ и этот сосуд с помощью U-образной трубки соединить с окружающей атмосферой, то жидкость, залитая в трубку, при абсолютном давлении газа, превышающем окружающее атмосферное (барометрическое) давление, займет такое положение, что уровень ее в правом колене трубки будет выше, чем в левом, на высоту h (рис. 1.1, а).
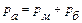 , (1.1)
, (1.1)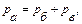 (1.2)
(1.2)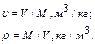
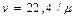 , где
, где 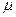 - относительная молекулярная масса газа, кг/моль.
- относительная молекулярная масса газа, кг/моль.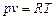 , (1.3)
, (1.3)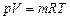 . (1.4)
. (1.4)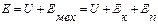 (1.5)
(1.5)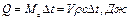 (1.6)
(1.6)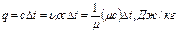 (1.6`)
(1.6`) , (1.7)
, (1.7)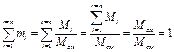 (1.8)
(1.8)


