
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вычислить жесткость воды, если в 140 л воды содержится 16,2 г ионов кальция и 2,92 г ионов магния.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1000 – перевод моль в миллимоль.
Ж =
Ответ: Ж = 7,53 ммоль/л.
Определить массу сульфата кальция в 200 л воды, если жесткость, обусловленная этой солью, равна 9 ммоль/л.
откуда
Ответ:
3. Рассчитать обменную емкость катионита КУ-2, если через адсорбционную колонку, содержащую 1 кг катионита, пропустили 2,5 м3 воды общей жесткости 13,6 ммоль/л. Написать уравнение протекающей реакции.
Na2 R + Ca2+(Mg2+, Fe2+) = 2Na+ + Ca(Mg2+, Fe2+) R;
ε =
ε =
Ответ: ε = 34 ммоль/г
УРОВЕНЬ С 1. На титрование 100 см3 воды, содержащей гидрокарбонат магния, ушло 12 см3 0,15 н раствора HCl. Написать уравнение протекающей реакции. Рассчитать жесткость воды и определить массу соли, содержащейся в 40 л этой воды.
Согласно закону эвивалентов
n экMg(HCO3)2 = n эк(HCl) = Cэк(HCl) · V
откуда
Ж =
Определяем массу гидрокарбоната магния, содержащегося в 40 л воды:
Ж =
откуда
М эк[Mg(HCO3)2] =
Ответ: Ж = 18 ммоль/л, 2. При кипячении 2 л воды (при рН > 10,3), содержащей только гидрокарбонат магния, образовался осадок массой 28 мг. Написать уравнение протекающей реакции. Определить жесткость воды и массу соли в 0,5 м3 этой воды.
Сa(HСО3)2 = CaCO3↓ + H2O + CO2↑;
Mg(HCO3)2 = Mg(OH)2↓ + 2CO2↑ (при рН > 10,3);
Fe(HCO3)2 = Fe(OH)2↓ + 2CO2.
Так как все вещества реагируют и образуются в равных количествах их эквивалентов, жесткость можно рассчитать по массе осадка гидроксида магния:
Ж =
М эк[Mg(OH)2] =
Массу гидрокарбоната магния в 0,5 м3 воды определяем по формуле
Ж = откуда
М эк[Mg(НСO3)2] =
Ответ: Ж = 0,48 моль/л,
3. Для устранения жесткости к 10 л природной воды, которая содержит 0,015 % мас. гидрокарбоната кальция и 0,005 % мас. гидрокарбоната магния, добавили гашеную известь. Плотность воды 1 г/см3. Написать уравнения протекающих реакций. Определить массу гашеной извести, необходимую для устранения временной жесткости.
Mg(HCO3)2 + 2Ca(OH)2 = Mg(OH)2↓ + 2CaCO3↓ + 2H2O.
Необходимые для расчета массы солей найдем по их массовым долям в воде:
откуда
Ж = =
М эк[Сa(НСO3)2] = М эк[Mg(НСO3)2] =
Жесткость можно также выразить через массу гашёной извести, пошедшей на ее устранение:
Ж =
откуда
М эк[Сa(OH)2] =
Ответ:
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 705; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.01 с.) |

 = 16,2 г
= 16,2 г
 = 140 л
= 140 л
 = 2,92 г
= 2,92 г
 +
+ 
 ;
;
 = 20 г/моль (мг/ммоль)
= 20 г/моль (мг/ммоль)
 =12 г/моль (мг/ммоль).
=12 г/моль (мг/ммоль). =7,53 ммоль/л.
=7,53 ммоль/л. ,
,
 –?
–?
 ;
; = 68 г/моль (мг/ммоль).
= 68 г/моль (мг/ммоль). =122,4 г.
=122,4 г.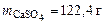
 = 2,5 м3
Жобщ = 13,6 ммоль/л
= 2,5 м3
Жобщ = 13,6 ммоль/л
 = 1 кг
= 1 кг
 ;
; = 34 ммоль/г.
= 34 ммоль/г.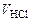 = 12 см3
= 12 см3
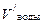 = 40 л
С эк(HCl) = 0,15 моль/л
= 40 л
С эк(HCl) = 0,15 моль/л
 =
=
=
=  .
.
 ?
Ж –?
?
Ж –?
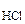 ,
, = 18 ммоль/л.
= 18 ммоль/л. ,
, =
=  =
=  = 52,56 г.
= 52,56 г. =73 г/моль (мг/ммоль);
=73 г/моль (мг/ммоль); = 28 мг = 0,028 г.
= 28 мг = 0,028 г.
 =
=  = 0,48 ммоль/л;
= 0,48 ммоль/л; 29 г/моль (мг/ммоль).
29 г/моль (мг/ммоль). ,
, ;
; 73 г/моль (мг/ммоль).
73 г/моль (мг/ммоль). = 17,52 г.
= 17,52 г. = 0,015 % мас.
= 0,015 % мас.
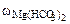 = 0,005 % мас.
= 0,005 % мас.
 = 1 г/см3
= 1 г/см3
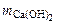 –?
–?

 ∙100;
∙100;
 ∙100,
∙100,
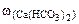 ∙10-2 ∙ m воды =
∙10-2 ∙ m воды =  = 0,015·10-2 10·103·1 = 1,5 г.
= 0,015·10-2 10·103·1 = 1,5 г.
 ∙10-2 ∙ m воды =
∙10-2 ∙ m воды =  = 0,005·10-2·10·103·1 = 0,5 г.
= 0,005·10-2·10·103·1 = 0,5 г.
 2,53 ммоль/л.
2,53 ммоль/л. 81 г/моль (мг/ммоль);
81 г/моль (мг/ммоль); 73 г/моль (мг/ммоль).
73 г/моль (мг/ммоль). ,
, =
= 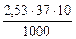 = 0,94 г.
= 0,94 г. 37 г/моль.
37 г/моль.



