
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
Решение
По табл. 11.1 находим значение стандартных электродных потенциалов железа (II) и цинка:
Так как а) Коррозия в атмосферных условиях (H2O + O2). Составляем схему коррозионного ГЭ:
А(-)Zn H2O + O2 Fe(+)K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии: НОК ДМ
На К(+) 2H2O + O2 + 4ē = 4OH- 1
2Zn + 2H2O + O2 = 2Zn(OH)2 – суммарное молекулярное уравнение процесса коррозии. б) Коррозия в кислой среде (H2SO4). Составляем схему коррозионного ГЭ:
А(-)Zn │ H2SO4 │ Fe(+)K или А(-)Zn │ H+ │ Fe(+)K Составляем уравнения электродных процессов и суммарной реакции процесса коррозии: НОК ДМ
На К(+) 2H+ + 2ē = H2 1
Zn + 2H+ = Zn2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии. Zn + H2SO4 = ZnSO4 + H2 – суммарное молекулярное уравнение процесса коррозии. в) Коррозия в кислой среде в присутствии кислорода (HCl + O2). Составляем схему коррозионного ГЭ:
А(-)Zn │ HCl + O2 │ Fe(+)K или А(-)Zn │ H+ + O2 │ Fe(+)K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии: НОК ДМ
На К(+) 4H+ + O2 + 4ē = 2H2O 1
2Zn + 4H+ + O2 = 2Zn2+ + 2H2O – суммарное ионно-молекулярное уравнение процесса коррозии. 2Zn + 4HCl + O2 = 2ZnCl2 + 2H2O – суммарное молекулярное уравнение процесса коррозии. Во всех случаях коррозионному разрушению будет подвергаться более активный металл – цинк. УРОВЕНЬ С 1. Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1 М раствор хлорида цинка, и хромовым электродом, погруженным в 1·10-3 М раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.
Хлорид цинка диссоциирует по уравнению:
ZnCl2 = Zn2+ + 2Сl-.
α = 1 (ZnCl2 – сильный электролит), Рассчитываем электродный потенциал цинка по уравнению Нернста:
= –0,76 +
Хлорид хрома (III) диссоциирует по уравнению
CrCl3 = Cr3+ + 3Сl-.
α = 1 (CrCl3 – сильный электролит), Рассчитываем электродный потенциал хрома:
Так как Составляем схему ГЭ:
А(-)Cr │ CrCl3 ││ ZnCl2 │ Zn(+)K А(-)Cr │ Cr3+ ││ Zn2+ │ Zn(+)K.
Составляем уравнения электродных процессов и суммарной тообразующей реакции:
На A(-)Cr – 3ē = Cr3+ 2 На К(+)Zn2+ + 2ē = Zn 3
2Cr + 3Zn2+ = 2Cr3+ + 3Zn – суммарное ионно-молекулярное уравнение токообразующей реакции. 2Cr + 3ZnCl2 = 2CrCl3 + 3Zn – суммарное молекулярное уравнение токообразующей реакции. Рассчитываем напряжение ГЭ:
Ответ: ε = 0,04 В.
2. Составить схему ГЭ, в котором протекает химическая реакция Fe + Ni2+ = Fe2+ + Ni. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов ∆ fG °(298 К, Me n +) рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298 К. ∆ fG °(298 К, Ni2+) = – 64,4 кДж/моль; ∆ fG °(298 К, Fe2+) = – 84,94 кДж/моль.
НОК ДМ
На К(+)Ni2+ + 2ē = Ni 1 – восстановление
Анодом ГЭ является электрод, на котором происходит процесс окисления, катодом – электрод, на котором происходит процесс восстановления. Тогда в рассматриваемом ГЭ анодом будет являться железо, катодом – никель. Составляем схему ГЭ:
А(-) Fe │ Fe2+ ║ Ni2+ │ Ni(+)K.
Рассчитываем стандартное напряжение ГЭ:
∆ rG º (298 К) = – z ∙ F ∙ εº,
ε0 =
z = 2, F = 96500 Кл/моль. Рассчитываем константу равновесия токообразующей реакции (Кc):
lgKс =
Kс = 103,6 = 3981.
Ответ: ε0 = 0,106 В, Kс = 3981. 3. Составить схему коррозионного ГЭ, возникающего при контакте железной пластинки площадью 20 см2 с никелевой в растворе соляной кислоты HCl. Написать уравнения электродных процессов и суммарной реакции процесса коррозии. а) Вычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0,5 см3 газа (н.у.). б) Вычислить весовой и глубинный показатели коррозии, если за 120 минут потеря массы железной пластинки составила 3,7∙10-3 г. Плотность железа равна 7,9 г/см3. Решение
По табл. 11.1 находим значения стандартных электродных потенциалов железа (II) и никеля (II):
Так как Составим схему коррозионного ГЭ:
А(-)Fe │ HCl │ Ni(+)K или А(-)Fe │ H+ │ Ni(+)K.
Cоставляем уравнения электродных процессов и суммарной реакции процесса коррозии:
На A(-)Fe – 2ē = Fe2+
На К(+)2Н+ + 2ē = Н2
Fe + 2H+ = Fe2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии. Fe + 2HCl = FeCl2 + H2 – суммарное молекулярное уравнение процесса коррозии. а) Рассчитываем объемный показатель коррозии K V по формуле
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород. Следовательно, V (газа) = Тогда
K V =
10–4 – коэффициент пересчета, сантиметров квадратных в метры квадратные. Рассчитываем весовой показатель коррозии K m по формуле
K m =
В процессе коррозии разрушению подвергается железо и выделяется водород. Следовательно:
М эк(Ме) = М эк(Fe) =
K m =
Ответ: K V = 375 см3/м2∙ч, K m = 0,94 г/м2∙ч. б) Рассчитываем весовой показатель коррозии K m по формуле
При расчете K m принимаем Тогда
K m =
Рассчитываем глубинный показатель коррозии по формуле
П =
Ответ: K m = 0,925 г/м2∙час, П = 1,03 мм/год.
ЭЛЕКТРОЛИЗ РАСТВОРОВ Таблица 11.1
Процессы, протекающие на катоде при электролизе водных растворов
Окончание табл. 11.1
Таблица 11.2
Последовательность окисления анионов на инертном аноде в водном растворе
Примечание. Если анод изготовлен из металлов II или III зоны (растворимый анод), то при электролизе протекает только процесс его растворения Мe0 – nē = Me n + УРОВЕНЬ А 1. В какой последовательности при стандартных условиях из раствора будут восстанавливаться Fе2+, Cu2+, Zn2+, Ag+ с одинаковой концентрацией, если напряжение внешнего источника тока достаточно для выделения любого металла? Ответ: последовательность восстановления ионов металлов из раствора будет определяться величиной их стандартного электродного потенциала (
2. Написать последовательность процессов, протекающих на инертном аноде при электролизе раствора, содержащего следующие вещества: NaCl, Na2SO4, NaOH. Ответ: последовательность окисления анионов на инертном аноде определена в табл. 11.2. Поэтому последовательность процессов на аноде будет следующая:
1. 2Cl- – 2ē = Cl2; 2. 4ОН- – 4ē = О2 + 2Н2О.
3. анион SO
2H2O – 4е = О2 + 4H+. 3. Написать уравнение объединенного закона Фарадея для определения массы (объема) вещества, выделяющегося на электродах при электролизе. Ответ: m в = УРОВЕНЬ В 1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей (анод инертный):
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 1743; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.59.231 (0.093 с.) |
 = – 0,44В,
= – 0,44В, 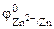 = – 0,76В.
= – 0,76В.

 На A(-) Zn – 2ē = Zn2+ 2
На A(-) Zn – 2ē = Zn2+ 2
 На A(-) Zn – 2ē = Zn2+ 1
На A(-) Zn – 2ē = Zn2+ 1
 На A(-) Zn – 2ē = Zn2+ 2
На A(-) Zn – 2ē = Zn2+ 2


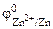 = – 0,76 В,
= – 0,76 В,  = – 0,74 В.
= – 0,74 В.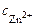 =
=  ∙ α ∙
∙ α ∙ 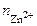 = 1 ∙ 1 ∙ 1 = 1 моль/л,
= 1 ∙ 1 ∙ 1 = 1 моль/л, =
=  =
= = – 0,76 В.
= – 0,76 В. =
=  ∙α∙
∙α∙  = 10-3 ∙ 1 ∙ 1 = 10-3 моль/л,
= 10-3 ∙ 1 ∙ 1 = 10-3 моль/л, = 1.
= 1. =
=  = –0,74 +
= –0,74 +  lg10-3 = –0,80 В.
lg10-3 = –0,80 В. <
< 

 =
=  –
–  = –0,76–(–0,80) = 0,04 В.
= –0,76–(–0,80) = 0,04 В.
 = ∆ fG º (298 К, Fe2+) – ∆ fG º (298 К, Ni2+) =
= ∆ fG º (298 К, Fe2+) – ∆ fG º (298 К, Ni2+) = .
.
 = –0,25 В.
= –0,25 В.
 , см3/м2∙ч.
При расчете K V принимаем: S – м2, τ – час, V (газа) – см3.
, см3/м2∙ч.
При расчете K V принимаем: S – м2, τ – час, V (газа) – см3.
 .
. =
=  375 см3/м2∙ч.
375 см3/м2∙ч. , г/м2∙ч.
, г/м2∙ч. = 28 г/моль,
= 28 г/моль,
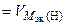 = 11200 см3/моль.
= 11200 см3/моль. = 0,94 г/м2∙ч.
= 0,94 г/м2∙ч. = 3,7·10-3 г.
S = 20 см 2
ρFe = 7,9 г/см3
= 3,7·10-3 г.
S = 20 см 2
ρFe = 7,9 г/см3

 , г/м2∙ч.
Коррозии подвергается железо. Тогда потеря массы металла
, г/м2∙ч.
Коррозии подвергается железо. Тогда потеря массы металла

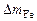 .
.
 =
=  = 0,925 г/м2∙ч.
= 0,925 г/м2∙ч.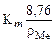 =
=  мм/год.
мм/год. В
В
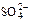 ,
,  ,
,  и др.), то они на аноде не окисляются, а концентрируются в околоанодном пространстве (анолите). На аноде окиcляются только молекулы воды:
2H2O – 4е = О2+4H+
и др.), то они на аноде не окисляются, а концентрируются в околоанодном пространстве (анолите). На аноде окиcляются только молекулы воды:
2H2O – 4е = О2+4H+
 ). Ионы металлов будут восстанавливаться в порядке уменьшения величины их стандартного электродного потенциала (см. табл. 11.1).
). Ионы металлов будут восстанавливаться в порядке уменьшения величины их стандартного электродного потенциала (см. табл. 11.1). В
В

 будет концентрироваться в анолите. На аноде будет протекать процесс
будет концентрироваться в анолите. На аноде будет протекать процесс ,
,  =
=  .
.


