
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнять реакцию. Указать окислитель и восстановитель.
KCrO2 + Br2 + KOH → KBr + K2Cr2O7 + H2O. Определить массу KCrO2, необходимую для взаимодействия с 4 г брома.
Решение
КCr+3O2 + Br20 + KOH = KBr восст. окисл. среда
окисл-ль Br20 + 2ē = 2Br– 3 восст-ль Cr+3 – 3ē = Cr+6 2
3Br20 + 2Cr+3 = 6Br
2KCrO2 + 3Br2 + 6KOH → 6KBr + K2Cr2O7 + 3H2O.
Согласно уравнению реакции 2 моль KCrO2 реагирует с 3 моль Br2, т.е. 2М
Ответ:
Уравнять реакцию H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O. Указать окислитель и восстановитель. Определить Сэк(Н2S), если на взаимодействие с 3,16 г KMnO4 ушло 200 см3 раствора H2S.
Решение
H2S-2 + KMn+7O4 + H2SO4 = Sº + Mn+2SO4 + K2SO4 + H2O восст. окисл. cреда НОК ДМ
окисл-ль Mn+7 + 5ē = Mn+2 2
5S-2 + 2Mn+7 = 5Sº + 2Mn+2
Переносим полученные коэффициенты в молекулярное урав-нение:
5H2S + 2KMnO4 + H2SO4 = 5S + 2MnSO4 + K2SO4 + H2O.
Подсчитываем количество H2SO4, необходимое для получения
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + H2O.
Уравниваем количество водорода и кислорода (8Н2О):
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O.
По закону эквивалентов n эк(H2S) = n эк(KMnO4)
где
Ответ: Уравнять реакцию KI + CuCl2 <=> CuCl + KCl + I2. Указать окислитель и восстановитель. Определить направление протекания и константу равновесия реакции при стандартных условиях.
НОК ДМ НОК ДМ
1 2 Cu+2 + e- = Cu+1 1 2
2KI + 2CuCl2 <=> 2CuCl + 2KCl + I2.
Определяем стандартные электродные потенциалы электрохимических систем, участвующих в реакции: I2 + 2e- = 2I- φ Cu2+ + e- = Cu+ φ Из двух приведенных окислителей более сильным будет I2, поскольку φ
I2 находится в продуктах реакции, следовательно, реакция будет протекать справа налево, т.е. реально протекающей будет реакция
2CuCl + 2KCl + I2 <=> 2KI + 2CuCl2.
тогда Δ rG º(298 K) = – z · F · ε0,
где z – число отданных или принятых электронов (НОК); ε˚ – стандартное напряжение ОВР, В. Ε0 = φ0ок – φ0восст ε˚ = Δ rG °(298 K) = –2 · 96500 · 0,39 = –75270 Дж,
Высокое значение Kс свидетельствует о смещении равновесия вправо. Ответ: Кс =1,66·1013; Δ rG º(298 K) = -75,27 кДж; реакция протекает справа налево; окислитель – I2; восстановитель – CuCl.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ. КОРРОЗИЯ МЕТАЛЛОВ. УРОВЕНЬ А 1. Железная деталь находится в кислой коррозионной среде. Определить, какими из металлов возможно осуществить анодную защиту детали: а) Ti; б) Ni; в) Cu; г) Zn.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 395; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.1.232 (0.008 с.) |

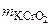 –?
–?
 + K2Cr2+6O7 + H2O
+ K2Cr2+6O7 + H2O
 НОК ДМ
НОК ДМ
 – 3М
– 3М 
 –
– 
 =
=  = 2,05 г.
= 2,05 г. 3,16 г
3,16 г
 = 200 см3
= 200 см3


 восст-ль S-2 – 2ē = Sº 5
восст-ль S-2 – 2ē = Sº 5
 .
. =
=  , г/моль,
, г/моль, – число электронов, принятых одной молекулой KMnO4.
– число электронов, принятых одной молекулой KMnO4. г/моль.
г/моль. ·0,2 =
·0,2 =  = 0,1.
= 0,1. =
=  = 0,5 моль/л.
= 0,5 моль/л. окислитель – KMnO4, восстановитель – Н2S.
окислитель – KMnO4, восстановитель – Н2S. I-1 – 1e- = I
I-1 – 1e- = I  1 2
1 2 2I-1 + 2Cu+2 = 2Cu+1 + I
2I-1 + 2Cu+2 = 2Cu+1 + I 
 = +0,54 B (таблица);
= +0,54 B (таблица);
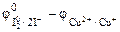 = 0,54 – 0,15 = 0,39 В.
= 0,54 – 0,15 = 0,39 В. = 1,66·1013.
= 1,66·1013.


