
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Составить ионно-молекулярное и молекулярное уравнение гидролиза хлорида железа (III). Вычислить константу, степень и рН гидролиза соли в 0,01М растворе.
Сокращенное ионно-молекулярное уравнение гидролиза
Молекулярное уравнение гидролиза
FeCl3 + H2O <=> FeOHCl2 + HCl;
pН = –1/2∙lgKг – 1/2∙lg
Ответ:
2. Используя справочные данные по Δ fH º(298 K) и S º(298 К) веществ, определить равновесное парциальное давление СО при температуре 1000 К для реакции Fe3O4(к) + 4C(к) = 3Fe(к) + 4CO(г).
-2,3 R TlgKp = Δ rH º(298 K) – T Δ rS º(298 K).
Значения Δ fH º(298 K) и S º(298 K) веществ берем из таблицы.
Δ rH º(298 K) = [4Δ fH º(298 K,CO(г)) + 3Δ fH º(298 K, Fe(к))] – – [Δ fH º(298 K, Fe3O4(к))+ 4Δ fH °(298 K,C(к))].
Δ rH º(298 K) = 4(–110,5) – (–1117,1) = 675,1 кДж. Δ rS º(298 K) = [4 S º(298 K, CO(г)) + 3 S º(298 K, Fe(к))] – – [ S º(298 K, Fe3O4(к)) + 4 S º(298 K, C(к))].
Δ rS º(298 K) = [4·197,5 + 3∙27,15] – [146,2 + 4·5,7] = 702,45 Дж/К.
Kp =
Kp =
р CO =
Ответ: р CO = 2,3 атм.
3. При растворении 6 г сплава меди, железа и алюминия в соляной кислоте выделилось 3 л водорода (н.у.) и получено 1,86 г нерастворившегося осадка. Определить состав сплава (% мас.).
2Al + 6HCl = 2AlCl3 + 3H2. (19.4)
Медь в этих условиях не растворяется, следовательно:
m н.о = m Cu = 1,86 г.
m Fe+Al = m спл – m Cu= 6 – 1,86 = 4,14 г.
Пусть х – масса железа в сплаве, г; Fe → H2 (реакция (19.3)) 56 г Fe – 22,4 л Н2 х г Fe – V
V
Тогда (4,14 – х) – масса алюминия в сплаве, г;
2 Al → 3H2 (реакция (19.4)) 2∙27 г Al – 3·22,4 л Н2 (4,14 – х) г Al – V
V
Суммарный объем выделившегося водорода:
V х = 2,56 г
Следовательно m Fe = 2,56 г, m Al = 4,14 – 2,56 = 1,58 г.
ωFe = ωAl = ωCu =
Ответ: состав сплава: ωFe = 43 % мас., ωAl = 26 % мас.,ωCu = 31 % мас.
Литература
Задачи и упражения по химии / Г.А. Бурак [и др.]; под ред Приложения Приложение 1 Индивидуальные домашние задания.
ПРиложение 2
ОСНОВНЫЕ ВОПРОСЫ КУРСА ХИМИИ
РК-1
1. Закон сохранения массы–энергии. Закон Авогадро. Атомные и молярные массы. Моль. 2. Методы определения молярных масс газообразных веществ. Парциальное давление газа. Закон Дальтона. 3. Оксиды. Классификация. Свойства. Номенклатура. 4. Кислоты и основания. Классификация. Свойства. Номенклатура. 5. Соли. Классификация. Свойства. Номенклатура. 6. Эквивалент. Закон эквивалентов. Расчет молярных масс эквивалентов простых и сложных веществ. 7. Растворы. Молярная концентрация; молярная концентраця эквивалентов растворенного вещества. Моляльность. 8. Массовая и молярная доля растворенного вещества. Плотность раствора, титр раствора вещества. 9. Химическая термодинамика. Изохорный тепловой эффект химической реакции. Внутренняя энергия. 10. Изобарный тепловой эффект химической реакции. Энтальпия. Стандартные энтальпии образования и сгорания химических веществ. 11. I и II закон термохимии. I и II следствия из закона Гесса. 12. Энтропия. Стандартная энтропия химических соединений. Расчет изменения энтропии химических реакций. 13. Энергия Гиббса. Стандартная энергия Гиббса образования химических соединений. Расчет изменения энергии Гиббса химических реакций. 14. Энергия Гиббса и направленность протекания химических реакций.
РК-2
1. Скорость химических реакций. Средняя и истинная скорость реакций. Зависимость скорости реакции от концентрации реагирующих веществ. Молекулярность и порядок реакции. 2. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации. 3. Скорость химических реакций в гетерогенных системах. Катализ. 4. Химическое равновесие в гомогенных и гетерогенных системах. Константа равновесия и ее связь с термодинамическими функциями. 5. Принцип Ле-Шателье. 6. Физические и химические свойства воды. Диаграмма состояния воды. 7. Законы Рауля и Вант-Гоффа для растворов неэлектролитов. 8. Теория электролитической диссоциации. Степень и константа диссоциации. Сильные и слабые электролиты. 9. Активность ионов. Кажущаяся степень диссоциации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов. 10. Ионное произведение воды. рН растворов. Произведение растворимости. Ионно-молекулярные уравнения. 11. Основные случаи гидролиза одно- и многозарядных ионов. Усиление и ослабление процесса гидролиза. 12. Константа, степень и рН гидролиза.
РК-3
1. Степень окисления. Типичные окислители и восстановители. 2. Реакции окисления-восстановления. Метод электронного баланса. Молярные массы эквивалентов окислителей и восстановителей. 3. Направление протекания и константа равновесия окислительно-восстановительных реакций. 4. Электродный потенциал, его измерение, стандартный электродный потенциал. 5. Ряд стандартных потенциалов металлических электродов. Зависимость значения электродного потенциала от концентрации и рН электролита. 6. Гальванические элементы (ГЭ), напряжение ГЭ. Современные ГЭ. 7. Аккумуляторы (щелочные и кислотные). Материалы анода и катода. Процессы, протекающие при зарядке и разрядке аккумуляторов. 8. Коррозия металлов. Химическая и электрохимическая коррозия металлов. 9. Показатели коррозии (весовой, объемный и глубинный). Методы защиты металлов от коррозии. 10. Электролиз растворов и расплавов. Поляризация электродов. Перенапряжение. Потенциал разложения. 11. Последовательность электродных процессов на аноде и катоде при электролизе растворов. Схемы электролиза растворов с инертными электродами и растворимым анодом. 12. Законы Фарадея. Выход по току. 13. Общие свойства металлов. Взаимодействие металлов с водой, кислотами и щелочами. 14. Способы получения металлов. Пиро- и гидрометаллургические процессы. 15. Комплексные соединения, их строение, номенклатура и диссоциация в растворах. 16. Жесткость воды и способы ее устранения. 17. Синтетические полимеры. Реакции полимеризации и поликонденсации.
ОСНОВНЫЕ ВОПРОСЫ КУРСА ХИМИИ ДЛЯ СТУДЕНТОВ МТФ I СЕМЕСТР
I блок
1. Закон сохранения массы–энергии. Закон Авогадро. Атомные и молярные массы. Моль. 2. Методы определения молярных масс газообразных веществ. Парциальное давление газа. Закон Дальтона. 3. Оксиды. Классификация. Свойства. Номенклатура. 4. Кислоты и основания. Классификация. Свойства. Номенклатура. 5. Соли. Классификация. Свойства. Номенклатура. 6. Эквивалент. Закон эквивалентов. Расчет молярных масс эквивалентов простых и сложных веществ. 7. Растворы. Молярная концентрация; молярная концентрация эквивалентов растворенного вещества. Моляльность.
8. Массовая и молярная доля растворенного вещества. Плотность раствора, титр раствора вещества. 9. Химическая термодинамика. Изохорный тепловой эффект химической реакции. Внутренняя энергия. 10. Изобарный тепловой эффект химической реакции. Внутренняя энергия. Энтальпия. Стандартные энтальпии образования и сгорания химических веществ. 11. I и II закон термохимии. I и II следствия из закона Гесса. 12. Энтропия. Стандартная энтропия химических соединений. Расчет изменения энтропии химических реакций. 13. Энергия Гиббса. Стандартная энергия Гиббса образования химических соединений. Расчет изменения энергии Гиббса химических реакций. 14. Энергия Гиббса и направленность протекания химических реакций.
II блок
1. Скорость химических реакций. Средняя и истинная скорость реакций. Зависимость скорости реакции от концентрации реагирующих веществ. Молекулярность и порядок реакции 2. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации. 3. Скорость химических реакций в гетерогенных системах. Катализ. 4. Химическое равновесие в гомогенных и гетерогенных системах. Константа равновесия и ее связь с термодинамическими функциями. 5. Принцип Ле-Шателье. 6. Физические и химические свойства воды. Диаграмма состояния воды. 7. Законы Рауля и Вант-Гоффа для растворов неэлектролитов. 8. Теория электролитической диссоциации. Степень и константа диссоциации. Сильные и слабые электролиты. 9. Активность ионов. Кажущаяся степень диссоциации. Изотонический коэффициент. Законы Рауля и Вант-Гоффа для растворов электролитов. 10. Ионное произведение воды. рН растворов. Произведение растворимости. Ионно-молекулярные уравнения. 11. Основные случаи гидролиза одно- и многозарядных ионов. Усиление и ослабление процесса гидролиза. 12. Константа, степень и рН гидролиза.
III блок
1. Степень окисления. Типичные окислители и восстановители.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 309; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.141.6 (0.043 с.) |
 0,01 M
0,01 M


 ,
,
 (таблица);
(таблица); ;
; ;
;  = 0,84;
= 0,84; =
=

 .
. р
р  .
.
 –?
–?
 .
. = 26,9
= 26,9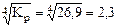 атм.
атм.
 = 3 л
m н.о = 1,86 г
= 3 л
m н.о = 1,86 г
 ∙ 100 %.
В соляной кислоте растворяются железо и алюминий согласно следующим уравнениям реакций:
Fe + 2HCl = FeCl2 + H2 (19.3)
∙ 100 %.
В соляной кислоте растворяются железо и алюминий согласно следующим уравнениям реакций:
Fe + 2HCl = FeCl2 + H2 (19.3)
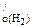
 , л.
, л.
 , л.
, л. + V
+ V 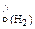 =
=  ;
; ;
; .
.


