
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Указать окислитель и восстановитель.
Определить Сэк(Na2S), если на взаимодействие с 4 г KMnO4 ушло 250 см3 раствора Na2S.
Решение
Na2S-2 + KMn+7O4 + H2O→ Mn+4O2 + Na2S+6O4 + KOH.
НОК ДМ
окисл-ль Mn+7 + 3e = Mn+4 8
3S-2 + 8Mn+7 = 3Sº + 8Mn+4
Переносим полученные коэффициенты в молекулярное уравнение. Уравниваем число ионов К+ и определяем количество воды → 4Н2О:
3Na2S +8KMnO4 + 4H2O = 8MnO2 + 3 Na2SO4 + 8KOH. По закону эквивалентов
n эк(Na2S) = n эк(KMnO4);
где n e – число электронов, принятых одной молекулой KMnO4.
Ответ:
Уравнять реакцию Mn(OH)4 + HCl → MnCl2 + H2O + Cl2. Указать окислитель и восстановитель. Определить объем газа (н.у.), выделяющийся при взаимодействии 8 г гидроксида марганца (IV) с соляной кислотой.
окисл-ль Mn+4 + 2e = Mn+2 1
2Cl-1 + Mn+4 = Cl20 + Mn+2 Переносим полученные коэффициенты в молекулярное уравнение, окончательно уравниваем его, учитывая при этом количество ионов Cl-1, необходимое для получения MnCl2:
Mn(OH)4 + 4HCl = MnCl2 + Cl2 + 4H2O.
М 123 г – 22,4 л 8 г – х л х =
Ответ: V
Уравнять реакцию MnO2 + KClO3 + KOH → K2MnO4 + KCl + H2O. Указать окислитель и восстановитель. Определить массу оксида марганца (IV), необходимую для восстановления 150 см3 1 н раствора KСlO3.
НОК ДМ
окисл-ль Cl+5 + 6e = Cl- 1
3Mn+4 + Cl+5 = 3Mn+6 + Cl-
Переносим полученные коэффициенты в молекулярное уравнение, уравниваем число К+, а затем Н и О: 3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O/
По закону эквивалентов
n эк(KClO3) = n эк(MnO2);
V
M эк(MnO2)
m
m
Ответ: m
МЕТАЛЛЫ VIII ГРУППЫ УРОВЕНЬ А 1. Определить заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединении Na3[Co(CN)6]. Решение
Заряд комплексного иона [Co(CN)6]3- равен суммарному заряду ионов внешней сферы, но противоположен ему по знаку.
Степень окисления комплексообразователя определяется по заряду комплексного иона: х –
х + 6∙(-1) = -3, откуда х = 3, таким образом, заряд комплексообразователя Со3+. Координационное число комплексообразователя (Со3+) равно суммарному числу лигандов (СN-), окружающих комплексообразователь, т.е. кч
Ответ: [Co(CN)6]3-, Со3+, кч Написать сокращенные электронные формулы атомов железа и иридия и указать расположение валентных электронов по подуровням.
Решение
Ответ:
3. Раствор содержит ионы Fe2+, Pd2+, Ni2+ в одинаковой концентрации. В какой последовательности эти ионы будут выделяться при электролизе, если напряжение достаточно для выделения любого металла? Решение
Приведенные ионы будут восстанавливаться на катоде в порядке уменьшения их стандартных электродных потенциалов:
Ответ: ионы будут восстанавливаться в следующей последовательности: Pd2+, Ni2+, Fe2+ (+0,83; -0,25; -0,44 В). УРОВЕНЬ В 1. Используя справочные значения изменений стандартных энергий Гиббса образования веществ, определить возможность самопроизвольного протекания реакции: OsО4(к) +4Н2(г) = Os(к) + 4Н2О(ж) при стандартных условиях. Ответ мотивировать расчетом ΔrG°(298K).
если Δ rG °(298 К) < 0, то самопроизвольное протекание реакции при заданных условиях возможно; если Δ rG °(298 К) > 0, то при заданной температуре реакция невозможна.. Значение Δ rG °(298 К) определяем по первому следствию из закона Гесса:
D rG o(298 K) = [D fG o(298 K, Os(к)) + 4D fG o(298 K, H2O(ж))] – – [D fG o(298 K, OsO4(к)) + 4D fG o(298 K, Н2(г))].
Тогда:
Δ rG °(298 К) = 4(-237,3) – (-302,5) = -646,7 кДж.
Ответ: так как Δ rG °(298 К) < 0, то самопроизвольное протекание реакции возможно. 2. Вычислить концентрацию ионов железа в 0,01 М растворе K3[Fe(CN)6], содержащем, кроме того, 0,02 моль/л цианида калия. Константа нестойкости иона [Fe(CN)6]3- в водном растворе равна 1.10-31.
K3[Fe(CN)6] = [Fe(CN)6]3-+3К+.
Концентрация комплексного иона [Fe(CN)6]3- равна 0,01 моль/л, так как из одной молекулы комплексной соли образуется один комплексный ион. Константа нестойкости комплексного иона [Fe(CN)6]3- характеризует следующий равновесный процесс:
[Fe(CN)6]3- <=>Fe3+ + 6CN- (вторичная диссоциация); (19.1)
Присутствие цианида калия в растворе смещает равновесие диссо-циации комплексного иона (19.1) влево вследствие возрастания концентрации одноименного иона CN-, образующегося при диссоциации KCN:
КCN = К+ + СN-.
После смещения равновесия устанавливается новое равновесие. Концентрацию Fe3+ в новом равновесии принимаем равной х моль/л. Общая равновесная концентрация [CN-] равна сумме концентраций CN-, образовавшихся при диссоциации КCN и [Fe(CN)6]3-:
[CN-] = из [Fe(CN)6]3- из КCN
из [Fe(CN)6]3-
из КCN так как КCN сильный электролит, α = 1, Тогда
[CN-] = (6 х + 0,02) моль/л.
Вследствие малого значения х принимаем
6 х + 0,02 ≈ 0,02 моль/л.
Таким образом, выражение (19.2) примет вид
откуда
х = [Fe3+] =
Ответ: [Fe3+] = 1,56·10-23 моль/л.
3. Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей: а) сульфата кобальта (II), б) хлорида палладия (II) (анод инертный). Какие продукты выделяются на аноде и катоде?
На катоде выделяется Co и Н2, на аноде выделяется О2.
б) PdCl2 = Pd2+ + 2Cl- K(-) A(+) инертный Pd2+ + 2ē = Pd 2Cl - – 2ē = Cl2 H2O H2O
На катоде выделяется Pd, на аноде выделяется Cl2.
УРОВЕНЬ С
|
|||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 222; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.150.163 (0.031 с.) |
 4 г
4 г
 = 250 см3 = 0,25 л
= 250 см3 = 0,25 л

 восст-ль S-2 – 8e = S+6 3
восст-ль S-2 – 8e = S+6 3
 ;
; =
=  , г/моль,
, г/моль, г/моль.
г/моль. =
=  моль/л.
моль/л. моль/л.
моль/л. = 8 г
= 8 г
 –?
–?

 НОК ДМ
НОК ДМ восст-ль Cl-1 – e = Cl0 2
восст-ль Cl-1 – e = Cl0 2

 = 1,46 л.
= 1,46 л. = 150 см3 = 0,15 л
с эк(KClO3) = 1 моль/л
= 150 см3 = 0,15 л
с эк(KClO3) = 1 моль/л
 –?
–?
 восст-ль Mn+4 – 2e = Mn+6 3
восст-ль Mn+4 – 2e = Mn+6 3
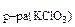 · с эк(KClO3) =
· с эк(KClO3) =  ;
;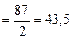 г/моль;
г/моль; ;
;
 = 6.
= 6.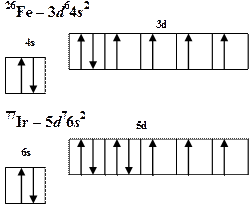
 = 0,83 В,
= 0,83 В,  = –0,25 В,
= –0,25 В,  = –0,44 В.
= –0,44 В. = 0,01 моль/л,
с KCN = 0,02 моль/л,
Кн = 1.10-31.
= 0,01 моль/л,
с KCN = 0,02 моль/л,
Кн = 1.10-31.
 . (19.2)
. (19.2) +
+  = 6 х, моль/л;
= 6 х, моль/л; =
=  ·α·
·α· 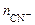 = 0,02·1·1 = 0,02 моль/л,
= 0,02·1·1 = 0,02 моль/л, = 1.
= 1. ,
, 1,56·10-23 моль/л.
1,56·10-23 моль/л.


