
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стабилизация воды с повышенной карбонатной жесткостью подкислениемСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Стабильность – один из основных показателей качества воды. Она обусловлена соотношением содержания различных форм углекислоты в воде (НСО3–; СО32–; СО2). Условия стабильности определяются с помощью индекса стабильности J, имеющего название индекса насыщения или индекса Ланжелье:
Знак индекса определяют свойства углекислотных соединений воды. Так, при J = 0 вода стабильна; при J < 0 водa коррозионна; при J > 0 вода нестабильна. Основная часть воды, расходуемая на производственные нужды, тратится на охлаждение, агрегатов (промышленные печи разных производств, конденсаторы паротурбин, компрессоры и т. п.), такая вода должна быть стабильной; при нагреве не давать отложений карбоната кальция CaCО3 на поверхностях, с которыми она соприкасается; не вызывать коррозию труб и оборудования. Образование отложений в системах водяного охлаждения вызвано тем, что находящиеся в природных водах бикарбонаты кальция Ca(HCO3)2 при нагреве выше 35–40°C распадаются, что нарушает углекислотное равновесие:
Бикарбонат магния Mg(HCО3)2 практически не образует отложений ввиду сравнительно большой растворимости карбоната магния. В природных водах карбонатная жесткость равна щелочности, поэтому в практических работах по стабилизации воды принято пользоваться величиной щелочности. Определение стабильности производят и с помощью показателя стабильности, равного отношению щелочности исходной воды к щелочности воды после насыщения карбоната кальция:
Вода стабильная, если CО = 1; если же ЩИСХ > ЩНАС, т.е. CО > 1, то вода нестабильна; если ЩИСХ < ЩНАС, т.е. CО < 1,то вода коррозионна или агрессивна. Методика определения СО сводится к следующему: в пробе воды определяют общую щелочность ЩИСХ, а затем в полулитровую колбу отмеряют 400 мл исследуемой воды и добавляют туда 10 г порошкообразного химически чистого карбоната кальция. Колбу закрывают резиновой пробкой и помещают в аппарат для встряхивания. Пробу встряхивают 0,5–1,0 час. Затем осторожно отбирают 100 мл раствора и снова определяют общую щелочность ЩНАС, По этим показателям устанавливают СО – показатель стабильности. При карбонатной жесткости природной воды по кальцию свыше 3–6 мг/л могут появляться отложения, ухудшающие производственные процессы: паротурбины расходуют больше пара и топлива, сокращается срок службы кладки и деталей металлургических печей и т.п. Для стабилизационной обработки охлаждающей воды применяют различные методы: подкисление, фосфатирование, рекарбонизацию и др. При подкислении щелочность воды понижается и выделяется свободная углекислота
Для стабилизации воды используют серную или соляную кислоты. При подкислении соли карбонатной жесткости переходят в соли некарбонатной жесткости, которые не распадаются при нагреве. Переход солей жесткости происходит по уравнениям
Стабильность воды при подкислении обеспечивается соответствующей дозировкой. Необходимая доза кислоты для стабилизации определяется по формуле:
где Щ – щелочность исходной воды, мг-экв/л; e – эквивалентный вес кислоты; с – содержание СаО в технической серной кислоте %; 2,0 – остаточная щелочность, мг-экв/л. Порядок проведения лабораторной работы 1. Определить качественнее показатели исходной воды: — активную реакцию pH; — общую щелочность, мг-экв/л; — общую жесткость, мг-экв/л; — показатель стабильности CО Методика определения показателей приведена в лабораторной работе № 1. 2. Определить расчетную дозу кислоты для стабилизационной обработки воды по формуле (5.3). Для определения оптимальной дозы кислоты расчетное количество уточняется экспериментально, путем пробного подкисления. Для этого испытуемую воду разливают в пять полулитровых или литровых цилиндров и в каждый вводят определенное количество серной кислоты. В 1-й цилиндр добавляют количество кислоты, полученное по расчету, во 2-й количество кислоты с коэффициентом 1,05 от расчетной величины, в 3-й – с коэффициентом 1,1; в 4-й – количество кислоты с коэффициентом 0,95; в 5-й – с коэффициентом 0,9 от расчетной величины. Введенную кислоту перемешивают с водой и оставляют на 10 мин в состояния покоя. Затем определяют общую щелочность воды во всех цилиндрах. Оптимальной дозой будет та, которая дает значение щелочности воды, близкое к 2,5–3,0 мг-экв/л. Все данные сводят в табл. 5.1. Таблица 5.1
Примечание: Методика пересчета концентраций дана в Приложении. 3. Определить качественные показатели воды при оптимальной дозе кислоты: — активную реакцию pH; — общую щелочность, мг-экв/л; — общую жесткость, мг-экв/л; — показатель стабильности CО после подкисления и обосновать изменение отдельных показателей. 4. Составить отчет о проделанной работе, заполнив табл. 5.2. Таблица 5.2
4. Составить отчет о проделанной работе и выполнить задание к лабораторной работе по стабилизации воды: Расход охлаждающей воды на заводе составляет 2500 м3/сут. Вода в охлаждающих системах будет нагреваться до 40 ° С. Подкисление производят серной кислотой. Необходимо определить дозу серной кислоты при подкислении и годовой расход ее. Лабораторная работа №6
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 567; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.94.189 (0.01 с.) |

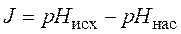 . (5.1)
. (5.1) .
. . (5.2)
. (5.2)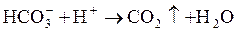 .
. .
. мг/л, (5.3)
мг/л, (5.3)


