
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коагулирование природных водСодержание книги
Поиск на нашем сайте
Основной задачей очистных сооружений городских водопроводов, пользующихся речными и озерными водами, является осветление и обесцвечивание воды, то есть удаление из нее коллоидных и взвешенных веществ. Находящиеся в воде коллоидные и взвешенные частицы имеют очень малые размеры (десятые и сотые доли микрона) и вес, поэтому осаждение, выпадение их в осадок происходит очень медленно (недели, месяцы, и даже годы). Это вызывает необходимость строительства громоздких, дорогих сооружений. Процесс этот можно ускорить, если заставить частицы соединиться друг с другом, укрупниться, агрегироваться, тогда под действием сил тяжести они быстрее выпадут в осадок, выделяться из воды. Процесс взаимного слипания частиц, их укрупнения, называется коагуляцией, а реагенты, используемые для этой цели, называется коагулянтами. При обработке природных вод наибольшее распространение из коагулянтов получили сернокислые и хлористые соли алюминия и железа. При введении в воду сернокислого алюминия сначала происходит диссоциация соли:
Трехвалентные катионы алюминия подвергаются затем гидролизу за счет гидроксильных ионов, находящихся в воде, образуя практически нерастворимую гидроокись алюминия:
Образующаяся гидроокись алюминия Al(OH)3 имеет весьма развитую поверхность и обладает адсорбционными свойствами, поэтому находящиеся в воде примеси сорбируются гидроокисью алюминия, в результате чего вода осветляется и обесцвечивается. В процессе коагуляции хлопья гидроокиси с прилипшими к ним примесями постепенно укрупняются, что облегчает их последующее выделение из воды. Выделяющиеся при гидролизе ионы водорода вступают в реакцию с присутствующими в воде гидрокарбонатными ионами:
Если карбонатов, содержащихся в воде, не хватает для полного гидролиза коагулянта, то для повышения щелочности воды производят ее подщелачивание. Дозу извести для подщелачивания определяют по формуле:
где ДИЗ – доза извести, мг/л; ДК – доза коагулянта; е – эквивалентный вес коагулянта; Щ – щелочность в исходной воде, мг-экв/л. Если значение ДИЗ получается отрицательным, то подщелачивание не производят. Эффект подщелачивания объясняется связыванием ионов водорода (H+) гидроксильными ионами (OH–). Таким образом, суммарная реакция гидролиза сульфата алюминия в присутствии находящегося в природных водах бикарбоната кальция выражается уравнением:
Наиболее эффективная коагуляция протекает при полном переходе Al2(SO4)3 в нерастворимый в воде гидроксид алюминия. Это условие обеспечивается при полном гидролизе коагулянта, происходящем при значениях рН воды в пределах 6,5–7,5. Избыточные или недостаточные количества введенного коагулянта уменьшают или повышают рН среды и ухудшают эффективность процесса коагуляции. Поэтому при коагулировании воды сернокислым алюминием необходимо выбирать и поддерживать такую дозу коагулянта, которая обеспечила бы эффективную очистку. При предварительных расчетах для обработки воды дозу сернокислого алюминия определяют по формуле:
где ДК – доза коагулянта, мг/л; Ц – цветность воды, град. или по формуле
где М – мутность воды, мг/л. Наибольшая величина ДК из 2х предыдущих формул и является расчетной. Оптимальную дозу коагулянта и щелочи определяют путем пробного коагулирования в лабораторных условиях.
Порядок выполнения лабораторной работы Для выполнения работы выдается проба исследуемой воды. 1. Определить качественные показатели исходной воды: — прозрачность по шрифту, см; — цветность, град; — активную реакцию рН; — общую щелочность, мг-экв/л; — общую жесткость, мг-экв/л. 2. Провести пробное коагулирование данной воды сернокислым аммонием, определить оптимальную дозу коагулянта. Пробное коагулирование проводят в нескольких цилиндрах путем введения в них дозы коагулянта, близкой к расчетной, определенной по формулам (2.2); (2.3). В 5–10 мерных цилиндров наливают исследуемую воду. В первый цилиндр вводят расчетную дозу, во второй на 25 мг/л больше расчетной, в третий – 25 мг/л больше второго и т.д. После введения раствора коагулянта, воду в цилиндре тщательно перемешивают мешалкой 10–15 раз и оставляют в покое на 20–30 мин. Каждые 5 мин фиксируют изменение состояния обрабатываемой воды (помутнение, опалесценция, образование микро хлопьев, агрегация хлопьев, начало осаждения и т.д.) Результаты вводятся в табл. 2.1. Таблица 2.1
Наименьшая доза коагулянта, при которой получены наибольшие хлопья через 15 минут и наилучшее осаждение хлопьев через 30 минут считается оптимальной. Эту дозу уточняют количественным контролем. Для этого после 30-минутного отстаивания воду из цилиндра, где наблюдается наилучшее осаждение хлопьев, фильтруют и в фильтре определяют показатели качества обработанной воды. 3. Определить качественные показатели воды, полученной после коагулирования при оптимальной дозе сернокислого алюминия: — прозрачность по шрифту, см; — цветность, град; — активную реакцию рН; — общую щелочность, мг-экв/л; — общую жесткость, мг-экв/л. Объяснить изменение отдельных показателей обработанной воды и заполнить табл. 2.2. Таблица 2.2
Лабораторная работа № 3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 600; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.174.45 (0.007 с.) |

 .
.
 .
.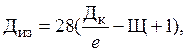 мг/л, (2.1)
мг/л, (2.1) .
. мг/л, (2.2)
мг/л, (2.2)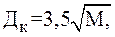 мг/л, (2.3)
мг/л, (2.3)


