
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обеззараживание воды ионами серебра и методом хлорированияСодержание книги
Поиск на нашем сайте Обеззараживание воды ионами серебра Одним из надежных методов обеззараживания воды является обработка ионами тяжелых металлов, в частности ионами серебра. Бактерицидные свойства серебра объясняются способностью его ионов и ионогенных соединений разрушать плазму микроорганизмов. Степень активности серебра зависит от концентрации ионов в растворе. В природных водах, со держащих различные ионы и органические вещества в коллоидном состоянии и имеющих различные значения рН, бактерицидный эффект ионов серебра может значительно изменяться. Это объясняется образованием комплексов и малорастворимых соединений, адсорбцией ионов серебра коллоидными частицами,изменением условий адсорбируемости серебра, а также другими процессами, снижающими концентрацию ионов в растворе или ухудшающими условия контакта. Оптимальными количествами серебра для большинства прозрачных вод, не содержащих большого количества примесей солей (в пределах 5–25 мг/л) являются дозы от 0,05 до 0,2 мг/л. Целью настоящей работы является определение эффективности обеззараживания воды ионами серебра. Ход определения. Для более точного количественного учета бактерий, воду загрязненного водоема следует разбавлять (разводить). Разведение производят следующим образом. В две или три пробирки наливают по 9 мл стерильной дистиллированной воды пипеткой на 10 мл и пробирки нумеруют. Отбирают 1 мл исследуемой воды и вносят в пробирку №1 (разведение получилось 1:10). После перемешивания из пробирки №1 отбирают 1 мл и вносят в пробирку №2 (разведение будет 1:100) и так далее. Степень разведения следует подбирать в каждом случае в зависимости от бактериальной загрязненности водоема. Последнее разведение делают в двух параллелях. Выделение микроорганизмов и их учет производится путем высева на плотные питательные среды. Для этого навеску среды разводят в 150 мл дистиллированной воды в колбе на 250 мл, размешивают и доводят до кипения, непрерывно помешивая стеклянной палочкой. Далее дают среде остыть до 45–48°С, прикрыв горлышко колбы бумажным фильтром. Затем среду разливают по чашкам Петри (делают по две, три параллели и разливают примерно по 15–20 мл среды на одну чашку). Прикрывают чашки со средой на три четверти и оставляют до полного остывания и затвердения. Из одной пробирки последнего разведения отбирают аликвоту 1 мл пипеткой на 1 мл и выливают на поверхность питательной среды в чашке Петри, разравнивают по поверхности осторожными круговыми движениями, используя стерильную изогнутую палочку. Палочку стерилизуют перед каждым употреблением, окуная ее в стаканчик со спиртом и обжигая в пламени горелки. Чашки закрывают и маркируют. Следует дать воде впитаться в питательную среду, после чего чашку переворачивают вверх дном, чтобы избежать конденсации паров воды на крышке. Грязную воду во второй пробирке последнего разведения обеззараживают солями серебра, в частности AgNO3. Для этого из бюретки в пробирку наливают отмеренное расчетное количество 0,01 н раствора AgNO3 и перемешивают. Доза азотнокислого серебра задается руководителем. Через 20 минут отбирают из 0,1 мл обеззараженной воды, и делают посев на твердую питательную среду. Подписывают чашки и помещают вместе с первыми чашками в сушильный шкаф, где они хранятся при температуре 37–40 ºС в течение 24 часов. Через сутки чашки вынимают из шкафа и производят подсчет всех выросших колоний, т. е. устанавливают микробное число и определяют эффект обеззараживания:
где N – общее число микроорганизмов в 1 мл, экз/мл; n – среднее число выросших колоний на поверхности среды чашки Петри; m – разведение образца; а – аликвота, взятая для посева данного образца. Результаты сводят в табл. 6.1. Таблица 6.1
Хлорирование воды Современные требования к качеству воды хозяйственно-питьевого назначения предусматривают уничтожение болезнетворных бактерий, находящихся в природных водах. Бытовые сточные воды перед выпуском их в водоем, также подвергаются обеззараживанию. Из всех методов обеззараживания наиболее распространенным является обработка воды газообразным хлором и его производными – гипохлоритом, двуокисью хлора и др. Хлорирование обеспечивает надежное обеззараживание. Перед хлорированием воду подвергают коагулированию и освобождают от взвешенных и коллоидных частиц в отстойниках и на фильтрах. Сущность обеззараживающего действия хлора заключается в окислении веществ, входящих в состав протоплазмы клеток бактерий, в результате чего последние гибнут. Наиболее чувствительны к хлору бациллы брюшного тифа, дизентерии и холерные вибрионы. На разрушение бактериальных клеток расходуется малая доза хлора, большая часть его вступает в реакцию с разнообразными органическими и минеральными примесями. Количество хлора, расходуемое на уничтожение бактерий и окисление различных примесей, составляет хлоропоглощаемость воды (мг/л). Для получения бактерицидного эффекта необходимо правильно подобрать дозу хлора и обеспечить его контакт с водой в течение 30 мин. Взаимодействий воды с хлором (гидролиз хлора) протекает по уравнению:
Полученная хлорноватистая кислота HClO может диссоциировать либо с образованием гипохлоритного иона
либо с образованием атомарного кислорода
обладающих сильными окислительными свойствами. На практике при определении необходимой дозы хлора для обеззараживания исходят из хлоропотребности воды, включающей хлоропоглощаемость ее и некоторый избыток хлора, обеспечивающий в течений заданного отрезка времени бактерицидный эффект. Для сохранения бактерицидных свойств во время транспортировки воды потребителю концентрация остаточного хлора в воде после 30-минутного контакта должна быть не менее 0,3–0,5 мг/л. Для выполнения работы студенту выдается проба исходной воды. Определение оптимальной дозы хлора при обеззараживании воды Для характеристики поведения воды при нормальном хлорировании необходимо установить зависимость остаточного хлора от дозы введенного при контакте хлора с водой в течение 30 мин. Для этого в четыре–пять плоскодонных колб наливают 100 мл исследуемой воды и с интервалами 5–8 мин приливают в них мерной пипеткой хлорную воду с концентрацией активного хлора 0,1 мг в 1 мл. Доза хлора устанавливается руководителем от 1 до 3 мг/л. Соответственно в каждую колбу вводится 1; 1,5; 1,75; 2,0; 2,5 мг/л или другие возможные вариации. Колбы взбалтывают и закрывают пробками. Так как время контакта хлора с водой во всех колбах должно быть равным 30 мин, то через 6–10 мин после приливания раствора хлорной воды в последнюю колбу приступают к определению остаточного хлора в первой колбе. В каждой колбе остаточный хлор определяют через 5 мин. Определение остаточного хлора в воде производится следующим образом: в 100 мл исследуемой воды добавляют 5 мл 10%-ного раствора йодистого калия (KJ), 5 мл буферной смеси с рН 4,6 (смесь равных объемов нормальных растворов уксусной кислоты и уксусного натрия) и 1 мл 1%-ного раствора крахмала. При наличии активного хлора в воде происходит посинение раствора, так как хлор вытесняет из йодистого калия йод:
или в ионном виде
Выделившийся йод окрашивает крахмал в синий цвет. К посиневшему раствору прибавляют по каплям из бюретки 0,001 н-раствор тиосульфата натрия (гипосульфита) до обесцвечивания раствора. Реакция протекает то уравнению
или в ионном виде
Обесцвечивание раствора наступает в тот момент, когда весь йод связывается тиосульфатом натрия; йодистый натрий и тетратиосульфат натрия, образующийся в результате реакции, окрашивания с крахмалом не дает. Содержание активного хлора вычисляют по формуле:
где V 1 – количество раствора тиосульфата натрия, затраченного на титрование исследуемой пробы,мл; N – нормальность раствора тиосульфата натрия; V 2 – объем исследуемой воды, взятой для титрования, мл. Все результаты опыта сводят в табл. 6.2. По этим данным составляют график "Доза хлора – остаточный хлор". По нему определяют дозу введенного хлора, котораяобеспечивает 0,5 мг/л остаточного хлора. Таблица 6.2
По полученным данным определяют показатель хлорируемости по формуле:
Приложение Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном количестве раствора. Наиболее используемы три вида концентрации:процентная,полярная, нормальная. Процентная концентрация показывает сколько весовыхчастей растворенного вещества содержится в 100 весовых частяхраствора. Например, 1%-ный раствор Al2(SO4)3. Это означает, что 100 г раствора серного алюминия содержит 1 г соли Al2(SO4)3. Поэтому в 1000 см3 (г) раствора содержится 10 г соли: 1000 см3 – 10000 мг 1 см3 – Х Х=(10000 мг · 1 см3) / 1000 см3 = 10 мг 1 мл раствора содержит 10 мг. Нормальными (н) называются растворы, содержащие водномлитре один г-экв растворенного вещества. Эквивалентом называется вещество, которое может присоединять или замещать 1 весовую часть водорода или 8 весовых частей кислорода: Эквивалент кислоты = (Молекулярный вес кислоты) / (Основность); Эквивалент основания = (Молекулярный вес основания) / (Число гидроксильных групп); Эквивалент соли = (Молекулярный вес соли) / (Число атомов металла · Валентность металла). Если раствор содержит 0,5 г-экв в 1 л, тоон называется полунормальным; если 0,1 г-экв – то децинормальным; если 0,01 г-экв – то сантинормальным и т.д. Если концентрация раствора H2SO4 децинормальная (0,1 н), то в 1 мл раствора H2SO4 содержится 49/10 = 4,9 мг кислоты. БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Васильев, В.П. Аналитическая химия: учебник / В.П. Васильев. – М: Высш. шк., 1989. – ч. 1. – 320 с. 2. Золотов, Ю.А. Основы аналитической химии: учебник / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева. – М: Высш. шк., 1999. – Ч. 1. – 352 с. 3 Крешков, А.П. Курс аналитической химии: учебник / А.П. Крешков, А.А. 4. Булатов, М.И. Практическое руководство по фотометрическим методам анализа: учебное пособие / М.И. Булатов, И.П. Калинкин.– Л: Химия, 1986. – 325 с. 5. СанПиН 2.1.4.1074 – 01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества.
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 587; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.57 (0.011 с.) |

 , (6.1)
, (6.1) .
.

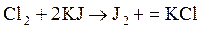 ,
, .
.
 .
. мг/л, (6.2)
мг/л, (6.2) . (6.3)
. (6.3)


