
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение химических показателей водыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте 1. Активная реакция воды (рН) Активная реакция воды, то есть степень ее кислотности или щелочности, характеризуется количественно концентрацией водородных ионов. Отрицательный логарифм концентрации водородных ионов принято обозначать рН. Для химической чистой воды при температуре 22 ° С рН 7 – нейтральная реакция, при рН < 7 – кислая, при рН > 7 – щелочная. Для определения рН могут быть использованы два метода: колориметрический и электролитический. Колориметрическое определение используют для бесцветных вод. Этот метод основан на свойствах индикаторов менять свою окраску в зависимости от концентрации водородных ионов. а) определение рН универсальным индикатором Для определения рН используют индикаторную бумагу, которая представляет собой обычную фильтровальную бумагу, пропитанную раствором того или иного универсального индикатора. К каждой пачке индикаторной бумаги обычно прилагается цветная шкала, показывающая окраску бумаги при различных pH. б) электролитический метод определения pH Этот метод основан на применении электродов, потенциал которых зависит от концентрации ионов водорода в исследуемом растворе. Определение потенциала электрода производят, измеряя электродвижущую силу концентрационной цепи, состоящей из стандартного электрода с постоянным потенциалом и исследуемого с неизвестным потенциалом, зависящим от концентрации водородных ионов в исследуемом растворе. При изменении pH электролитическим методом применяются pH-метры. Для определения pH раствора на приборерН-340 необходимо включить прибор в сеть и прогреть в течение 30 мин. Убрать из-под электродов стаканчик с дистиллированной водой, высушить, промокая их чистой фильтровальной бумагой. После этого можно приступать к измерению pH исследуемого раствора. Для этого необходимо произвести следующие операции: 1. Погрузить электроды в стаканчик с раствором. 2. По нижней шкале pH-метра замерить приближенное значение pH раствора. Для нахождения точного (до сотых) значения pH нужно переключатель «Пределы измерений» поставить на тот диапазон, в который попадает приближенное значение. Если pH около 7, то поставить переключатель на диапазон 5-8, затем включить «размах» в среднее положение и снять с точностью до сотых показатель по верхней шкале: к значению «5» прибавить показания по верхней шкале. Снимать показания pH нужно только тогда, когда становиться стрелка на приборе (обычно стрелка устанавливается в течение 0,5–1 мин, а если раствор концентрированный – в течение 2 минут). Замерив и записав показания прибора, выключить тумблер «размах» и «Пределы измерения», убрать стаканчик с исследуемой водой, высушить фильтровальной бумагой электроды, как в начале опыта, погрузить их в стаканчик с дистиллированной водой. Общая щелочность воды Общая щелочность воды обусловлена суммой содержащихся в воде ионов HCO3–, CO32–, OH– и других солей слабых кислот, вступающих в реакцию с сильным. Щелочность, обусловленная присутствием сильных оснований (гидратов), называется гидратной. Щелочность, обусловленная присутствием ионов HCO3–, CO32–, называется бикарбонатной или карбонатной. Для природных вод характерна бикарбонатная щелочность. Щелочность выражается в мг-экв/л. Практически щелочность природных вод соответствует концентрации гидрокарбонатных ионов HCO3–, если в воде отсутствуют карбонаты CO32–. Определение общей щелочности основано на реакции образования нейтральных солей при титровании воды соляной кислотой. Ионы оттитровывают соляной кислотой в присутствии индикатора фенолфталеина, они обуславливают щелочность воды по фенолфталеину. При этом протекают следующие реакции:
Ион HCO3– оттитровывают соляной кислотой в присутствии индикатора метилоранжа. При этом происходит реакция
Если щелочность по фенолфталеину равна нулю, то общая щелочность обусловлена только HCO3– и равна карбонатной жесткости, так как в природных водах ионы HCO3– связаны только с ионами Са2+ и Mg2+. Ход определения. К 100 мл исследуемой воды, отмеренной цилиндром в коническую колбу, приливают 2–3 капли фенолфталеина. Если окраска не появилась, то в ту же колбу добавляют 2–3 капли метилоранжа и титруют 0,1 н – раствором соляной кислоты до перехода окраски из соломенно-желтой в оранжевую. Если же окраска по ф/ф появилась, то раствор надо оттитровать соляной кислотой 0,1 н до исчезновения окраски и затем уже ввести индикатор метилоранж. Суммарное количество кислоты, пошедшее на титрование и есть общая щелочность воды. Титрование нужно вести на белом фоне. Общую щелочность воды находят по формуле:
где V – количество кислоты, израсходованной на титрование 1000 мл воды, мл; N – нормальность раствора кислоты.
Общая жесткость воды Жесткостью воды называется суммарная концентрация в ней ионов кальция и магния, выраженная в мг-экв/л. Различают жесткость общую, карбонатную и некарбонатную. Карбонатной жесткостью называют часть общей жесткости, обусловленную содержанием в воде бикарбонатов кальция и магния. Некарбонатная жесткость обусловлена содержанием в воде, главным образом, сульфатов и хлоридов кальция и магния. Общая жесткость подразделяется на кальциевую и магниевую. Общая жесткость воды определяют комплексонометрическим методом. Метод основан на способности реактива (трилона Б) образовывать с ионами кальция и магния устойчивые комплексные соединения. Индикатор хромоген черный образует с ионами кальция и магния малодиссоциированный комплекс розово-малинового цвета, а в их отсутствие окрашен в голубой цвет с зеленоватым оттенком. Соединения кальция и магния с индикаторами более диссоциированы, чем комплексы их с трилонами Б, поэтому при добавлении трилона Б магний и кальций из комплексов с хромогеном переходят в соединении с трилоном. Окраска раствора становится голубой. Индикатор меняет свою окраску и от рН среды, поэтому в титруемый раствор добавляют буферную смесь из NH4Cl + NH4OH, поддерживающую постоянное значение рН ~ 10. Ход определения. В колбу на 250 мл наливают 100 мл воды, добавляют 5 мл аммиачного буферного раствора с рН 10 и 5–10 кристаллов сухого индикатора хромогена черного. Содержимое колбы тщательно перемешивают до появления розово-малинового цвета. Титрование проводят медленно 0,1 н раствором трилона Б при интенсивном перемешивании до появления сине-голубого окрашивания. Общая жесткость воды рассчитывается по формуле:
где V – количество раствора трилона Б, израсходованного на титрование, мл; N – нормальность раствора трилона Б. а) определение кальциевой жесткости В коническую колбу емкостью 250 мл вносят 100 мл исследуемой воды. Затем прибавляют 2 мл 2н раствора NaOH, на кончике ложечки вносят в колбу немного сухого индикатора мурексида и медленно титруют 0,1н раствором трилона Б при энергичном перемешивании до перехода окраски от красной до лиловой. Расчет содержания иона Ca2+ в воде производится по формуле:
где V – количество раствора трилона Б в мл, израсходованное на титрование; k – поправочный коэффициент к титру раствора трилона Б; N – нормальность раствора трилона Б; W – объем исследуемой воды в мл, взятой для анализа. б ) определение магниевой жесткости Магний [Mg2+] определяется методом расчета с использование результатов титрования при определении общей жесткости и кальциевой комплексонометрическим методом с трилоном Б. Содержание ионов магния Mg2+ в мг-л вычисляются по формуле:
где А – общая жесткость воды, мг-экв/л; В – кальциевая жесткость воды, мг-экв/л; е – эквивалент магния, мг/л.
Окисляемость воды Окисляемость воды обуславливается в основном присутствием в ней органических веществ, а также некоторых неорганических примесей (сероводорода, сульфита, закисного железа и др.), поглощающих кислород. Величина окисляемости выражается в мг/л кислорода, который расходуется на окисление веществ, содержащихся в одном литре воды. В практике окисляемость определяется перманганатным и бихроматным методом. Сущность перманганатного метода: Окисление органических веществ перманганатом калия в кислой среде протекает по уравнению:
После кипячения раствора в течение 10 мин, к нему прибавляется щавелевая кислота, восстанавливающая избыток перманганата калия. Избыток прибавленной щавелевой кислоты затем оттитровывают раствором перманганата калия. Ход определения. В коническую термостойкую плоскодонную колбу емкостью 200–250 мл наливают 20 мл исследуемой воды, добавляют 80 мл дистиллированной воды, 5 мл разбавленной серной кислоты (1:3) и из бюретки 10 мл 0,01н раствора перманганата. В колбу вставляют небольшую воронку и кипятят жидкость в течение 10 мин (от начала кипения). К горячей окрашенной жидкости добавляют из бюретки 10 мл 0,01н раствора щавелевой кислоты, перемешивают и обесцвеченный раствор (горячий) титруют 0,01н раствором перманганата до появления бледно-розового окрашивания. Окисляемость воды определяют по формуле:
где V 1 – количество раствора KMnO4, израсходованного на титрование, мл; Vg – объем KMnO4, необходимый для окисления дистиллированной воды (задается руководителем); N – нормальность раствора KMnO4; W – объем воды, взятой для анализа, мл.
Свободная углекислота Накопление свободной углекислоты в воде открытых водоемов указывает на неблагоприятные условия течения окислительных процессов, слабую аэрацию и недостаточный фотосинтез. Такая вода обладает высокой агрессивностью. Определение свободной углекислоты производится путем титрования её едким натром в присутствии фенолфталеина.
Ход определения. К 100 мл исследуемой воды прибавляют 3–5 капель фенолфталеина и титруют 0,02н – раствором NaOH. Конец реакции определяется получением раствора с устойчивой бледно-розовой окраской, соответствующей стандартному раствору. Количество растворенной углекислоты вычисляется по формуле:
где V 1 – объем раствора NaOH, идущий на титрование, мл; N – нормальность раствора; V – объем воды, взятой для титрования, мл.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 2255; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.007 с.) |


 .
.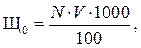 мг-экв/л, (1.1)
мг-экв/л, (1.1)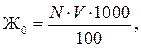 мг-экв/л, (1.2)
мг-экв/л, (1.2) (1.3)
(1.3)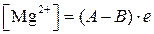 , мг/л, (1.4)
, мг/л, (1.4) .
. мг/л О2 , (1.5)
мг/л О2 , (1.5)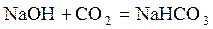 .
.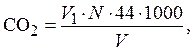 мг/л, (1.6)
мг/л, (1.6)


