
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
И.Ю. Апаликова, А.М. КострюковаСодержание книги
Поиск на нашем сайте
И.Ю. Апаликова, А.М. Кострюкова
ХИМИЯ ВОДЫ И МИКРОБИОЛОГИЯ
Учебное пособие для выполнения лабораторных работ
Челябинск Издательство ЮУрГУ
УДК 546.1(076.5) + 579(076.5) А76
Одобрено учебно-методической комиссией архитектурно-строительного факультета
Рецензенты: д.х.н., проф. Викторов В.В., д.б.н., проф. Дятлов Д.А.
Апаликова, И.Ю. А76 Химия воды и микробиология: учебное пособие для выполнения лабораторных работ / И.Ю. Апаликова, А.М. Кострюкова. – Челябинск: Изд-во ЮУрГУ, 2007. – 32 c.
Пособие предназначено для самостоятельной подготовки к выполнению лабораторных работ и оформлению отчетов по ним. В нём приведены методики выполнения анализа показателей воды, а также наиболее характерные методы очистки природных и сточных вод. Пособие ориентировано, прежде всего, на студентов, обучающихся по специальности 280201 – «Охрана окружающей среды и рациональное использование природных ресурсов» и 020802 – «Природопользование».
УДК 546.1(076.5) + 579(076.5)
© Издательство ЮУрГУ, 2007
И.Ю. Апаликова, А.М. Кострюкова
ХИМИЯ ВОДЫ И МИКРОБИОЛОГИЯ
Учебное пособие для выполнения лабораторных работ
Техн. редактор А.В. Миних
Издательство Южно-Уральского государственного университета
УОП Издательства. 454080, г. Челябинск, пр. им. В.И. Ленина, 76
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ Пособие является дополнением к лекционному материалу, предусмотренному программой по курсам «технология очистки природных и сточных вод», «химия воды и микробиология», «ландшафтоведение». Пособие ориентировано, прежде всего, на студентов, обучающихся по специальностям 280201 – «Охрана окружающей среды и рациональное использование природных ресурсов» и 020802 – «Природопользование». Также пособие может быть использовано студентами других специальностей, в учебной программе которых предусмотрен данный курс. Вопросы химии окружающей среды и экологического мониторинга, миграции и трансформации загрязняющих веществ в природных и антропогенных системах занимают одну из центральных позиций в образовательных стандартах профильных специальностей высшей школы, в программах многих практических семинаров и учебных курсов. Особенности развития аналитической химии с одной стороны и исключительная роль воды в жизни человека с другой определили то обстоятельство, что экологический мониторинг водных объектов получил приоритетное развитие в большинстве национальных и региональных систем наблюдений. Каждая работа состоит из теоретической и практической частей. В первой части рассмотрены теоретические предпосылки, необходимые для выполнения экспериментальных исследований, дающие объяснения сущности физико-химических процессов, происходящих в ходе работы. В практической части дается цель работы, необходимые реактивы и оборудование, описание и порядок проведения работы, требования к оформлению отчетов. Для проверки усвоения изложенного материала в конце каждой работы приведены задачи для самостоятельного решения и вопросы для контроля. Поэтому основные цели лабораторных работ – привить студентам навыки самостоятельной экспериментальной работы и помочь при самостоятельном изучении теоретического материала.
Лабораторная работа № 1
ОПРЕДЕЛЕНИЕ ОСНОВНЫХ ПОКАЗАТЕЛЕЙ КАЧЕСТВА ВОДЫ
Цель данной работы сводится к освоению навыков определения физических и химических показателей воды. Определение физических показателей воды: 1.Определение запаха Запах и вкус воды зависит от ряда причин: от газов, насыщающих воду, от химического состава примесей, наличия в ней органических веществ. По характеру запахи делятся на две группы: а) запахи естественного происхождения (от отмирающих и живущих в воде организмов, от влияния берегов, дна и т.д.); б) запахи искусственного происхождения (от промышленных сточных вод, обработки воды реагентами на станциях). Для определения запаха воду наливают в колбу емкостью 100 мл на 2/3 объема, накрывают часовым стеклом, встряхивают вращательным движением в закрытом состоянии, открывают и определяют запах. Если запах воды сразу не определяется, то воду подогревают до t +60 ˚С и затем повторяют определение. Интенсивность запаха характеризуют по пятибалльной системе, приведенной в табл. 1.1. Таблица 1.1
Определение цветности Цветность измеряют в градусах платиново-кобальтовой шкалы цветности путем сравнения исследуемой воды с эталоном. В эталонную колбу наливают примерно 500 мл и рассматривают сбоку на белом фоне на расстоянии двух метров, подбирая к цвету пробы цвет более подходящей колбы шкалы цветности.
Определение прозрачности Прозрачность воды зависит от количества и степени дисперсности находящейся в воде взвешенных веществ (глины, ила и органических взвесей). Прозрачность выражается в сантиметрах водяного столба, через который видны линии толщиной в 1 мм, образующие крест (определение по кресту или шрифт № 1 (по Снеллену). Определение прозрачности по «шрифту» проводит в специально градуированном стеклянном цилиндре (высота градуированной части больше 30 см) с припаянным внизу краном и плоским, хорошо прошлифованным дном. Воду наливают в цилиндр, подкладывают стандартный шрифт № 1 на расстоянии 4 см от дна и просматривают его сверху через слой воды, отливая или добавляя ее, и отмечая высоту столба, через который чтение шрифта еще невозможно. Высота воды в цилиндре, отсчитанная в сантиметрах, выражает степень прозрачности воды. Определение производят при хорошем освещении, но не на прямом солнечном свете. При незначительном содержании взвешенных веществ в воде (менее 2 мг/л) определяется ее мутность (мг/л). При наличии в воде большого количества взвешенных веществ их определяют весовым путем. Перевод прозрачности в мутность (мг/л) приведен в табл. 1.2. Таблица 1.2 Таблица перевода прозрачности в мутность
Общая щелочность воды Общая щелочность воды обусловлена суммой содержащихся в воде ионов HCO3–, CO32–, OH– и других солей слабых кислот, вступающих в реакцию с сильным. Щелочность, обусловленная присутствием сильных оснований (гидратов), называется гидратной. Щелочность, обусловленная присутствием ионов HCO3–, CO32–, называется бикарбонатной или карбонатной. Для природных вод характерна бикарбонатная щелочность. Щелочность выражается в мг-экв/л. Практически щелочность природных вод соответствует концентрации гидрокарбонатных ионов HCO3–, если в воде отсутствуют карбонаты CO32–. Определение общей щелочности основано на реакции образования нейтральных солей при титровании воды соляной кислотой. Ионы оттитровывают соляной кислотой в присутствии индикатора фенолфталеина, они обуславливают щелочность воды по фенолфталеину. При этом протекают следующие реакции:
Ион HCO3– оттитровывают соляной кислотой в присутствии индикатора метилоранжа. При этом происходит реакция
Если щелочность по фенолфталеину равна нулю, то общая щелочность обусловлена только HCO3– и равна карбонатной жесткости, так как в природных водах ионы HCO3– связаны только с ионами Са2+ и Mg2+. Ход определения. К 100 мл исследуемой воды, отмеренной цилиндром в коническую колбу, приливают 2–3 капли фенолфталеина. Если окраска не появилась, то в ту же колбу добавляют 2–3 капли метилоранжа и титруют 0,1 н – раствором соляной кислоты до перехода окраски из соломенно-желтой в оранжевую. Если же окраска по ф/ф появилась, то раствор надо оттитровать соляной кислотой 0,1 н до исчезновения окраски и затем уже ввести индикатор метилоранж. Суммарное количество кислоты, пошедшее на титрование и есть общая щелочность воды. Титрование нужно вести на белом фоне. Общую щелочность воды находят по формуле:
где V – количество кислоты, израсходованной на титрование 1000 мл воды, мл; N – нормальность раствора кислоты.
Общая жесткость воды Жесткостью воды называется суммарная концентрация в ней ионов кальция и магния, выраженная в мг-экв/л. Различают жесткость общую, карбонатную и некарбонатную. Карбонатной жесткостью называют часть общей жесткости, обусловленную содержанием в воде бикарбонатов кальция и магния. Некарбонатная жесткость обусловлена содержанием в воде, главным образом, сульфатов и хлоридов кальция и магния. Общая жесткость подразделяется на кальциевую и магниевую. Общая жесткость воды определяют комплексонометрическим методом. Метод основан на способности реактива (трилона Б) образовывать с ионами кальция и магния устойчивые комплексные соединения. Индикатор хромоген черный образует с ионами кальция и магния малодиссоциированный комплекс розово-малинового цвета, а в их отсутствие окрашен в голубой цвет с зеленоватым оттенком. Соединения кальция и магния с индикаторами более диссоциированы, чем комплексы их с трилонами Б, поэтому при добавлении трилона Б магний и кальций из комплексов с хромогеном переходят в соединении с трилоном. Окраска раствора становится голубой. Индикатор меняет свою окраску и от рН среды, поэтому в титруемый раствор добавляют буферную смесь из NH4Cl + NH4OH, поддерживающую постоянное значение рН ~ 10. Ход определения. В колбу на 250 мл наливают 100 мл воды, добавляют 5 мл аммиачного буферного раствора с рН 10 и 5–10 кристаллов сухого индикатора хромогена черного. Содержимое колбы тщательно перемешивают до появления розово-малинового цвета. Титрование проводят медленно 0,1 н раствором трилона Б при интенсивном перемешивании до появления сине-голубого окрашивания. Общая жесткость воды рассчитывается по формуле:
где V – количество раствора трилона Б, израсходованного на титрование, мл; N – нормальность раствора трилона Б. а) определение кальциевой жесткости В коническую колбу емкостью 250 мл вносят 100 мл исследуемой воды. Затем прибавляют 2 мл 2н раствора NaOH, на кончике ложечки вносят в колбу немного сухого индикатора мурексида и медленно титруют 0,1н раствором трилона Б при энергичном перемешивании до перехода окраски от красной до лиловой. Расчет содержания иона Ca2+ в воде производится по формуле:
где V – количество раствора трилона Б в мл, израсходованное на титрование; k – поправочный коэффициент к титру раствора трилона Б; N – нормальность раствора трилона Б; W – объем исследуемой воды в мл, взятой для анализа. б ) определение магниевой жесткости Магний [Mg2+] определяется методом расчета с использование результатов титрования при определении общей жесткости и кальциевой комплексонометрическим методом с трилоном Б. Содержание ионов магния Mg2+ в мг-л вычисляются по формуле:
где А – общая жесткость воды, мг-экв/л; В – кальциевая жесткость воды, мг-экв/л; е – эквивалент магния, мг/л.
Окисляемость воды Окисляемость воды обуславливается в основном присутствием в ней органических веществ, а также некоторых неорганических примесей (сероводорода, сульфита, закисного железа и др.), поглощающих кислород. Величина окисляемости выражается в мг/л кислорода, который расходуется на окисление веществ, содержащихся в одном литре воды. В практике окисляемость определяется перманганатным и бихроматным методом. Сущность перманганатного метода: Окисление органических веществ перманганатом калия в кислой среде протекает по уравнению:
После кипячения раствора в течение 10 мин, к нему прибавляется щавелевая кислота, восстанавливающая избыток перманганата калия. Избыток прибавленной щавелевой кислоты затем оттитровывают раствором перманганата калия. Ход определения. В коническую термостойкую плоскодонную колбу емкостью 200–250 мл наливают 20 мл исследуемой воды, добавляют 80 мл дистиллированной воды, 5 мл разбавленной серной кислоты (1:3) и из бюретки 10 мл 0,01н раствора перманганата. В колбу вставляют небольшую воронку и кипятят жидкость в течение 10 мин (от начала кипения). К горячей окрашенной жидкости добавляют из бюретки 10 мл 0,01н раствора щавелевой кислоты, перемешивают и обесцвеченный раствор (горячий) титруют 0,01н раствором перманганата до появления бледно-розового окрашивания. Окисляемость воды определяют по формуле:
где V 1 – количество раствора KMnO4, израсходованного на титрование, мл; Vg – объем KMnO4, необходимый для окисления дистиллированной воды (задается руководителем); N – нормальность раствора KMnO4; W – объем воды, взятой для анализа, мл.
Свободная углекислота Накопление свободной углекислоты в воде открытых водоемов указывает на неблагоприятные условия течения окислительных процессов, слабую аэрацию и недостаточный фотосинтез. Такая вода обладает высокой агрессивностью. Определение свободной углекислоты производится путем титрования её едким натром в присутствии фенолфталеина.
Ход определения. К 100 мл исследуемой воды прибавляют 3–5 капель фенолфталеина и титруют 0,02н – раствором NaOH. Конец реакции определяется получением раствора с устойчивой бледно-розовой окраской, соответствующей стандартному раствору. Количество растворенной углекислоты вычисляется по формуле:
где V 1 – объем раствора NaOH, идущий на титрование, мл; N – нормальность раствора; V – объем воды, взятой для титрования, мл.
Лабораторная работа № 2 Лабораторная работа № 3 Лабораторная работа № 4
Лабораторная работа №5 Лабораторная работа №6 Хлорирование воды Современные требования к качеству воды хозяйственно-питьевого назначения предусматривают уничтожение болезнетворных бактерий, находящихся в природных водах. Бытовые сточные воды перед выпуском их в водоем, также подвергаются обеззараживанию. Из всех методов обеззараживания наиболее распространенным является обработка воды газообразным хлором и его производными – гипохлоритом, двуокисью хлора и др. Хлорирование обеспечивает надежное обеззараживание. Перед хлорированием воду подвергают коагулированию и освобождают от взвешенных и коллоидных частиц в отстойниках и на фильтрах. Сущность обеззараживающего действия хлора заключается в окислении веществ, входящих в состав протоплазмы клеток бактерий, в результате чего последние гибнут. Наиболее чувствительны к хлору бациллы брюшного тифа, дизентерии и холерные вибрионы. На разрушение бактериальных клеток расходуется малая доза хлора, большая часть его вступает в реакцию с разнообразными органическими и минеральными примесями. Количество хлора, расходуемое на уничтожение бактерий и окисление различных примесей, составляет хлоропоглощаемость воды (мг/л). Для получения бактерицидного эффекта необходимо правильно подобрать дозу хлора и обеспечить его контакт с водой в течение 30 мин. Взаимодействий воды с хлором (гидролиз хлора) протекает по уравнению:
Полученная хлорноватистая кислота HClO может диссоциировать либо с образованием гипохлоритного иона
либо с образованием атомарного кислорода
обладающих сильными окислительными свойствами. На практике при определении необходимой дозы хлора для обеззараживания исходят из хлоропотребности воды, включающей хлоропоглощаемость ее и некоторый избыток хлора, обеспечивающий в течений заданного отрезка времени бактерицидный эффект. Для сохранения бактерицидных свойств во время транспортировки воды потребителю концентрация остаточного хлора в воде после 30-минутного контакта должна быть не менее 0,3–0,5 мг/л. Для выполнения работы студенту выдается проба исходной воды. Определение оптимальной дозы хлора при обеззараживании воды Для характеристики поведения воды при нормальном хлорировании необходимо установить зависимость остаточного хлора от дозы введенного при контакте хлора с водой в течение 30 мин. Для этого в четыре–пять плоскодонных колб наливают 100 мл исследуемой воды и с интервалами 5–8 мин приливают в них мерной пипеткой хлорную воду с концентрацией активного хлора 0,1 мг в 1 мл. Доза хлора устанавливается руководителем от 1 до 3 мг/л. Соответственно в каждую колбу вводится 1; 1,5; 1,75; 2,0; 2,5 мг/л или другие возможные вариации. Колбы взбалтывают и закрывают пробками. Так как время контакта хлора с водой во всех колбах должно быть равным 30 мин, то через 6–10 мин после приливания раствора хлорной воды в последнюю колбу приступают к определению остаточного хлора в первой колбе. В каждой колбе остаточный хлор определяют через 5 мин. Определение остаточного хлора в воде производится следующим образом: в 100 мл исследуемой воды добавляют 5 мл 10%-ного раствора йодистого калия (KJ), 5 мл буферной смеси с рН 4,6 (смесь равных объемов нормальных растворов уксусной кислоты и уксусного натрия) и 1 мл 1%-ного раствора крахмала. При наличии активного хлора в воде происходит посинение раствора, так как хлор вытесняет из йодистого калия йод:
или в ионном виде
Выделившийся йод окрашивает крахмал в синий цвет. К посиневшему раствору прибавляют по каплям из бюретки 0,001 н-раствор тиосульфата натрия (гипосульфита) до обесцвечивания раствора. Реакция протекает то уравнению
или в ионном виде
Обесцвечивание раствора наступает в тот момент, когда весь йод связывается тиосульфатом натрия; йодистый натрий и тетратиосульфат натрия, образующийся в результате реакции, окрашивания с крахмалом не дает. Содержание активного хлора вычисляют по формуле:
где V 1 – количество раствора тиосульфата натрия, затраченного на титрование исследуемой пробы,мл; N – нормальность раствора тиосульфата натрия; V 2 – объем исследуемой воды, взятой для титрования, мл. Все результаты опыта сводят в табл. 6.2. По этим данным составляют график "Доза хлора – остаточный хлор". По нему определяют дозу введенного хлора, котораяобеспечивает 0,5 мг/л остаточного хлора. Таблица 6.2
По полученным данным определяют показатель хлорируемости по формуле:
Приложение Концентрацией раствора называется количество растворенного вещества, содержащегося в определенном количестве раствора. Наиболее используемы три вида концентрации:процентная,полярная, нормальная. Процентная концентрация показывает сколько весовыхчастей растворенного вещества содержится в 100 весовых частяхраствора. Например, 1%-ный раствор Al2(SO4)3. Это означает, что 100 г раствора серного алюминия содержит 1 г соли Al2(SO4)3. Поэтому в 1000 см3 (г) раствора содержится 10 г соли: 1000 см3 – 10000 мг 1 см3 – Х Х=(10000 мг · 1 см3) / 1000 см3 = 10 мг 1 мл раствора содержит 10 мг. Нормальными (н) называются растворы, содержащие водномлитре один г-экв растворенного вещества. Эквивалентом называется вещество, которое может присоединять или замещать 1 весовую часть водорода или 8 весовых частей кислорода: Эквивалент кислоты = (Молекулярный вес кислоты) / (Основность); Эквивалент основания = (Молекулярный вес основания) / (Число гидроксильных групп); Эквивалент соли = (Молекулярный вес соли) / (Число атомов металла · Валентность металла). Если раствор содержит 0,5 г-экв в 1 л, тоон называется полунормальным; если 0,1 г-экв – то децинормальным; если 0,01 г-экв – то сантинормальным и т.д. Если концентрация раствора H2SO4 децинормальная (0,1 н), то в 1 мл раствора H2SO4 содержится 49/10 = 4,9 мг кислоты. БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Васильев, В.П. Аналитическая химия: учебник / В.П. Васильев. – М: Высш. шк., 1989. – ч. 1. – 320 с. 2. Золотов, Ю.А. Основы аналитической химии: учебник / Ю.А. Золотов, Е.Н. Дорохова, В.И. Фадеева. – М: Высш. шк., 1999. – Ч. 1. – 352 с. 3 Крешков, А.П. Курс аналитической химии: учебник / А.П. Крешков, А.А. 4. Булатов, М.И. Практическое руководство по фотометрическим методам анализа: учебное пособие / М.И. Булатов, И.П. Калинкин.– Л: Химия, 1986. – 325 с. 5. СанПиН 2.1.4.1074 – 01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества.
И.Ю. Апаликова, А.М. Кострюкова
ХИМИЯ ВОДЫ И МИКРОБИОЛОГИЯ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 383; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.91.116 (0.01 с.) |


 .
.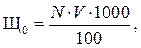 мг-экв/л, (1.1)
мг-экв/л, (1.1)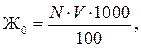 мг-экв/л, (1.2)
мг-экв/л, (1.2) (1.3)
(1.3)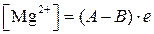 , мг/л, (1.4)
, мг/л, (1.4) .
. мг/л О2 , (1.5)
мг/л О2 , (1.5)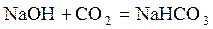 .
.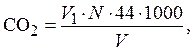 мг/л, (1.6)
мг/л, (1.6) .
.

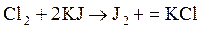 ,
, .
.
 .
. мг/л, (6.2)
мг/л, (6.2) . (6.3)
. (6.3)


