
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нейтрализация и обезжелезивание кислых производственных сточных водСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте На предприятиях черной металлургии, на машиностроительных и металлообрабатывающих заводах широко используется химическая обработка металлов кислотами в процессе травления. В результате образуются кислые железосодержащие стоки, имеющие свободные кислоты, (преимущественно серную, иногда смесь кислот) и соли железа (в основном FeSO4). Сброс таких стоков в водоемы без очистки вызывает обескислороживание воды. Соли железа в результате гидролиза и окисления образуют осадки ржаво-рыжего цвета. При большом загрязнении в водоемах полностью исчезает органическая жизнь, вода становится непригодной для водоснабжения, В настоящее время железосодержащие кислые стоки очищают либо для повторного использования в производстве, либо для последующего сброса в водоемы. Наиболее распространенным способом очистки таких сточных вод является известкование. При поступлении раствора известкового молока в стоки происходит нейтрализация свободных кислот. В частности, для серной кислоты, по уравнению
Присутствующее в стоках сернокислое железо диссоциирует
а ионы железа подвергаются гидролизу
Чтобы обеспечить полный гидролиз и выделение всего Fe(OH)2 необходимо повысить pH нейтрализуемых стоков до 8,5–9,0. При более низких значениях pH часть солей железа не подвергается гидролизу и остается в растворенном состоянии. Коагуляция Fe(OH)2 достигается повышением pH сточных вод до 3,5–9,0 путем добавления известкового молока. Образующиеся хлопья гидрата закиси железа Fe(OH)2 выпадают в осадок. При достаточно длительном контакте сточных вод с кислородом воздуха гидрат закиси Fe(QH)2 переходит в гидрат окиси Fe(OH)3.
Приближенный расчет дозы извести для нейтрализации железосодержащих кислых стоков производится по формуле:
где А – коэффициент запаса расхода извести по сравнению с теоретическим. Этот коэффициент должен обеспечить такой, избыток извести, чтобы pH при нейтрализации было в пределах 8,5–9,0 (обычно А =1,2…1,4); С – содержание СaO в продажной извести. Эту дозу уточняют в процессе эксплуатации, руководствуясь данными контрольных анализов; коэффициенты (0,57) и (0,37) определяют количество весовых частей извести, необходимых нейтрализации одной весовой части. Н2SО4 и FeSО4 соответственно (по стехеометрическому расчету); H2SO4 – количество серной кислоты и FeSO4 – железного купороса в пересчете по анализу стоков. Оптимальную дозу извести для нейтрализации и обезжелезивания производственных сточных вод находят экспериментальным путем. Для выполнения работы студенту выдается исходная проба сточных вод.
Порядок проведения лабораторной работы 1. Определить качественные показатели исходных стоков: — активную реакцию pH; — содержание железа, мг/л; — общую кислотность, мг - экв /л, Методика определения показателей приведена в лабораторной работе № 1. 2. Провести пробное известкование данной сточной воды введением раствора известкового молока, определить, его оптимальную дозу и эффект обезжелезивания и нейтрализации. Пробную нейтрализацию проводят в пяти цилиндрах введением расчетной дозы извести, определяемой по формуле (3.1). Для уточнения расчетной дозы берутся поправочные коэффициенты от 0,8 до 1,2. В каждый цилиндр с водой добавляют известковое молоко в соответствии с указанными коэффициентами. Например, в 1-й цилиндр ДИ=0,8·ДИР; во 2-й ДИ=0,9·ДИР; в 3-й ДИ=1,0·ДИР и т.д. Воду в цилиндрах перемешивают специальной мешалкой и оставляют в спокойном состоянии на 30 мин. Через 30 мин замечают цилиндр, в котором происходит наилучшее выпадение хлопьев. Каждые 10 мин фиксируют изменение состояния обрабатываемой воды (хлопьеобразование, уровень осаждающейся взвеси, состояние осветленного слоя воды и высоту уплотнения осадка). Все данные сводят в табл. 3.1. Наименьшая доза реагента, при которой произошло наилучшее выпадение осадков и их уплотнение при pH 9, считается оптимальной. Таблица 3.1
Примечание: Пример перерасчета дозы реагента на соответствующий объем данной концентрации приведен в Приложении. 3. Определить качественные показатели сточной воды при оптимальной дозе реагента путем фильтрования осветленного слоя вод через бумажный фильтр: — активную реакцию pH; — общую щелочность, мг-экв /л; — общую жесткость, мг-экв/л; — содержание железа, мг/л; Обосновать изменение отдельных показателей качества сточной воды. 4. Составить отчет о работе, заполнив табл.3.2 и начертить график уплотнения осадка во времени во всех пяти цилиндрах Таблица 3.2
5. Выполнить задание к лабораторной работе по нейтрализации и обезжелезиванию кислых стоков. На заводе ежечасно образуется 500 м3 отработанных кислых стоков. Их загрязняют серная кислота и сульфат железа. После нейтрализации и обезжелезивания этих стоков воду разрешается спускать в реку. Необходимо определить: 1. Оптимальную дозу извести для обработки данной сточной воды, мг/л; 2. Эффект очистки сточной воды при данной дозе, %; 3. Суточный расход технической извести, т; 4. Суточный расход 5%-ного раствора известкового молока, м3/сут.
Лабораторная работа № 4
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 730; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |

 .
.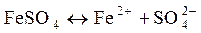 ,
,
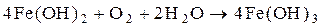 .
. мг/л, (3.1)
мг/л, (3.1)


