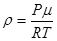Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Статистическая физика и термодинамикаСодержание книги
Поиск на нашем сайте Элементы молекулярно-кинетической теории Молекулярно-кинетическая теория изучает физические свойства тел, исходя из представления об их молекулярном строении. Она пользуется статистическим методом, изучая не движение отдельных молекул, а те средние величины (скорость, давление, температура, энергия и т.д), которые характеризуют это движение, и макроскопические процессы, с которыми они связаны. Термодинамика рассматривает наиболее общие свойства макроскопических тел, находящихся в состоянии термодинамического равновесия, и процессы изменяющие эти состояния, не вдаваясь в микроскопическое строение тел. В основе термодинамики лежит несколько фундаментальных законов, установленных опытным путем и имеющих весьма общий характер. Модель идеального газа Молекулярно-кинетическая теория рассматривает модель идеального газа, удовлетворяющую следующим условиям: 1) размеры молекул пренебрежимо малы, их принимают за материальные точки; 2) не учитываются силы взаимодействия между молекулами; 3) столкновение молекул друг с другом и со стенками сосуда считаются абсолютно упругими. Этим условиям удовлетворяют обычные газы при невысоких давлениях и температурах(например, воздух в комнате). Состояние некоторой массы газа определяется значением основных параметров: Р – давление, в СИ – системе измеряется в Па; V – объем, в СИ – системе измеряется в м3; Т – температура, в СИ измеряется в Кельвинах. Температура – физическая величина, характеризующая состояние термодинамического равновесия системы, обусловленная движением молекул. Соотношения, устанавливающие связь между параметрами, называются уравнениями состояния. Поведение идеальных газов описывается рядом законов, являющихся обобщением экспериментальных данных: 1. Закон Авогадро: моли любых газов при одинаковых температурах и давлениях занимают одинаковые объемы (моль – это такое количество вещества, масса которого численно равна его молекулярной массе). При нормальных условиях (Р=1,013333·105 Па, Т=273,15 К) объем моля равен 22,4·10-3 м3. По определению в одном моле различных веществ содержится одинаковое количество молекул, называемое числом Авогадро: NА=6,022·1023 моль-1. 2. Закон Дальтона: давление смеси идеальныхгазов равно сумме парциальных давлений газов, входящих в состав смеси:
Здесь Рi – парциальное давление, т.е. давление, которое оказывал бы один из газов смеси, если бы он один занимал весь объем, в котором находится смесь. 3. Уравнение Менделеева – Клапейрона, или уравнение состояния, связывающее между собой параметры идеального газа:
Здесь m – масса газа; μ – его молярная масса, Из формулы (6.1) можно выразить плотность вещества
|
||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 525; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

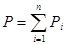
 (6.1)
(6.1) - число молей, R = 8,31 Дж/моль · К – универсальная газовая постоянная.
- число молей, R = 8,31 Дж/моль · К – универсальная газовая постоянная.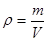 газа:
газа: